引言
在近年来的肿瘤学研究中,RAS蛋白家族在癌症发生和发展中扮演着至关重要的角色,其中KRAS、NRAS和HRAS是其最为重要的成员。这些小GTP酶在细胞增殖、分化和死亡的调控过程中起着核心作用。尤其是KRAS基因的突变,在多种癌症,包括胰腺癌(PDAC)、非小细胞肺癌(NSCLC)和结直肠癌(CRC)中发现有高频率的出现,因此,针对KRAS及其信号通路的治疗策略引起了广泛的研究兴趣。
RMC-7977是一种新型的小分子化合物,它通过与KRAS蛋白结合,特别是G12V KRAS突变体,形成可逆的三元复合物,从而干扰KRAS与RAS结合域(RBD)的结合。研究表明,RMC-7977在细胞内具有活性,能够抑制RAS信号通路的激活,包括磷酸化ERK(pERK)和细胞增殖。此外,RMC-7977对所有表达KRAS的细胞具有抑制作用,但对于不依赖RAS的BRAF(V600E)表达的MEFs细胞则没有影响,这表明其抑制作用是KRAS依赖的。
除了RMC-7977的细胞活性研究外,该化合物在动物模型中的抗肿瘤活性也引人注目。通过对869种人类肿瘤细胞系进行细胞活性测试,发现G12X KRAS突变型细胞系对RMC-7977特别敏感。此外,包括NRAS和HRAS突变型细胞系在内的其他KRAS野生型细胞系对RMC-7977也有反应,这进一步证明了RMC-7977广泛的潜在应用范围。
值得注意的是,RMC-7977对肿瘤生长的抑制作用在长达90天的治疗中保持稳定,表明其具有持久的抗肿瘤活性。此外,与现有的MEK和ERK抑制剂相比,RMC-7977在临床上可能提供一种新的治疗KRAS突变癌症的策略。
RMC-7977的开发为针对KRAS突变的癌症治疗提供了新的希望。通过抑制KRAS依赖的信号通路,RMC-7977不仅在细胞水平上显示出强大的抑制效果,而且在动物模型中也表现出显著的抗肿瘤活性。这些研究结果为未来的癌症治疗提供了重要的基础,特别是对于那些传统治疗方法效果不佳的KRAS突变癌症患者。随着更多的临床数据的积累,RMC-7977的应用前景将进一步明朗化。(4月8日 Nature “Concurrent inhibition of oncogenic and wild-type RAS-GTP for cancer therapy”)

Highlights
该研究的亮点在于发现并描述了RMC-7977,这是一种针对RAS蛋白(RAS proteins)的活跃状态下的突变型和野生型的广谱活性抑制剂。RMC-7977作为一种RAS(ON)多选择性抑制剂,展现了强大的临床前活性,尤其是针对携带G12X KRAS密码子12突变的癌症模型。此外,RMC-7977还能够抑制因RAS通路(RAS pathway)信号恢复而对KRAS(G12C)抑制剂产生抗药性的G12C KRAS癌症模型的生长。
该研究表明,RAS(ON)多选择性抑制剂能够靶向多种致癌和野生型RAS亚型,有望治疗广泛的RAS依赖性癌症,这些癌症在临床上有很高的治疗需求。研究中提到的另一种相关的RAS(ON)多选择性抑制剂RMC-6236,目前正在进行临床评估,针对的是KRAS突变的实体肿瘤患者(ClinicalTrials.gov:NCT05379985)。
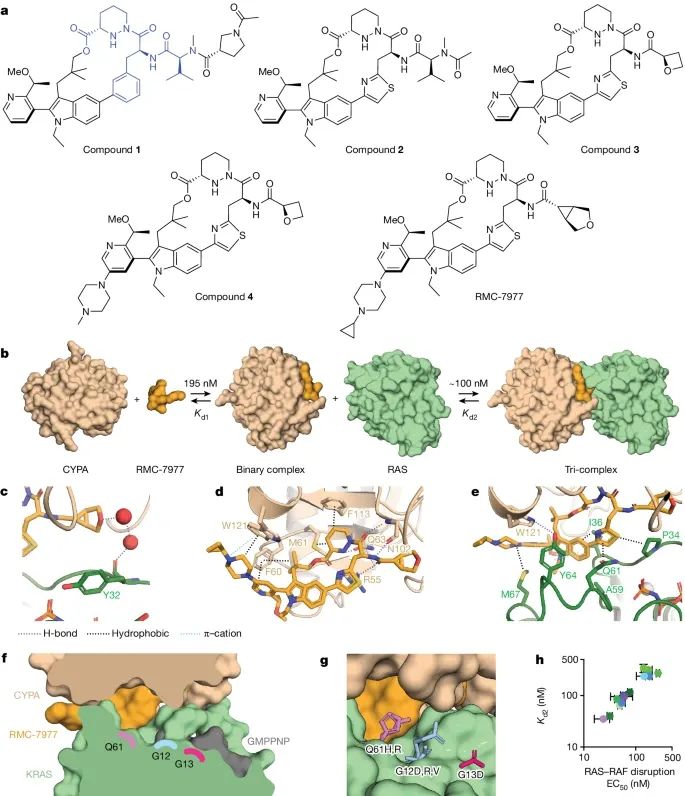
展示了RMC-7977如何通过多种机制抑制不同RAS变体的活跃状态。首先,化合物结构部分展示了化合物 1 的结构,其中CYPA结合基序以蓝色高亮显示。其次,三元复合物形成示意图显示了RMC-7977与CYPA之间的可逆结合(Kd1),以及该二元复合物与RAS之间的结合(Kd2)。接着,通过水的氢键网络部分表明RMC-7977的醚与RAS Y32的羰基之间形成了一个通过水的氢键网络(PDB ID: 8TBM)。在CYPA–RMC-7977结合部分,展示了涉及R55、吡嗪酸基团、F113、M61、双甲基基团、吡啶和F60的氢键。吡嗪的碱性氮与W121形成阳离子-π相互作用。由于与CYPA W121的氢键定位,RAS Y64与吡啶和吲哚基团形成π-π堆叠相互作用。SWI和SWII上的非极性侧链与RMC-7977形成疏水相互作用。三元复合物的结合方式在CYPA、KRAS和RMC-7977之间形成了一个开放的沟槽,该沟槽沿着Q61-G12-G13轴线。这个沟槽可以容纳致癌突变体中的大体积侧链,其中Q61、G12和G13的残基分别距离RMC-7977为3.5、7.5和9.7埃(PDB IDs: 8TBF, 8TBH, 8TBL 和 8TBM)。(Credit: Nature)
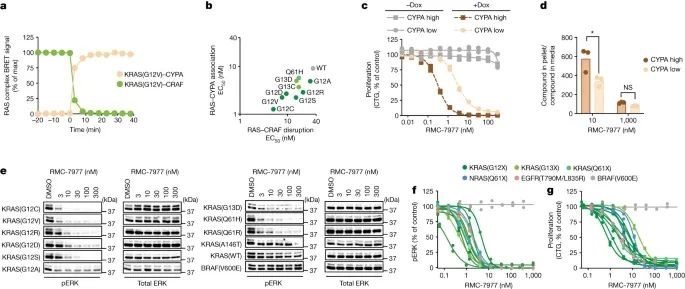
RAS抑制依赖于CYPA,并且对多种RAS变异具有活性。
a), b) 展示了RMC-7977处理后U2OS细胞中KRAS-CYPA复合物的形成及KRAS(G12V)-CRAF相互作用的破坏。这是通过时间序列实验来表达的,结果以最大信号百分比(% of max signal)来表示,并且展示了RAS-RAF抑制效力与多种KRAS变异形成三元复合物(tri-complex)之间的相关性(R²=0.7)。
c) 通过CellTiter-Glo (CTG) 分析了在RMC-7977处理120小时后,具有低或高CYPA表达水平的NCI-H358细胞的增殖情况。结果表明,与对照组相比,RMC-7977对这些细胞的抑制作用与CYPA的表达水平有关。
d) 使用液相色谱-质谱(LC-MS)分析了经过1小时RMC-7977处理的CYPA高表达和低表达NCI-H358细胞中RMC-7977浓度与培养基中RMC-7977浓度的比率。实验结果显示,这个比率在CYPA高表达细胞中明显高于低表达细胞(P=0.012)。
e) 通过Western blot展示了表达指定KRAS变异或BRAF(V600E)的同源MEF细胞,在经过24小时的RMC-7977或DMSO处理后的结果。
f), g) 通过pERK (AlphaLISA) (f) 和细胞增殖(CTG测定)(g) 水平来展示了经过4小时RMC-7977处理的人类癌细胞系(携带G12、G13或Q61突变的KRAS; Q61突变的NRAS;突变的EGFR;或BRAF V600E),与对照组相比,这些数据点显示了来自1至26次独立实验中的一次实验的生物学重复结果。
这部分的数据强调了RMC-7977在抑制不同KRAS变异的癌细胞增殖中的效力,并揭示了它与CYPA蛋白相互作用的重要性,这对于RMC-7977的抗癌活性至关重要。(Credit: Nature)
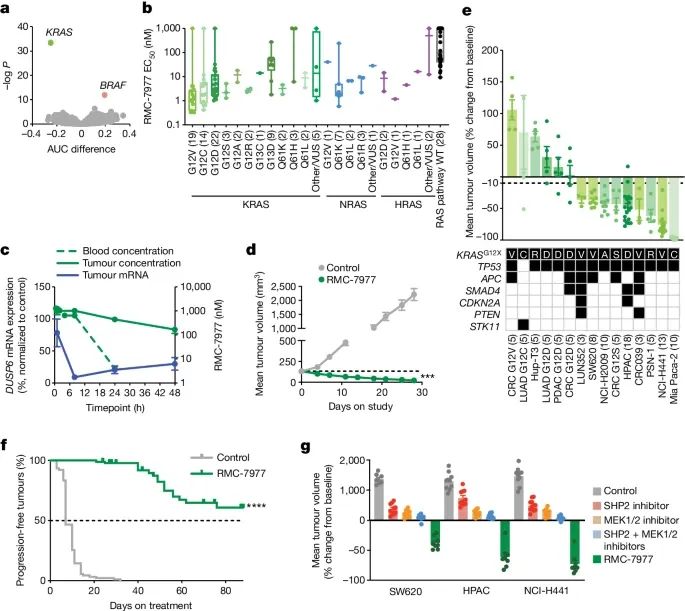
RMC-7977在对RAS-addicted的癌症模型中的广泛活性。
a) 揭示了不同基因型的细胞系间曲线下面积(AUC)差异与双侧Wilcoxon检验的负对数P值之间的关系。这里的点代表变异基因,负的AUC值表示对治疗的敏感性,正的AUC值表示抗药性。
b) 根据KRAS基因型的RMC-7977半抑制浓度(EC50),每个点代表一个细胞系。每组中的细胞系数量用括号标出。VUS代表未知意义的变异。
c) NCI-H441异种移植瘤在一次口服给药10 mg/kg RMC-7977后的血液和瘤体内RMC-7977(绿色)及DUSP6 mRNA(蓝色)的浓度。
d) 携带NCI-H441 CDX瘤体的小鼠,每天一次口服给药10 mg/kg RMC-7977治疗28天的结果。虚线显示了初始的平均肿瘤体积。
e) KRAS(G12X)异种移植模型在口服给药RMC-7977(10
f) KRAS G12X突变模型在每天一次口服10 mg/kg RMC-7977治疗下,肿瘤体积加倍时间的Kaplan-Meier分析(每组90只小鼠)。
g) 使用载体对照、SHP2抑制剂(每2天一次口服给药20 mg/kg RMC-4550)、MEK抑制剂(每天一次口服给药2.5 mg/kg cobimetinib)、联合SHP2和MEK抑制剂(每2天一次口服给药20 mg/kg RMC-4550和每天一次口服给药2.5 mg/kg cobimetinib)或每天一次口服给药10 mg/kg RMC-7977治疗的CDX模型。NCI-H441(KRAS G12V, NSCLC)和HPAC(KRAS G12D, PDAC)模型治疗了21天。SW620(KRAS G12V, CRC)治疗了28天。(Credit: Nature)
Strategies
研究首先通过基因编辑技术(CRISPR-Cas9)和功能遗传筛选(functional genetic screening)确定KRAS突变癌细胞系对RAS路径(RAS pathway)的依赖性,发现特定位置的KRAS突变(如G12位点的突变)与RAS致癌基因(oncogene)依赖性有关。这提示了以这些特定突变为靶点的治疗潜力。
接着,通过结构引导设计(structure-guided design)和优化先前发现的小分子化合物,研究团队发现了RMC-7977,并通过与CYPA(cyclophilin A)结合形成二元复合物(binary complex),再与活跃状态的RAS蛋白结合,形成三元复合体(tri-complex),从而抑制RAS蛋白与其效应器相互作用,中断下游信号传导。
为了验证RMC-7977的活性和选择性,研究人员利用了多种体外(in vitro)和体内(in vivo)模型,包括与RAS突变相关的多种癌症细胞系和小鼠模型。通过测定RMC-7977对这些模型中RAS信号通路激活状态的影响,以及对癌细胞增殖和肿瘤生长的抑制作用,验证了其作为RAS(ON)多选择性抑制剂(multi-selective inhibitor)的潜力。
此外,研究还探索了RMC-7977对于KRAS(G12C)抑制剂耐药的G12C KRAS癌症模型的治疗潜力,发现RMC-7977能够抑制因RAS路径信号重建而对G12C抑制剂产生耐药的癌细胞生长。
总体来说,该研究通过一系列体内外实验和结构生物学方法,发展了一种新型的RAS抑制剂RMC-7977,其针对广泛的RAS变体具有潜在的治疗效果,为RAS相关癌症治疗提供了新的策略。
Behind the Scenes
RMC-7977对RAS-GTP活性的抑制潜力
RMC-7977是一种具有广泛活性的可逆三元复合物(RAS inhibitor)抑制剂,针对活跃状态下的突变型和正常型KRAS、NRAS和HRAS变体(RAS variants)。通过形成与CYPA(Cyclophilin A)的二元复合物(binary complex),RMC-7977能有效地阻断RAS与下游效应物的相互作用,从而抑制肿瘤细胞中的RAS-GTP(Guanosine Triphosphate)信号传导。该药物展现了对RAS依赖型肿瘤的强效活性,特别是针对带有G12X KRAS变异的癌症模型。
RMC-7977的效力与选择性
RMC-7977通过与CYPA形成的三元复合物机制,展现出对KRAS相比于MRAS和其他与KRAS高序列同源性的RAS家族小GTPase蛋白具有更高的效力。这种机制依赖于RMC-7977与CYPA之间的强相互作用,该相互作用能够重塑CYPA的表面并创建出具有高亲和力的CYPA-复合物-KRAS三元复合物。该三元复合物能够在空间上阻挡KRAS与效应蛋白之间的相互作用,从而阻断下游信号传导。
RMC-7977的广泛活性与CYPA依赖性
RMC-7977在多种KRAS变体上展示了广泛的活性,这归功于其对CYPA的依赖性。CYPA的结合对于RMC-7977抑制RAF-MEK-ERK信号通路和细胞增殖至关重要。研究表明,使用竞争性CYPA抑制剂或通过基因敲除PPIA(编码CYPA的基因)都能证实CYPA结合是RMC-7977在细胞中活性所必需的。然而,值得注意的是,这种依赖性并不妨碍药物对其他RAS信号通路抑制剂(如trametinib)的敏感性,这表明RMC-7977在RAS信号通路抑制上提供了一种独特的作用机制。
RMC-7977在抗癌治疗中的潜力
由于RMC-7977能够同时抑制肿瘤细胞中的致癌和正常RAS-GTP活性,它在治疗RAS依赖型癌症中展现了巨大的潜力。特别是在那些对当前RAS(G12C)抑制剂产生抗性的癌症模型中,RMC-7977通过恢复RAS通路信号的抑制,显示出对这些抗性模型的有效性。这为RAS(G12C)抑制剂的耐药性问题提供了可能的解决方案,并为RAS依赖型癌症的治疗开辟了新的途径。
RMC-7977对KRAS变体细胞的作用谱
研究表明RMC-7977是一种针对RAS蛋白活性状态的广谱抑制剂,具有针对突变型和野生型KRAS、NRAS和HRAS变体的高效活性。通过对不同的KRAS基因型细胞模型进行预临床测试,RMC-7977展示了对G12X KRAS突变的肿瘤模型具有强大的活性,特别是对那些因RAS通路信号恢复而对KRAS(G12C)抑制剂产生抵抗的G12C KRAS癌症模型。
pERK抑制的KRAS依赖性
实验发现,RMC-7977能够抑制所有表达KRAS蛋白的细胞中的磷酸化细胞外信号调节激酶(pERK)水平。pERK作为RAS信号通路的关键组成部分,其抑制表明RMC-7977的抗肿瘤作用是通过直接作用于KRAS来实现的。尽管不同KRAS突变体之间存在细微但一致的差异,RMC-7977对各种KRAS基因型细胞的pERK抑制效果表明了其广谱的疗效。
对G12X KRAS突变细胞的高度敏感性
RMC-7977对G12X KRAS突变细胞株表现出特别高的敏感性,这可能与不同肿瘤中KRAS突变的生化特性有关。在G12X KRAS突变癌细胞中,RMC-7977不仅能够完全抑制pERK的活性,还能持续抑制RAF、ERK以及ERK底物RSK的磷酸化,表明其能够持久抑制RAS信号通路并诱导凋亡。这一发现强调了RMC-7977在针对特定KRAS突变型肿瘤中的潜在临床价值,尤其是在其他RAS通路抑制剂治疗失败的情况下。
RMC-7977的体内药效学和抗肿瘤活性
RMC-7977作为一种创新的药物,其在体内模型中的药效学(pharmacodynamics)和抗肿瘤活性评估显示出了显著的效果。通过对NCI-H441肿瘤模型的研究,RMC-7977展现出了良好的药物动力学特性(pharmacokinetics),在给药后能迅速达到肿瘤组织,且在肿瘤组织中展现出较长的药物暴露时间。具体表现为,单次口服给药10 mg/kg RMC-7977后,能在8小时内最大限度地抑制肿瘤内DUSP6水平达91%,随后这一效果在48小时内逐渐减弱,与肿瘤中RMC-7977浓度的下降相一致。这种药效的持久性,指示了RMC-7977可能具有较广的治疗指数(therapeutic index)。
CYPA蛋白在肿瘤中的作用
值得注意的是,CYPA (Cyclophilin A)蛋白在肿瘤组织中的表达较正常组织有所增加。CYPA的高表达不仅在肿瘤的维持中扮演了重要角色,而且对于RMC-7977在肿瘤中的分布和细胞内保留也具有重要影响。在15种不同的细胞系中,CYPA的中位浓度为12.3 µM,且在细胞源性异种移植瘤(cell line-derived xenograft, CDX)肿瘤体内比在体外培养的相应细胞中表达更高。这一发现表明,CYPA的高表达可能为RMC-7977提供了高效的细胞内靶点,从而增强了其在肿瘤组织中的药效。
潜在的局限性
该研究虽然在RAS(ON)多选择性抑制剂RMC-7977的开发与评估方面取得了显著进展,但仍存在一些局限性。
首先,虽然RMC-7977在体外(preclinically)展现出了针对RAS依赖型肿瘤的强效活性,但其在临床环境中的疗效和安全性还需进一步验证。临床试验(clinical trials)的结果将对RMC-7977作为癌症治疗药物的潜力提供更加确凿的证据。
其次,RMC-7977对于所有KRAS、NRAS和HRAS变体的广泛活性虽然是一个优势,但这种广谱性也可能导致非特异性作用(non-specific effects),从而影响其在特定癌症治疗中的应用。
此外,尽管研究表明RMC-7977对于KRAS(G12C)抑制剂耐药的G12C KRAS癌症模型具有抑制作用,但对于其他潜在耐药机制的有效性尚不清楚。
最后,RMC-7977的作用机制涉及与CYPA的结合,这需要考虑CYPA在不同肿瘤和患者中的表达差异以及可能的变异,这些因素都可能影响RMC-7977的效果和适应症。
潜在的研究方向
RMC-7977和其他RAS(ON)多选择性抑制剂的进一步优化和评估:目前已经证明RMC-7977在抑制RAS依赖性肿瘤中显示出潜力,尤其是针对不同RAS基因突变(包括KRAS、NRAS和HRAS)的肿瘤模型。未来的研究可以进一步优化这类药物的药效和安全性,以及探索它们在临床上的应用。
抗药性机制的研究:尽管RMC-7977能够克服一些因RAS通路信号恢复而导致的抗药性,但肿瘤细胞可能会通过其他机制发展出对RMC-7977的抗性。研究这些潜在的抗药性机制,以及如何通过组合疗法或新型抑制剂来克服这些抗性,将是未来研究的重点。
对RAS(ON)多选择性抑制剂与其他癌症治疗策略的联合应用的探索:考虑到癌症治疗的复杂性,将RMC-7977或其他RAS(ON)抑制剂与其他治疗手段(如化疗、免疫疗法或其他分子靶向疗法)结合使用,可能会提高治疗效果。未来的研究可以探索这些组合疗法的最佳方案和潜在益处。
RAS依赖性肿瘤的更深入理解:虽然RAS基因突变在许多癌症中很常见,但对RAS蛋白在肿瘤发展中的具体作用以及如何最有效地靶向RAS通路仍需更多了解。研究RAS基因家族在不同癌症和细胞环境中的作用,可以揭示新的治疗靶点和策略。
原文链接
Holderfield M, Lee BJ, Jiang J, Tomlinson A, Seamon KJ, Mira A, Patrucco E, Goodhart G, Dilly J, Gindin Y, Dinglasan N, Wang Y, Lai LP, Cai S, Jiang L, Nasholm N, Shifrin N, Blaj C, Shah H, Evans JW, Montazer N, Lai O, Shi J, Ahler E, Quintana E, Chang S, Salvador A, Marquez A, Cregg J, Liu Y, Milin A, Chen A, Ziv TB, Parsons D, Knox JE, Klomp JE, Roth J, Rees M, Ronan M, Cuevas-Navarro A, Hu F, Lito P, Santamaria D, Aguirre AJ, Waters AM, Der CJ, Ambrogio C, Wang Z, Gill AL, Koltun ES, Smith JAM, Wildes D, Singh M. Concurrent inhibition of oncogenic and wild-type RAS-GTP for cancer therapy. Nature. 2024 Apr 8. doi: 10.1038/s41586-024-07205-6. Epub ahead of print. PMID: 38589574.
https://www.nature.com/articles/s41586-024-07205-6