
在2-5%的结直肠癌(CRC)患者中,HER2扩增或过表达。尽管之前有证据表明,抗HER2治疗可使其中1/3的患者产生临床获益(CB),但在欧洲,抗HER2治疗尚未被批准用于这一适应证。在“药物再发现协议(Drug Rediscovery Protocol,DRUP)”中,根据分子谱患者接受了超说明书用药治疗。在本文中,研究者报告了“曲妥珠单抗/帕妥珠单抗治疗RAS/BRAF野生型HER2扩增的转移性CRC(HER2+mCRC)难治性患者”队列的结果。有可测量病变的进展难治性RAS/BRAF野生型HER2+mCRC患者被纳入曲妥珠单抗联合帕妥珠单抗治疗。DRUP的主要终点是CB(定义为经证实的客观缓解(OR)或疾病稳定(SD)≥16周)和安全性。采用类Simon 2阶段模式纳入患者,第一阶段8例,第二阶段24例(如果至少1/8的患者获得CB)。为了确定预测反应缓解的生物标志物,研究者对治疗前的活检样本进行了全基因组测序(WGS)。
在24例可评估的HER2+mCRC患者中,11例(46%)观察到CB,7例获得了OR(29%)。中位缓解持续时间为8.4个月。患者之前接受的治疗线数中位数为3。中位无进展生存期和总生存期分别为4.3个月(95%CI 1.9-10.3)和8.2个月(95%CI 7.2-14.7)。未观察到意外毒性。在可获得WGS数据的患者中,WGS为3/10例无CB患者的耐药提供了可能的解释。这项研究的结果证实了曲妥珠单抗联合帕妥珠单抗治疗HER2+mCRC患者的临床显著获益。
-
2-5%的结直肠癌患者存在HER2扩增或过表达;
-
曲妥珠单抗联合帕妥珠单抗治疗使近一半的HER2+mCRC患者获得临床获益;
-
曲妥珠单抗联合帕妥珠单抗治疗的耐受性良好;
-
全基因组测序数据可能揭示曲妥珠单抗联合帕妥珠单抗治疗的潜在耐药机制。
研究背景
结直肠癌每年占全球癌症诊断和癌症相关死亡的10%。确诊时,20%的患者有转移性CRC(mCRC), 5年生存率低于20%。基因组技术的最新进展以及大规模肿瘤分子谱分析为这些患者带来了新的治疗机会。
在约2-5%的CRC患者中,观察到HER2过表达或扩增,其在左半结肠和原发性直肠RAS/ BRAF野生型(RAS/BRAFwt)肿瘤中的发生率较高。目前,左侧RAS/BRAFwt肿瘤患者接受抗EGFR(即帕尼单抗或西妥昔单抗)联合或不联合化疗和/或抗VEGF治疗。然而,越来越多的证据表明HER2的扩增或过表达与抗EGFR治疗的耐药相关。ERBB2是一个众所周知的致癌基因,在乳腺癌、胃癌和食管癌中都有成功的靶向药物。最近的报告表明,HER2阳性mCRC(HER2+mCRC)患者也可从抗HER2治疗中获益。因此,美国食品药品监督管理局(FDA)于2023年1月批准了图卡替尼联合曲妥珠单抗治疗在氟嘧啶、奥沙利铂和伊立替康化疗后进展的RASwt HER2+mCRC。根据TRIUMPH试验,日本厚生劳动省监管部门已批准曲妥珠单抗联合帕妥珠单抗治疗HER2+mCRC患者。
尽管有很有前景的数据,但欧洲尚无针对HER2+mCRC患者的靶向治疗。这主要是因为在小亚组患者(如HER+mCRC患者)中开展的单组研究难以获得监管机构的批准。将抗HER2药物作为这些患者的标准治疗方案显然尚未得到满足。在本文中,研究者描述了“药物再发现协议(DRUP)”队列的治疗结果,在该队列中,难治性HER2+mCRC患者接受了曲妥珠单抗联合帕妥珠单抗治疗,以加强这一患者群体的临床相关治疗选择的证据。
在DRUP研究中,已用尽所有标准治疗方案的晚期癌症患者根据其肿瘤分子谱接受了超出其说明书适应证的注册靶向治疗。本研究旨在描述这些市售靶向疗法在其批准适应证之外使用的抗肿瘤活性和毒性。此外,为了进行探索性生物标志物分析,研究者对治疗前的活检样本进行了全基因组测序(WGS)。
研究方法
符合条件的患者在所有标准mCRC治疗线上均发生进展。HER2阳性的定义为在原发肿瘤或转移病灶中通过基于panel的二代测序(NGS)、WGS或原位杂交估计出至少有7个HER2拷贝数。有KRAS、NRAS或BRAF致病性突变的患者被排除。
研究结果
患者:
2016年10月至2023年2月在参与DRUP的荷兰13家医院接受治疗的27例HER2+mCRC患者被纳入。所有患者均被纳入基线特征和安全性分析。在这些患者中,3例患者无法根据研究方案评估主要终点。
27例接受治疗患者的基线特征见表1。中位年龄为60岁(范围:31-81),56%为男性(n=15)。大多数(n=24,88%)肿瘤位于左侧。78%的患者接受过3线或3线以上的系统治疗。


表1
临床获益和生存:
在2023年8月数据截止时,5例患者仍存活,中位随访时间为6.3个月(IQR 5.5-9.1)。在24例可评估的患者中,46%(n=11)在曲妥珠单抗联合帕妥珠单抗治疗后获得CB。ORR为29%(n=7),所有患者均达到了PR。图1显示了每例患者的靶病变总和的最大变化。中位PFS和OS分别为4.3个月(95%CI 1.9-10.3)和8.2个月(95%CI 7.2-14.7)(图2A和B)。图3显示患者的中位治疗时间为15.1周(95%CI 6.0-24.7)。OR患者的中位DoR(缓解持续时间)为8.4个月(95%CI 5.4-未达到)。所有有反应的患者均有至少3个月的DoR,其中5/7的患者达到6个月的DoR,2/6的患者达到1年的DoR。GMI(生长调节指数)中位数为1.20(范围:0.24-11.19)。GMI>1.33的共11例(46%),13例(54%)患者的GMI<1.33. 终止治疗的主要原因为疾病进展(n=21,81%)。3例(12%)患者因症状恶化停止治疗,1例(4%)患者因毒性,1例(4%)患者在研究治疗期间死亡。1例(4%)患者仍在接受研究治疗。
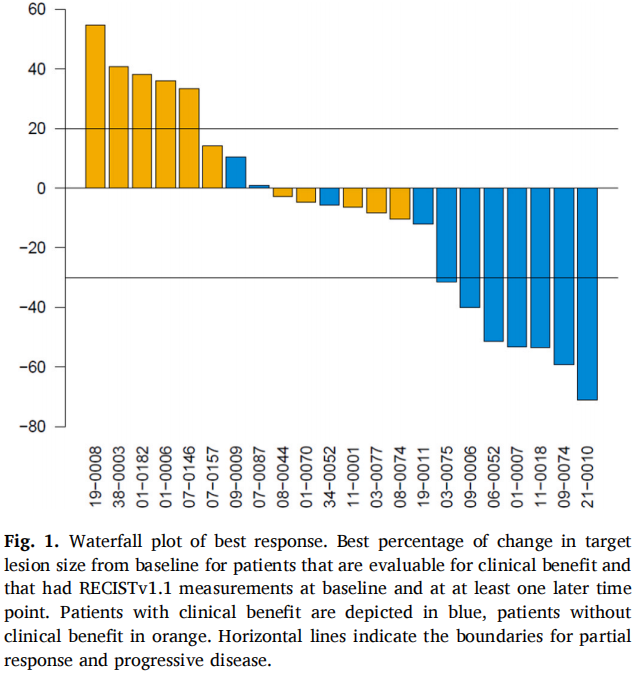
图1
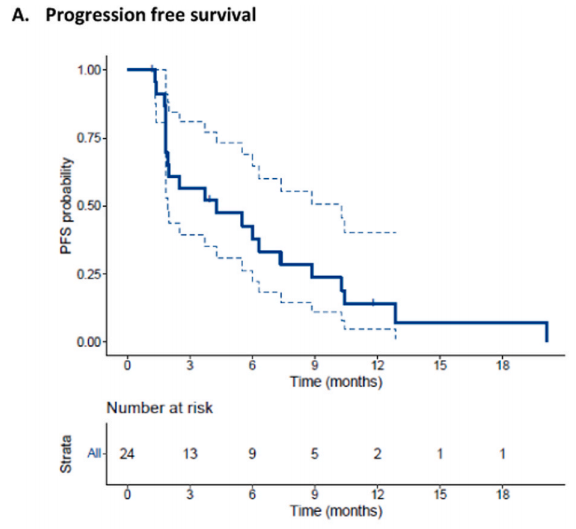
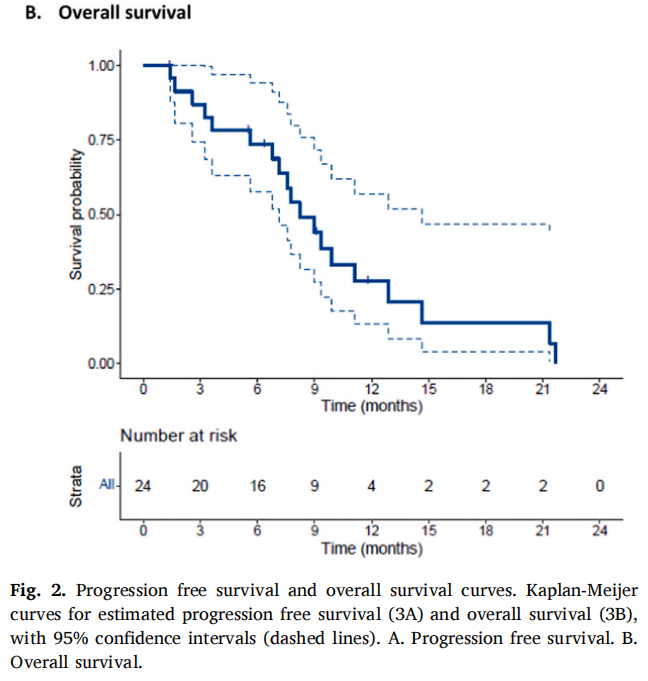
图2

图3
安全性:
总体而言,曲妥珠单抗联合帕妥珠单抗的耐受性良好,没有任何新的安全信号。16例患者共发生27起≥3级AEs(不良事件),其中6起可能、很可能或肯定与研究治疗相关。10例患者共报告15起SAEs(严重不良事件),其中2起与研究治疗相关。1例PR患者死亡(5级SAE),原因不明,但治疗医师认为与研究治疗无关。表2列出了所有与治疗相关的≥3级AEs和观察到的SAEs。

表2
基线活检和WGS结果:
所有可评估的患者在治疗前均接受了强制性的转移灶活检:肝(n=15)、肺(n=4)、淋巴结(n=3)、骨(n=1)和阴道(n=1)。17例(71%)活检标本成功测序,其中PR 5例,SD 2例,无CB 10例。其余7例活检因肿瘤细胞百分比低而不适合测序。WGS检测到的所有潜在驱动因素如图4所示。最常发现的伴随潜在驱动基因是TP53和APC突变。在有和没有CB的患者中,HER2拷贝数的中位数分别为141(范围:26-268)和73.5(范围:0-310)。未观察到HER2拷贝数和CB之间存在相关性。此外,HER2拷贝数与PFS或OS无关。值得注意的是,在有或无CB的患者之间,潜在驱动基因变异的中位数量有显著差异的趋势(4 vs 5.5;p=0.052)。所有CB患者均有≤4个其他潜在驱动突变。此外,研究者发现,与携带>4个其他潜在驱动基因突变的患者相比,携带≤4个其他潜在驱动基因突变的患者具有显著较长的PFS(p=0.0056)和OS(p=0.05)。在HER2拷贝数高于中位值(即90个拷贝)且曲妥珠单抗联合帕妥珠单抗治疗无效的患者中(n=4),3例患者有>4个潜在其他驱动突变。10例无CB的患者获得了基因组数据。对于其中3例患者,研究者可以提出无反应性的合理推测:在2例患者中,WGS无法证实纳入的靶点(即通过FISH评估的HER2扩增);在1例患者中,WGS显示KRAS突变(p.Gly12Cys)。在另外7例患者中,WGS未揭示任何已知的治疗耐药机制。然而,在4例无CB患者中发现FLT3扩增,也激活RTK/RAS通路。
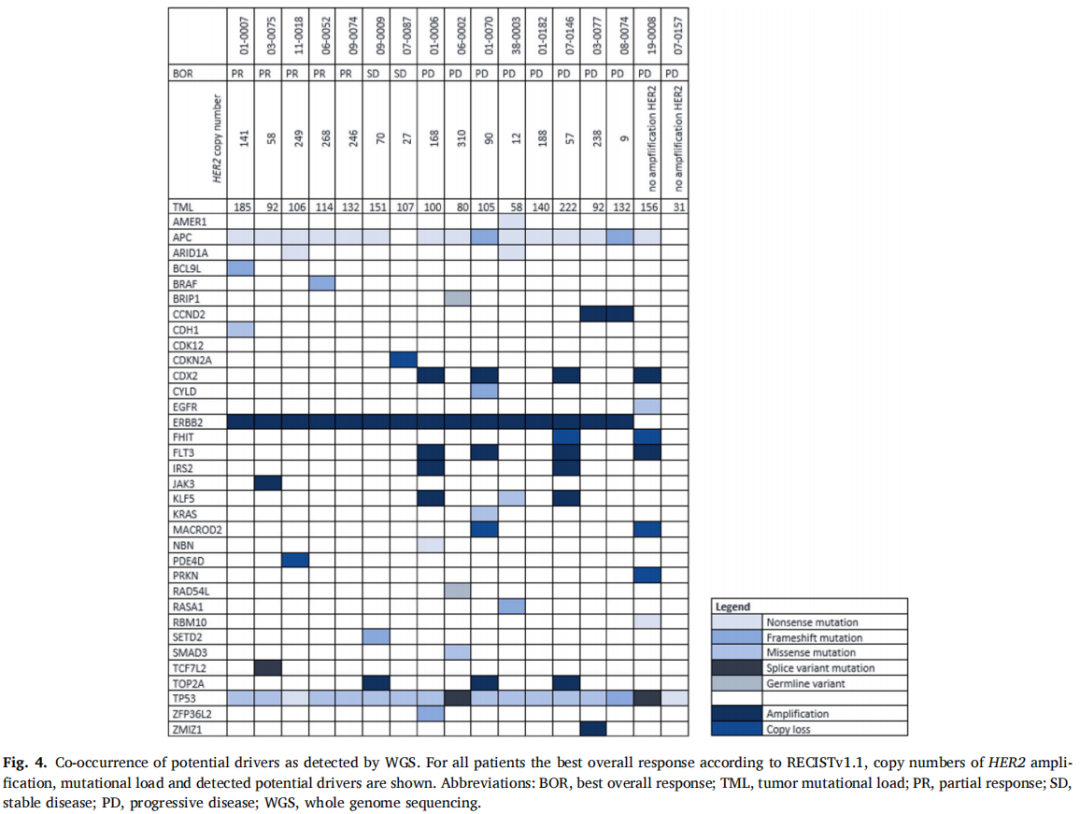
图4
讨 论
在当前的DRUP队列中,既往接受过大量治疗的HER2+mCRC患者接受了曲妥珠单抗联合帕妥珠单抗治疗。曲妥珠单抗联合帕妥珠单抗治疗后,47%的HER2+mCRC患者达到CB, ORR为29%,中位PFS和OS分别为4.3个月和8.2个月。在2-5%的mCRC患者中观察到HER2扩增,尽管越来越多的证据表明抗HER2治疗具有临床显著益处,但该治疗方案在欧洲仍缺乏批准。
目前已有4项单臂研究评估了曲妥珠单抗联合帕妥珠单抗治疗HER2+mCRC患者的效果。这些试验的结果具有高度可比性。尽管这些试验中的大多数患者既往接受过大量治疗(定义为既往接受过≥3线全身性治疗),但报告的ORR仍然非常高(25-32%)。与已批准的抗EGFR治疗(15-20%)或曲氟尿苷/替匹嘧啶(2%)三线治疗的ORR相比,这一点尤其显著。曲氟尿苷/替匹嘧啶治疗经选择的难治性CRC患者的中位OS为5.3-15.2个月。然而,根据TRIUMPH、MyPathway、TAPUR和DRUP的结果,曲妥珠单抗联合帕妥珠单抗治疗HER2+mCRC患者的中位OS为8.2-15.0个月。除疗效数据外,所有试验均收集了安全性数据,均未报告意外毒性。此外,本研究中观察到的可能、很可能或肯定相关的AEs均与药品说明书一致,包括腹泻、多形红斑、输液反应和左心功能不全。
越来越多的抗HER2治疗方案在HER2+mCRC患者中显示出良好的疗效。在HERACLES-A试验中,27例难治性HER2+mCRC患者接受了曲妥珠单抗联合拉帕替尼(一种酪氨酸激酶抑制剂)治疗。试验报告的ORR为30%。相反,HERACLES-B单臂2期试验,用帕妥珠单抗联合恩美曲妥珠单抗(T-DM1,ADC)治疗难治性HER2+mCRC患者,报告的ORR较低,为9.7%,但SD为67.7%。FDA批准图卡替尼联合曲妥珠单抗是基于MOUNTAINEER试验,该试验在84例HER2+mCRC患者中评估了图卡替尼联合曲妥珠单抗的疗效。试验报告的ORR为38%,中位DoR为12.4个月。在DESTINY-CRC01试验中,HER2 +mCRC患者接受了德曲妥珠单抗(T-DXd,一种靶向HER2的抗体-药物偶联物)治疗,获得了45.3%的高ORR。
这些累积的数据表明,约1/3的难治性HER2+mCRC患者将从抗HER2治疗中获益。美国NCCN已经建议对mCRC患者进行HER2扩增检测,并认为抗HER2靶向治疗是HER2 +mCRC患者的相关选择。
推进HER2+ mCRC抗HER2治疗策略的关键后续步骤包括开发生物标志物,以加强患者选择并最终提高CBR(临床获益率)。有证据表明,RAS、PIK3CA和BRAF变异与抗HER2治疗耐药相关。因此,尽管有RAS和BRAF变异的患者不应单独接受抗HER2治疗,但正如DESTINY-CRC01试验所报告的那样,他们可能能够从T-Dxd中获益。本队列的生物标志物分析揭示了3例无CB的患者对治疗耐药的推测:1例患者有KRAS共突变,2例患者可能由于肿瘤的异质性,无法证实HER2扩增。然而,已知约有1/3的乳腺癌患者存在HER2状态转变,这可能也适用于CRC患者。在抗EGFR治疗过程中,除了HER2状态转变外,还可能出现HER2扩增。在其他4例无CB的患者中,发现FLT3扩增,可能在抗EGFR治疗期间获得,并可能通过激活RTK/RAS通路与耐药相关。然而,据研究者所知,目前还没有临床前数据支持FLT3扩增和抗HER2治疗耐药之间的关联。值得注意的是,在本试验中,所有有4个以上潜在辅助驱动突变的患者接受曲妥珠单抗联合帕妥珠单抗治疗均失败,这提示单独靶向HER2不足以抑制肿瘤生长。联合多种靶向治疗可能会克服这些患者的耐药。因此,在开始抗HER2治疗前进行分子检测以确认HER2阳性和确定可能的耐药机制是至关重要的。在某些情况下,特别是在已知HER2扩增的患者中,ctDNA有可能用于确认,从而避免有创活检。MyPathway研究提示,拷贝数高于中位数的患者比拷贝数低于中位数的患者有更高的缓解率。本研究未发现HER2拷贝数与CB、PFS和OS相关,可能与样本量较小有关。此外,与PD患者相比,对治疗反应最好的患者之前接受的治疗较少,这表明抗HER2可能在其疾病过程的早期更有效。目前,MOUNTAINEER-03试验正在进行中,目的是研究在HER2+mCRC患者中,抗HER2治疗是否比标准治疗在一线治疗中更有效(ClinicalTrials.gov,注册号:NCT05253651)。
本研究的局限性是未随机分组,未设对照组,患者队列相对较小。尽管如此,研究者认为这些结果仍有价值,因为越来越多的证据表明抗HER2治疗对HER2+mCRC患者有效,这为欧洲批准抗HER2治疗这些患者铺平了道路。需要通过进一步的研究来确定生物标志物,从而更好地选择患者,并确定HER2检测和抗HER2治疗的时机。
参考文献:
Spiekman, Ilse A C et al. “Trastuzumab plus pertuzumab for HER2-amplified advanced colorectal cancer: Results from the drug rediscovery protocol (DRUP).” European journal of cancer (Oxford, England : 1990), vol. 202 113988. 7 Mar. 2024, doi:10.1016/j.ejca.2024.113988
