在接受超声引导下甲状腺活检的患者中,约25%的患者最终以细胞学结果不确定告终。这推动了分子检测等其他方法的应用,以进一步对这些患者进行分层。在甲状腺结节的检查中,分子检测被用作形态学评估的辅助手段。本研究调查了RET/PTC和THADA/IGF2BP3融合的影响,这两个基因融合在甲状腺肿瘤中被描述为致癌事件。本研究为回顾性、单中心研究,于2016年1月至2021年8月在加拿大蒙特利尔麦吉尔大学教学医院进行。研究纳入了因甲状腺结节接受手术,并且术前接受了分子检测,显示RET/PTC或THADA/IGF2BP3基因融合的患者。
本研究纳入了697个连续手术治疗的甲状腺结节,通过分子检测进行评估,其中5个有RET/PTC融合,7个有THADA/IGF2BP3融合。RET/PTC组的5个结节中,100%为恶性,表现为Bethesda V/VI级。80%(4/5)的患者有淋巴结转移。20%(1/5)有甲状腺外侵犯。60%(3/5)为弥漫硬化型甲状腺乳头状癌,其余为经典型甲状腺乳头状癌。7个THADA/IGF2BP3融合结节均表现为Bethesda III/IV级,71.4%(5/7)为恶性,28.6%(2/7)为乳头状核特征的非侵袭性滤泡性甲状腺肿瘤(NIFTP)。THADA/IGF2BP3融合恶性肿瘤均为滤泡型甲状腺乳头状癌。均无淋巴结转移或甲状腺外侵犯。
RET/PTC融合结节表现为Bethesda V/VI级,具有更强的侵袭性,而THADA/IGF2BP3融合结节表现为Bethesda III/IV级,具有更强的惰性行为。这一认识可能使临床医师制定更有针对性的治疗方案,如手术范围和辅助放射性碘治疗。
研究背景
癌症是最常见的内分泌恶性肿瘤。近几十年来,其发病率稳步上升,这可归因于诊断模式的进步,有助于在疾病过程的早期发现甲状腺结节。超声引导下细针穿刺(USFNA)是可疑甲状腺病变检查的金标准。尽管细胞病理学将大多数活检归类为良性或恶性,但仍有20-25%的结节被归类为不确定类型,即Bethesda III(意义未明的异型性)和Bethesda IV(滤泡性肿瘤或可疑滤泡性肿瘤)。这推动了分子检测领域作为进一步诊断和预测甲状腺结节的并行方式的发展。
美国甲状腺学会(ATA)指南的最新版本表明,在细胞学不确定的结节检查中,分子检测可作为USFNA的辅助手段,前提是对患者进行有关基因检测益处和局限性的教育。ATA指南还讨论了特定突变的侵袭行为,以预测复发风险,并指导术后管理。寻找分子标志物对于区分良恶性肿瘤、预测侵袭性表型、预后、复发和治疗效果至关重要,其中包括潜在的新型治疗靶点。
Bethesda分级系统基于FNA活检的细胞病理学特征。II级代表潜在的良性甲状腺结节,建议使用超声和/或血液检查进行监测,并且显著增长的机会仍然低到不需要手术干预。中级Bethesda分级(III/IV)代表意义不明的滤泡病变/异型性。许多文献关注在这一有问题的实体,恶性病理的概率在不同机构和地区之间经常显著波动。Bethesda分级V包括具有甲状腺恶性病理特征的可疑病变,但不能确定为恶性病变;Bethesda分级VI被推测为恶性,并转诊接受手术治疗。
甲状腺癌有多种类型,其表现、侵袭性、生存率和治疗方法各不相同。最常见的类型是乳头状甲状腺癌(PTC)和滤泡性甲状腺癌(FTC),这两种癌加起来约占所有病例的90%。同样,PTC的几种变异型在患病率、侵袭性和危险因素方面也存在差异。与本研究相关的最具侵袭性的变异型之一是弥漫性硬化变异型(DSV),最常在年轻患者中观察到。其侵袭性强,易发生腺外侵犯、颈部淋巴结转移和复发。
FTC的一个亚型是嗜酸性细胞癌(也称Hürthle细胞癌,HCC),它比FTC更具侵袭性,约占所有病例的3%。FTC的另一种亚型是具有乳头状核特征的非浸润性甲状腺滤泡性肿瘤(NIFTP),以前被归类为PTC的一种类型。
分子生物学研究发现了许多甲状腺癌的致癌驱动基因。在已知的驱动因素中,75%被描述为染色体点突变,15%显示非重叠的染色体重排,通常导致酪氨酸激酶的激活,10%没有确定的驱动因素。除了诊断能力之外,分子检测在未来还可能有助于提供靶向治疗,从而抑制甲状腺肿瘤发生过程中异常驱动通路的活性。事实上,分子疗法的出现现在被认为是治疗某些甲状腺未分化癌(ATC)的金标准,ATA指南建议测定BRAF基因的突变状态。具体而言,达拉非尼在BRAF突变的甲状腺癌中显示出一定的疗效,尤其是与MEK抑制剂(如曲美替尼)联合使用时。
一个值得探索的的重排基因是RET。RET是一种与PTC和甲状腺髓样癌(MTC)相关的原癌基因。RET基因位于10号染色体长臂,编码一种细胞膜酪氨酸激酶,其激活后刺激MAPK和PI3K,促进下游细胞增殖。RET/PTC是指RET与一种不同的异源基因发生融合,产生一系列嵌合癌基因。这种重排反过来产生一种激活MAPK通路的蛋白质。据报道,RET/PTC在成人散发性乳头状癌中高达20-40%,然而,其发生率在的研究中有很大的差异。RET/PTC易位也与肿瘤多灶性有关。RET/PTC融合已被证明与其他突变共存,即恶性PTC中的BRAF(V600E)。RET/PTC融合也不同于RET点突变,后者是RET基因DNA序列的单一变化。这些点突变可以遗传的或获得性的,并与MTC有关。
另一个值得探索的基因重排是指THADA基因融合,这是甲状腺癌中第二常见的染色体重排。据推测,在缺乏任何其他可识别的驱动突变的甲状腺癌中,约有5%的发生率。Panebianco等人最近的研究阐明了THADA基因融合导致细胞生长、迁移和侵袭增加的机制。染色体2p21带(THADA)和7p15之间的易位导致IGF2过表达,从而激活下游MAPK和PI3K信号通路。它也可发生于其他类型的癌症,如乳腺癌、卵巢癌、肺癌和结直肠癌。
迄今为止,已有多项研究评估了这两种基因重排的发生率和临床病理特征。少数研究报告了RET/PTC融合发生率,且方差较大。Morariu等人最近研究了THADA/IGF2BP3融合,据报道,在细胞学不确定的甲状腺结节中,THADA/IGF2BP3融合的发生率为2%。本研究的目的是确定RET/PTC和THADA/IGF2BP3融合在本队列患者人群中的发生率,并研究其组织病理学、治疗和手术结果。这些见解将有助于有这些分子变异之一的患者的术前/围手术期决策。
研究结果
流行病学:
在研究期间,在术前检查中使用分子分析对697个连续甲状腺结节进行了分析。在这些甲状腺结节中,377个在USFNA上为Bethesda III或IV级,312个在USFNA上为Bethesda V或VI级(图1)。在Bethesda III级结节中,最终的组织病理学分析显示,总共165个结节中有105个(64%)为恶性或非浸润性滤泡性甲状腺肿瘤伴NIFTP;在 Bethesda IV 级结节中,最终组织病理学分析显示,总共212个结节中有159个(73%)为恶性或NIFTP。
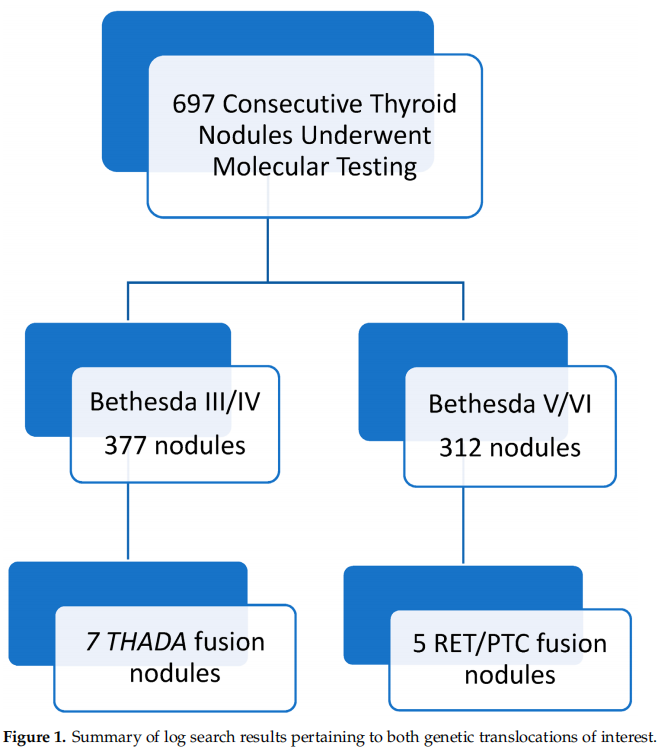
图1
所有USFNA活检显示RET/PTC融合阳性的结节报告为Bethesda V或VI级,所有USFNA活检显示THADA/IGF2BP3融合阳性的结节报告为Bethesda III或IV级。在USFNA显示Bethesda V或VI级的312个结节中,5个(1.60%)为RET/PTC融合阳性。在USFNA Bethesda III或IV级的377个结节中,THADA/IGF2BP3融合阳性结节7个(1.86%)。总体而言,所有RET/PTC或THADA/IGF2BP3融合的结节在最终的组织病理学分析中要么为恶性,要么为NIFTP。
基线特征:
评估了所有12例患者的基线信息。根据最终病理报告中肿瘤长轴厘米测量值报告肿瘤大小。基线特征见表1。RET/PTC融合组和THADA/IGF2BP3融合组在年龄、性别或最终病理肿瘤大小方面无显著统计学差异(分别为p=0.064,p=0.154和p=0.104)。RET/PTC融合的Bethesda分级高于THADA/IGF2BP3融合(p<0.01)。除了有限的中央颈清扫术外,所有患者均在术中接受了前哨淋巴结(LN)活检。如果前哨淋巴结阳性,则由外科医生进行更广泛的中央区颈淋巴结清扫术。
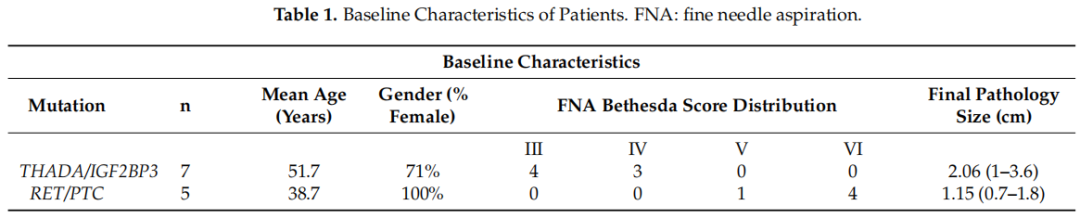
表1
癌症类型及其与临床病理特征的相关性:
5例RET/PTC融合病例均表现为Bethesda V/VI级。最终病理结果均为恶性:60%(3/5)为弥漫性硬化变异(DSV),其余为经典型PTC。DSV均有脉管侵犯,经典变异型均无脉管侵犯。所有结节均未见神经侵犯。仅1例(1/5)腺外侵犯(轻微)。最终的病理结果显示,80%(4/5)的患者有淋巴结转移,其中1例为淋巴结结外转移(ENS)。所有患者均接受了一次前哨淋巴结活检,如果前哨淋巴结活检阳性,外科医生继续进行中央区淋巴结活检(表2)。所有阳性淋巴结的最短长度均至少为0.2 cm。
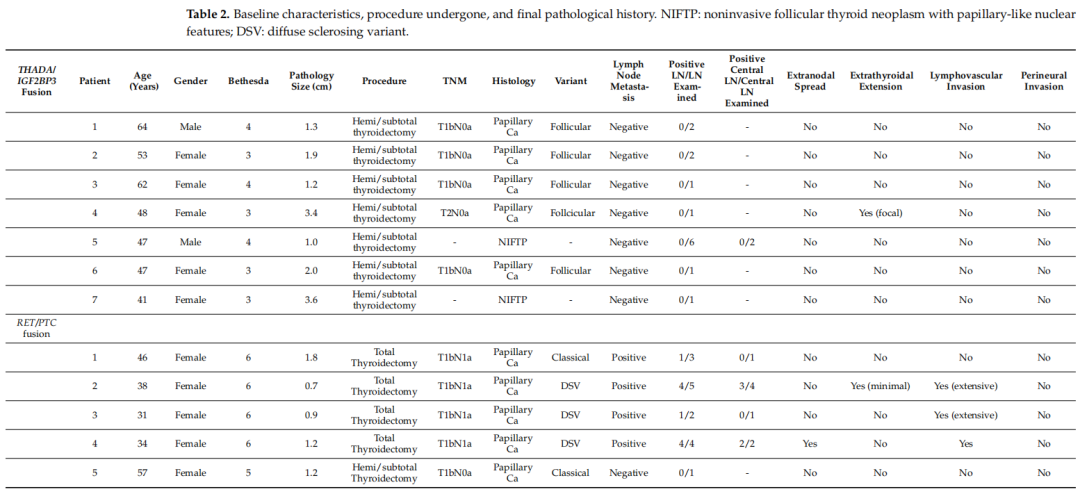
表2
在THADA/IGF2BP3融合组中,7例均表现为Bethesda III或IV级。此外,最终病理分析显示,71.4%(5/7)为恶性,28.6%(2/7)为NIFTP。恶性结节中,均表现为滤泡型PTC。所有结节均无甲状腺外侵犯。只有1个滤泡型PTC的结节呈局灶性淋巴血管侵犯。所有结节均无神经侵犯。在最终的病理分析中,所有患者均未出现淋巴结转移或结外扩散(表2)。
患者管理:
5例RET/PTC融合患者中,4例行甲状腺全切除术,1例行甲状腺半/次全切除术。接受甲状腺半/次全切除术的患者是唯一的术中前哨淋巴结活检阴性的恶性肿瘤患者。7例THADA/IGF2BP3融合病例均行甲状腺半/次全切除术。所有患者术中前哨淋巴结活检结果均为阴性。所有患者均未接受甲状腺全切除术(表2)。
患者随访:
5例THADA/IGF2BP3融合结节患者获得随访资料。其中4例为恶性结节,1例为NIFTP。平均随访期为18个月(范围:1-33个月)。在此期间未发现复发。
5例RET/PTC融合结节患者有随访资料,平均随访时间为20.6个月(范围:1-28个月)。3例患者的甲状腺扫描结果与残留的甲状腺组织一致,需要接受额外的治疗。术后甲状腺扫描阳性的患者与手术病理为弥漫性硬化型恶性肿瘤的患者相同。
讨 论
在过去的十年中,分子检测的出现在甲状腺结节的术前检查中迅速扩展。这项单中心研究在魁北克省蒙特利尔市进行,在自愿的基础上,对每个病例的患者提供分子检测。分子检测panels通常被认为是强有力的排除标准,减少了中等Bethesda评级的甲状腺结节对诊断性手术的需求。
在甲状腺细胞转化和肿瘤进展过程中,识别各种分子标志物是理解潜在致病因素的关键步骤,可以指导甲状腺癌的临床管理。迄今已报道了几种基因变异,包括乘客突变和基因驱动突变,如BRAF、p53、NRAS、KRAS和HRAS。然而,RET/PTC和THADA/IGF2BP3融合的研究较少,因为它们在已知的基因变异中只占一小部分。本回顾性研究旨在评估这两种基因重排的临床影响,并阐明分子检测在甲状腺结节检查和管理中的实际应用。
本回顾性研究确定了该队列患者人群中,这两种突变的发生率估计值,根据各自的Bethesda分类。所有RET/PTC融合结节经细胞学分析均为Bethesda V/VI级。在这种情况下,手术范围是基于现有的临床信息、患者偏好以及术中发现。在本研究中,大多数RET/PTC融合患者有淋巴结转移和(或)甲状腺外侵犯。此外,一半以上的病例为弥漫性硬化型。甲状腺结节有RET/PTC融合且侵袭性可能性高的知识将指导甲状腺专科医师在手术范围方面做出更明智的决定,包括决定进行中央区颈淋巴结清扫术。
另一方面,所有THADA/IGF2BP3融合的结节在USFNA评估中均表现为细胞学不确定。所有结节因最终病理诊断为恶性或NIFTP均需手术治疗。虽然这些结节在最终的手术病理中大部分是恶性的(5/7),但没有一个被认为是侵袭性或中或高复发风险。因此,对于存在THADA/IGF2BP3融合的结节,应采取更保守、更有限的手术方式。这些发现与Panebianco等人和Morariu等人报道的其他发现一致。然而,本队列患者人群中THADA/IGF2BP3融合结节的发生率较低。
本研究结果强调了基于分子检测结果优化患者治疗和管理决策的潜力。在2015年美国甲状腺学会分化型甲状腺癌指南发布之前,许多甲状腺恶性肿瘤采用甲状腺全切除术+放射性碘治疗。根据这些指南的建议,临床实践方案发生了变化,较小范围的手术(半甲状腺切除术/腺叶切除术)变得流行。对甲状腺恶性肿瘤患者行甲状腺全切除术还是甲状腺半切除术成为治疗的难题。当在最终病理分析中发现肿瘤具有侵袭性时,行半甲状腺切除术可导致甲状腺全切除术。因此,病人需要进行第二次手术。这导致与这一额外干预措施相关的成本和资源分配增加。此外,患者需要从他们的日常日程(如工作等)中抽出更多的时间。然而,当甲状腺恶性肿瘤被认为不具有侵袭性而进行甲状腺全切除术时,这种手术的范围可能被认为是过度治疗。此外,甲状腺全切除术的干预时间较长,相关并发症较多。此外,患者需要终生补充左甲状腺素。
这项研究清楚地证明了分子检测在帮助优化手术范围和避免任何不必要的甲状腺全切除术方面的价值。事实上,THADA/IGF2BP3融合患者可能会从有限的手术中获益,例如半甲状腺切除术或甲状腺叶切除术,因为这一人群中的患者要么患低度恶性肿瘤,要么患NIFTP肿瘤。这些结果表明THADA/IGF2BP3融合一般为非侵袭性突变。这些知识可以应用于患者管理以及处理具有这些突变的肿瘤的方式。相反,RET/PTC融合患者表现出侵袭性疾病的可能性为80%,因此甲状腺全切除术可能是这一患者群体的首选手术。此外,鉴于该组患者淋巴结转移的可能性增加,应强烈考虑进行中央区颈淋巴结清扫术。
本研究有几个局限性。RET/PTC或THADA/IGF2BP3融合病例的样本量有限,这限制了我们的统计学推论的功效。随访时间有限,两种融合的复发率未知。本研究还受到回顾性研究固有弱点的限制。此外,外科医生和病理学家对分子检测结果并非盲法。因此,与发现有THADA/IGF2BP3融合的患者相比,外科医生可能更有可能对RET/PTC组的中央区进行更全面的检查,以寻找异常淋巴结。当突变为THADA/IGF2BP3融合时,外科医生可能不太倾向于进行淋巴结探查,因为他们知道淋巴结转移的可能性明显较小。病理学家可能对分子检测的结果有偏见。
通过对RET/PTC和THADA/IGF2BP3融合病例进行回顾性分析,所有病例均被发现为恶性或NIFTP。RET/PTC融合组具有更强的侵袭性倾向(腺外侵犯、淋巴结转移和弥漫性硬化型),并根据2015年美国甲状腺学会分化型甲状腺癌指南被归类为中危复发。而THADA/IGF2BP3融合结节表现为惰性行为,在最终病理分析中被归类为低危恶性或NIFTP。对基因驱动因素的了解可能使临床医师制定更有针对性的治疗计划,并支持在细胞学结果不确定结节的术前检查中,分子检测具有显著的临床价值的观点。这项研究证实,有必要进一步评估可疑甲状腺结节中的RET/PTC和THADA/IGF2BP3重排,以改善患者管理,特别是决定是否可以制定靶向治疗计划。在资源有限的医疗系统中,首次实施最佳手术对患者、系统和甲状腺专科医生都有益。了解如何处理特定的甲状腺突变,如RET/PTC和THADA/IGF2BP3,可以帮助外科医生做出最知情的选择,并最大限度地提高手术过程的效率。同样,了解如何治疗某些突变可以防止其再次发生,这对患者和医生都是有利的。这项研究强调了分子检测的价值,不仅可以作为避免不必要手术的排除检测,而且可以作为帮助确定手术范围和辅助治疗需求的工具。
参考文献:
Tali G, Payne AE, Hudson TJ, da Silva SD, Pusztaszeri M, Tamilia M, Forest V-I. The Difference in Clinical Behavior of Gene Fusions Involving RET/PTC Fusions and THADA/IGF2BP3 Fusions in Thyroid Nodules. Cancers. 2023; 15(13):3394. https://doi.org/10.3390/cancers15133394
