糖尿病伤口难愈合主要归因于缺氧造成的血管生成、再上皮化和细胞外基质合成的抑制。高压氧疗法(HBOT)在临床上已被广泛用于改善伤口组织氧合,但是由于持续时间有限,氧气的扩散受到受损血管和紧密组织屏障的限制,治疗效果远非理想。为了克服HBOT的缺点,研究者提出了溶解氧疗法。水以11.1 µM cm-2 h-1渗透角质层,而氧气以 0.5μM cm-2 h-1渗透。因此,水可能是将氧气深入表皮的有效载体。水凝胶作为一种生物相容性材料,具有吸收和保留大量水分的能力,在伤口愈合中得到了广泛的应用。因此,通过水凝胶在糖尿病伤口中输送溶解氧是促进伤口愈合的宝贵策略之一。最近,研究人员开发了各种产氧水凝胶系统,主要通过氧载体(如微藻,全氟化碳,血红蛋白,和过氧化氢)来改善组织氧合。结果证实,通过水凝胶中负载的氧气进行氧化在穿透深度上明显高于气态氧。然而,现有的系统只能在较短的时间内释放氧气,这对大于14天的糖尿病的伤口愈合周期是不够的。此外,现有系统需要触发条件才能输送氧气,并且不能长时间储存,这给患者在日常护理中带来了不便,并进一步阻碍了伤口持续氧合的目标。
在本研究中,华中科技大学臧剑锋教授团队、同济医学院附属协和医院王琳教授以及王征教授团队共同提出一种具有可持续氧合性能的水凝胶贴片(PCPS-gel),以促进糖尿病伤口愈合。PCPS-gel是通过将聚乙二醇改性的过氧化钙(PEG@CPO)微粒和银离子(Ag+)混合到由聚乙烯醇(PVA)和海藻酸钠(SA)组成的双网络水凝胶中形成的。为了避免过氧化氢不合时宜分解引起的活性氧的毒性,将过氧化氢酶引入贴片中。其中,利用PEG修饰过氧化钙可促进产氧颗粒快速有效地释放氧气,减少反应产生的碳酸钙对后续产氧的影响。将PEG@CPO微粒加载到水凝胶中以形成伤口贴片一方面可以约束颗粒的氧气释放,结合过氧化氢酶浓度的调节,实现了持续释放7天氧气的效果;另一方面可将溶解氧原位输送到糖尿病伤口部位,增强治疗效果;将银离子(Ag+)引入释放氧气的水凝胶中,可抑制糖尿病创面高糖环境带来的细菌定植影响。在体外缺氧条件下,作者验证了PCPS-gel释放的氧气可以促进细胞迁移和血管生成。进一步地,作者基于糖尿病小鼠模型验证了PCPS-gel在体内对伤口愈合中的功效,发现PCPS-gel主要通过促进细胞外基质合成、诱导血管生成以及降低TNF-α和IL-6的炎性细胞因子表达来加速伤口愈合,实现了第7天84.2%的糖尿病伤口愈合率,优于现有的氧气释放方法。为了提高PCPS-gel的便利性和有效性,作者提出将贴片包装在便携式分离包装中,左侧是含有过氧化氢酶的无菌水,右侧是水凝胶。使用前,包装只需拆开中间的密封线,通过摇晃混合左右内容物,等待几分钟让水凝胶吸收过氧化氢酶。此外,水凝胶贴片还具备多孔、柔软、抗菌、可生物降解,储存稳定性15天等多种特性。
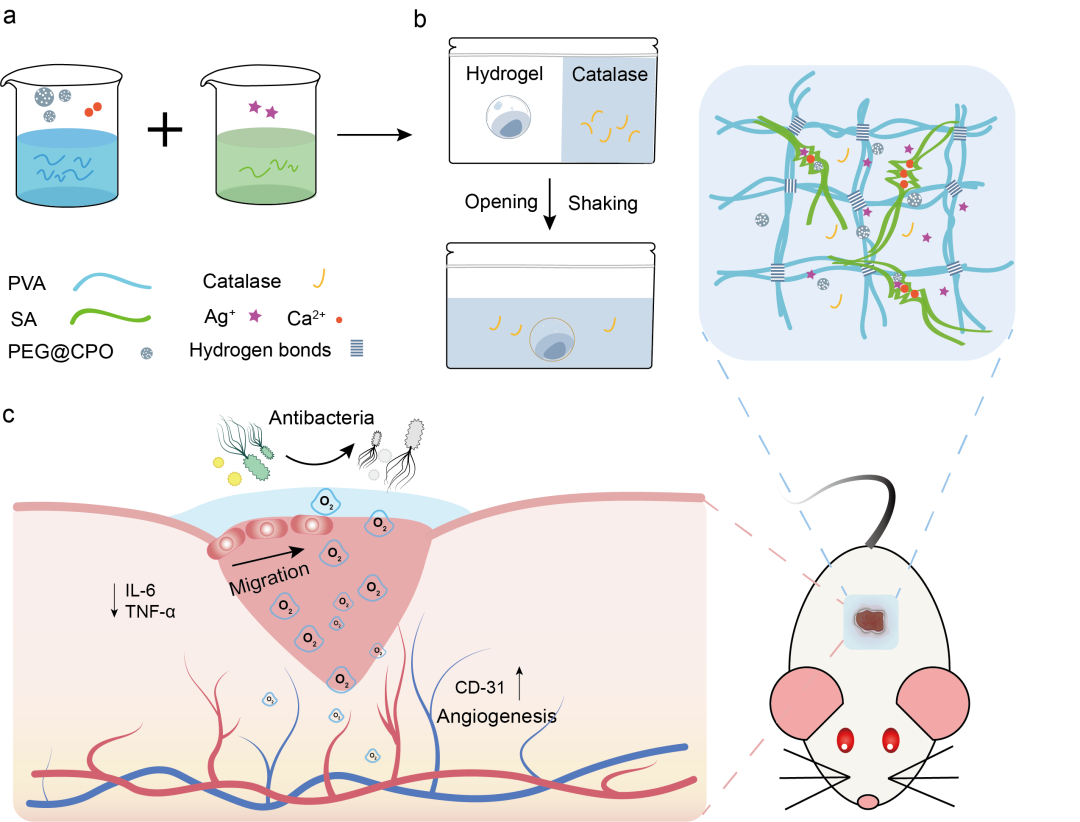
图1. PCPS-gel制备及其治疗糖尿病伤口愈合的示意图。
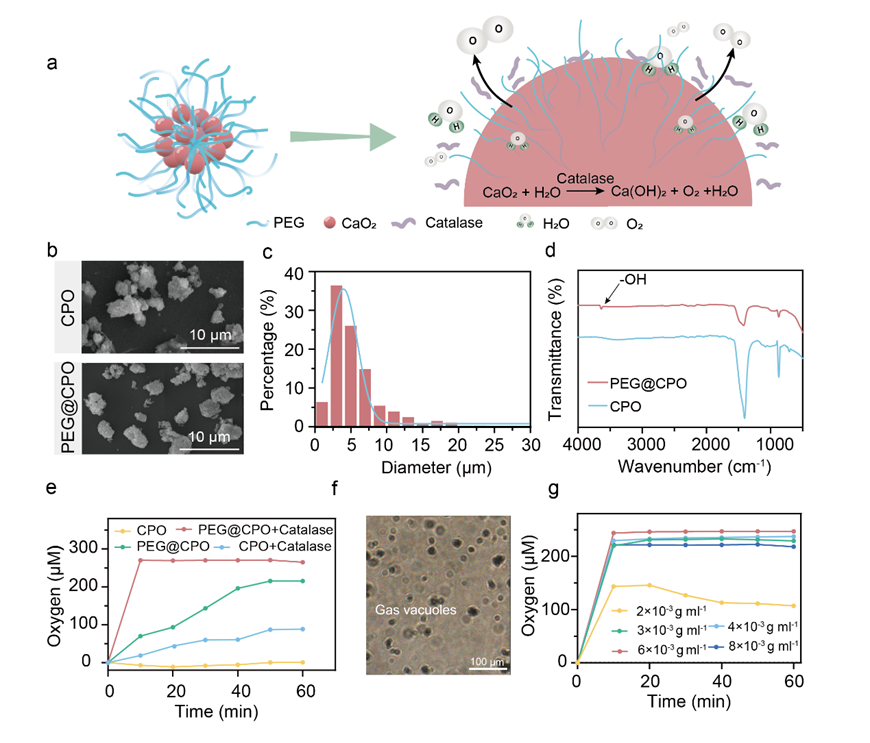
图2. PEG@CPO微粒的制备和产氧表征。
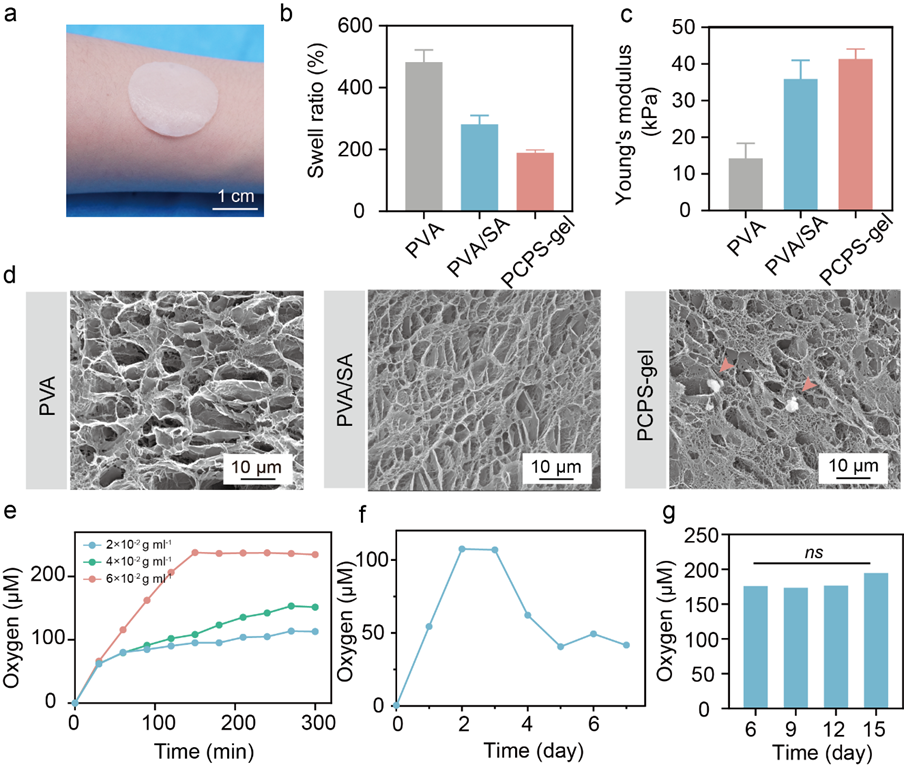
图3. PCPS-gel的表征。
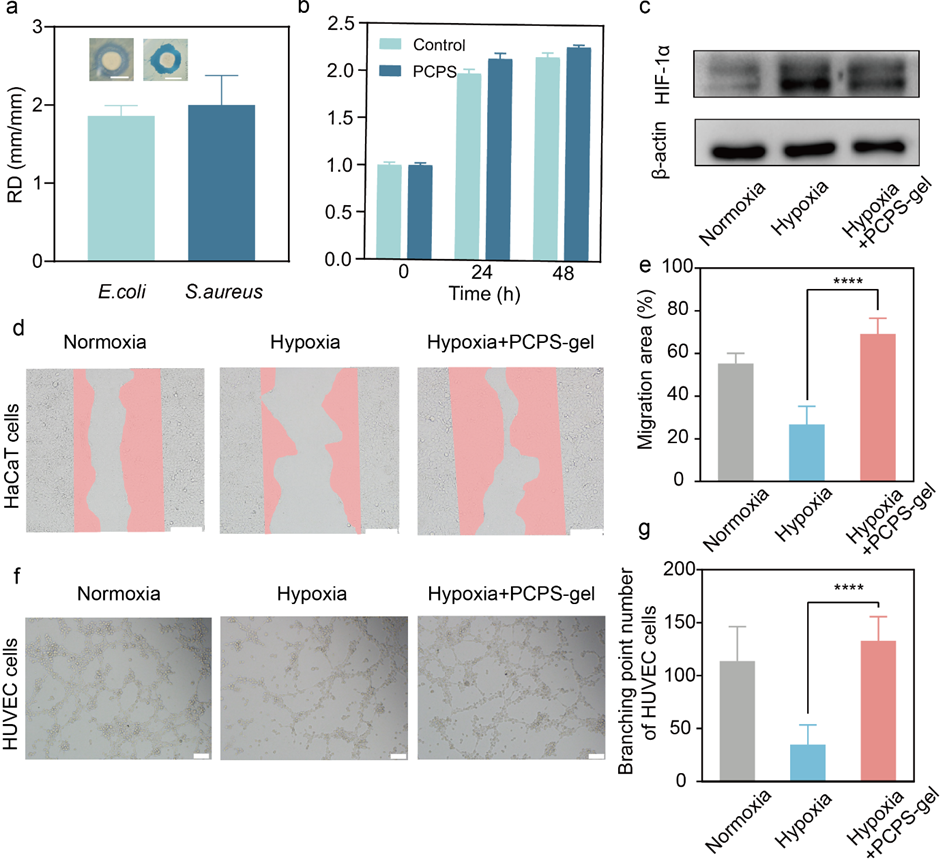
图4. 体外验证PCPS-gel的细胞毒性和伤口愈合治疗效果。
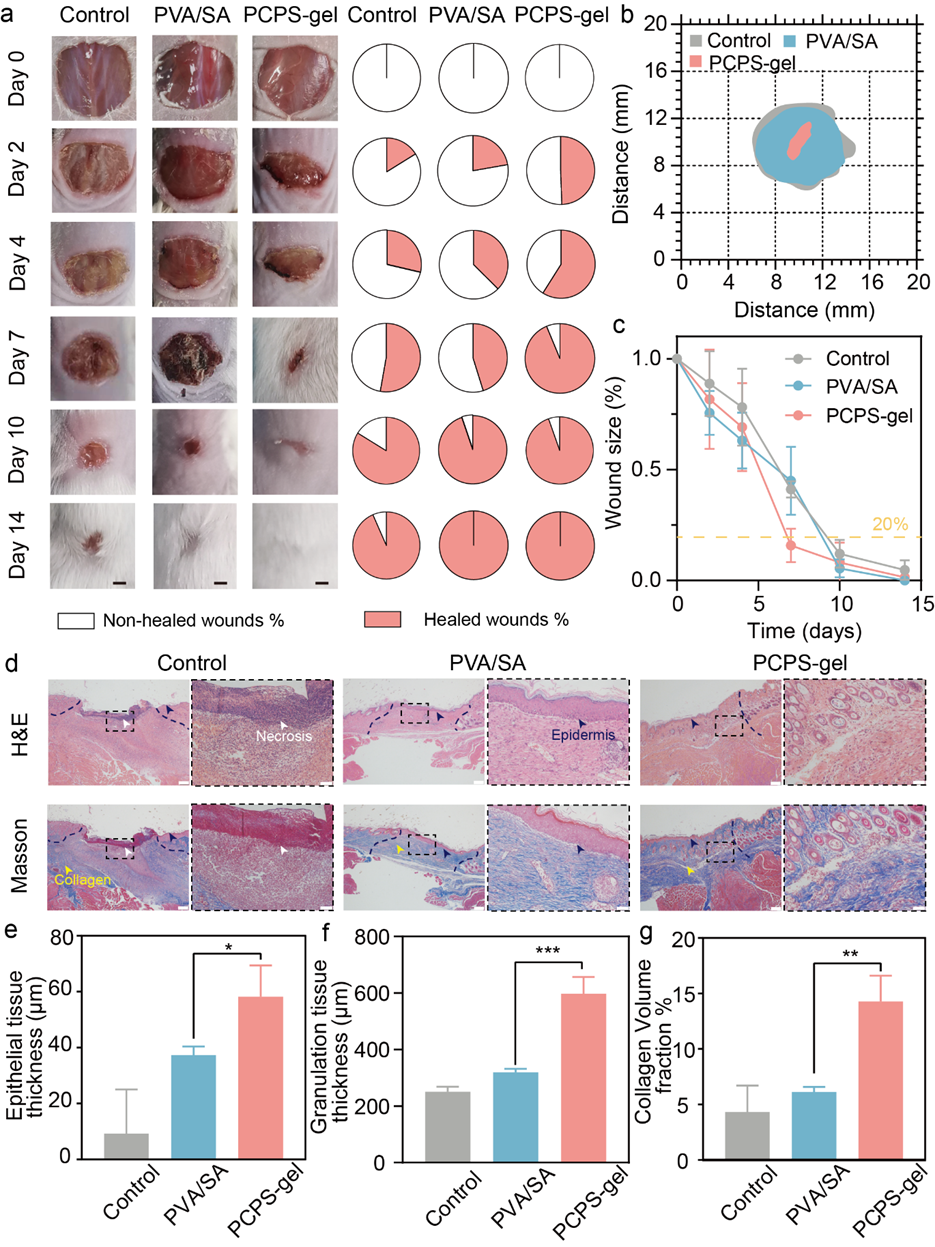
图5. PCPS-gel加快糖尿病小鼠的伤口闭合,促进了再上皮化和细胞外基质合成。
鉴于以上内容,作者相信该水凝胶贴片将成为治疗多种慢性伤口(尤其是糖尿病伤口)的潜在方法,并且还显示出如保存移植的组织和器官等更广泛的生物医学用途的潜力。此外,由于水凝胶贴片的氧释放动力学对治疗效果有显著影响。考虑到人体病理和生理学的复杂性,未来的研究应侧重于通过引入刺激响应性材料实现氧气释放动力学可视化,及时提醒患者更新贴片,使贴片智能化,进一步推进到临床应用。
华中科技大学博士研究生李纳、路小欢、杨月莹为本文的共同第一作者,华中科技大学臧剑锋教授、华中科技大学同济医学院附属协和医院王琳教授、王征教授为共同通讯作者。
以上研究获得了国家自然科学基金项目、华中科技大学同济医学院重大人类疾病综合创新团队项目和华中科技大学同济医学院博士生资助项目的资助。
原文链接:
https://doi.org/10.1002/adhm.202303314