CAR-T治疗PCNSL
原发性中枢神经系统淋巴瘤(PCNSL)是一种罕见的弥漫性大B细胞淋巴瘤(DLBCL),预后较差,主要原因在于高复发风险,复发/难治性PCNSL的中位总生存期(OS)仅有6.8个月。axicabtagene ciloleucel (axi-cel) 和lisocabtagene maraleucel (liso-cel)等CAR-T细胞疗法在系统性淋巴瘤获得重大成功,但由于担心免疫效应细胞相关神经毒性综合征(ICANS),关键研究均排除了CNS受累的患者,导致其在PCNSL中的应用受到限制。然而,近几年有多个小型研究和META分析报道了CAR-T在CNS淋巴瘤中的疗效和安全性,认为CNS淋巴瘤并非CAR-T的禁区。
然而总的来说,由于患者数量有限,特别是在真实世界中随访时间较短(大多数患者只有几个月),以及缺乏与这些系列中其他治疗策略的比较,CAR-T在PCNSL中的实际作用仍不明确。因此法国LOC(Lymphomes Oculo-Cérébraux)网络开展一项真实世界研究,报道了目前CAR-T治疗PCNSL的最大样本研究,旨在通过研究更大的队列和更长的随访时间,更好地描述CAR-T细胞疗法在PCNSL患者中的作用。研究结果近日发表于《American Journal of Hematology》。

研究方法&结果
该研究纳入LOC网络数据库中接受单采以进行CAR-T治疗的复发/难治性PCNSL患者,具体要求包括:ASCT后复发或不适合移植、既往治疗≥2线。还纳入对照组,具体要求包括:18-80岁、DLBCL PCNSL、一线接受HD-MTX为基础治疗、CNS 复发(不包括孤立性玻璃体视网膜复发)、无全身受累、不适合ASCT或 ASCT 后复发、三线后之后接受该治疗、此次复发和后续复发时接受除ASCT或CAR-T以外的任何治疗,排除在该复发时接受姑息治疗的患者。
患者特征
27例患者进行了单采以进行CAR-T治疗,其主要特征见表1,中位年龄为68岁,既往中位治疗线数为三线,包括14例(52%)患者接受过ASCT和2例(7%)患者接受过WBRT。22例(81%)存在脑实质受累,8例(30%)存在脑脊液受累,包括4例孤立性脑脊液复发。除1例患者外,所有患者均接受桥接治疗。
2例患者最终没有接受CAR-T治疗,因为神经系统状况随着肿瘤进展而恶化,在单采后3个月和4个月死亡,最终25例患者接受了CAR-T治疗。单采和CAR-T细胞输注之间的中位延迟为41天。CAR-T细胞输注时,10例(40%)患者KPS<70, 14例(56%)患者为完全缓解(CR)或部分缓解(PR)。4例患者正在服用类固醇。
缓解和生存
16例接受tisa-cel治疗,9例接受axi-cel治疗。除非复发,否则患者在CAR-T细胞输注后不接受任何其他治疗。1个月客观缓解率(ORR)为76%,其中32%出现CR, 44%出现PR。在随访期间,最佳缓解包括16例(64%)患者CR和4例(16%)患者PR,而5例(20%)患者对CAR-T立即难治。至最佳缓解中位时间为1.1个月。2例患者在早期MRI上表现为燃瘤(flare)效应,病变增加或出现,随后无需进一步治疗即消失。
根据CAR-T细胞治疗前疾病的中枢神经系统位置、CAR-T细胞输注时疾病状态和CAR-T细胞类型的缓解率见表2。在CAR-T细胞输注时,如果患者处于PR或CR,而非疾病稳定(SD)或疾病进展(PD),则CAR-T细胞输注后的CR率显著更高(86% vs 36%,p=0.02)。
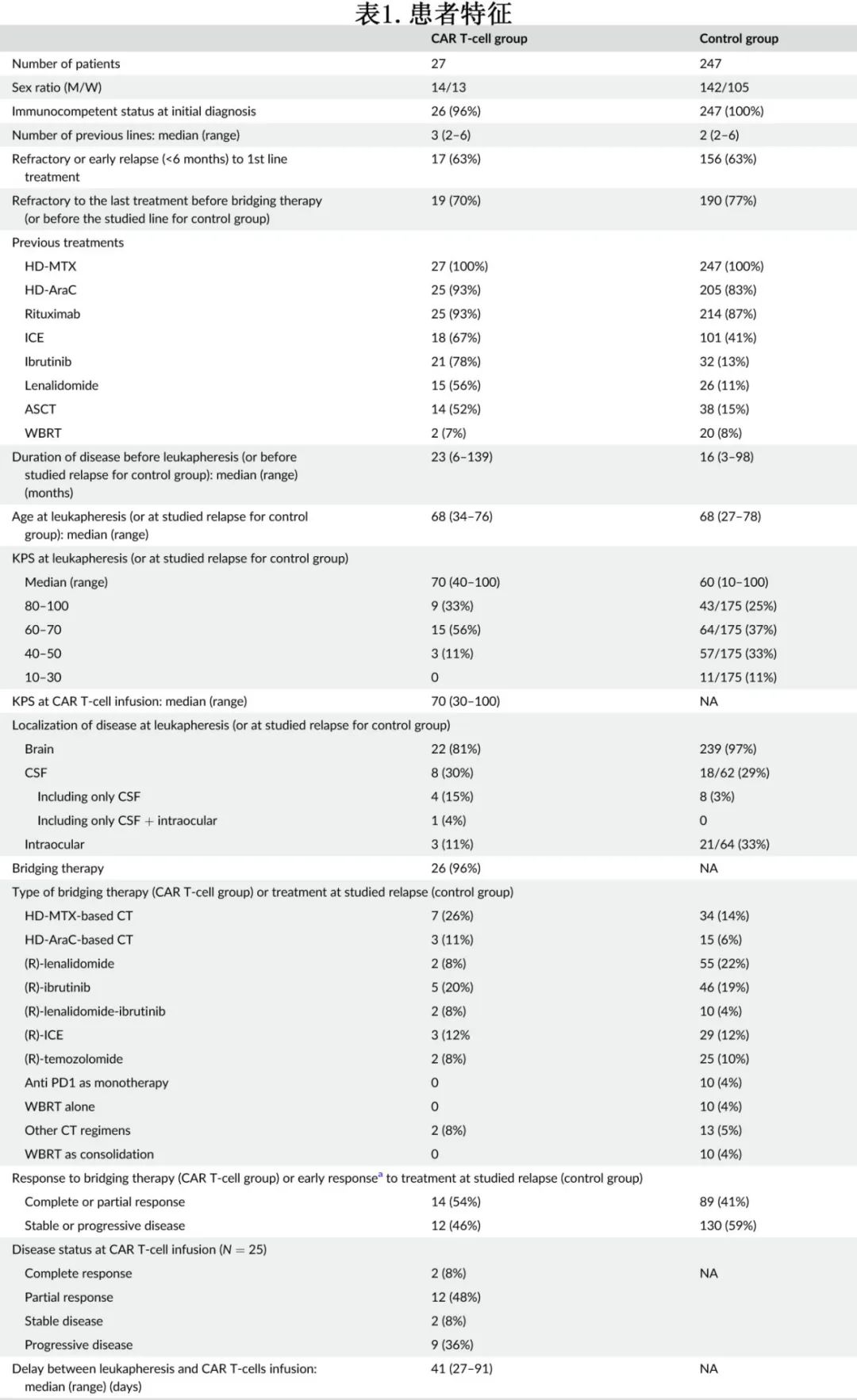
单采后中位随访20.8个月,CAR-T细胞输注后中位随访19.4个月。单采后的中位PFS为8.4个月, 6个月和12个月 PFS率分别为63%和43%,之后为平台期(图1A)。输注后的12个月PFS率为46%。
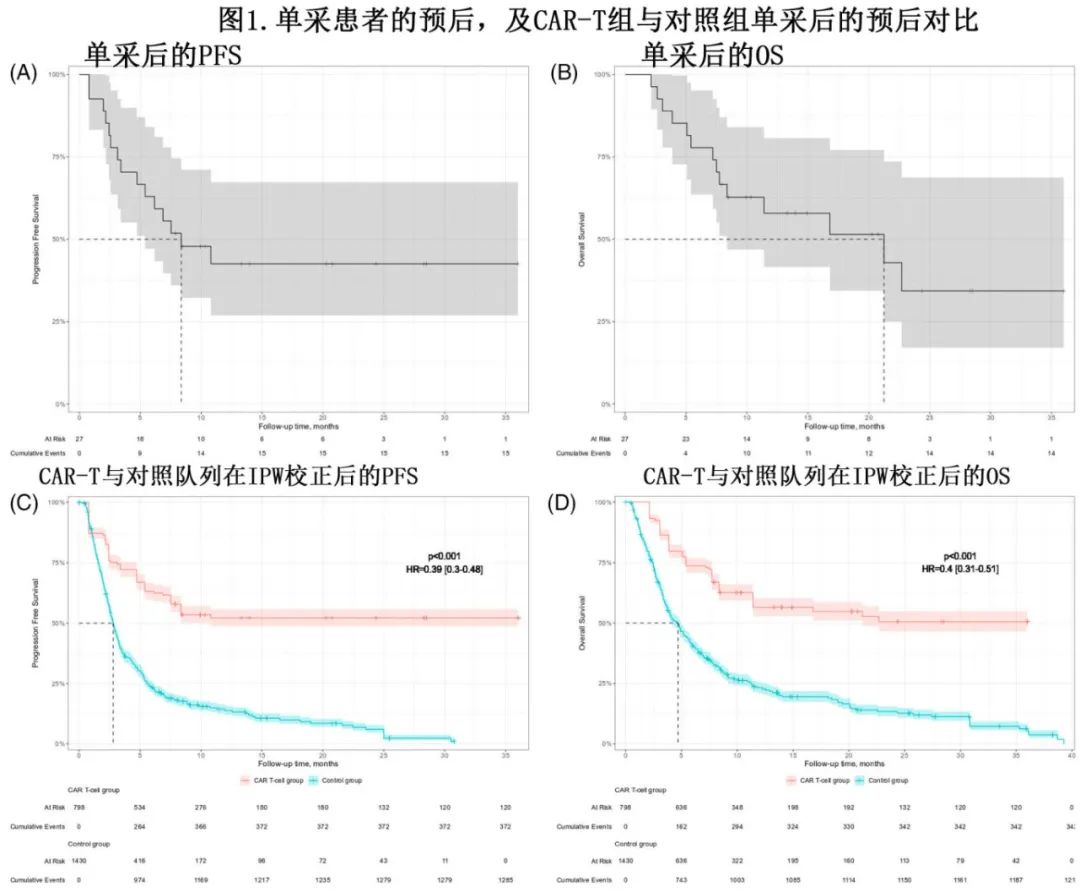
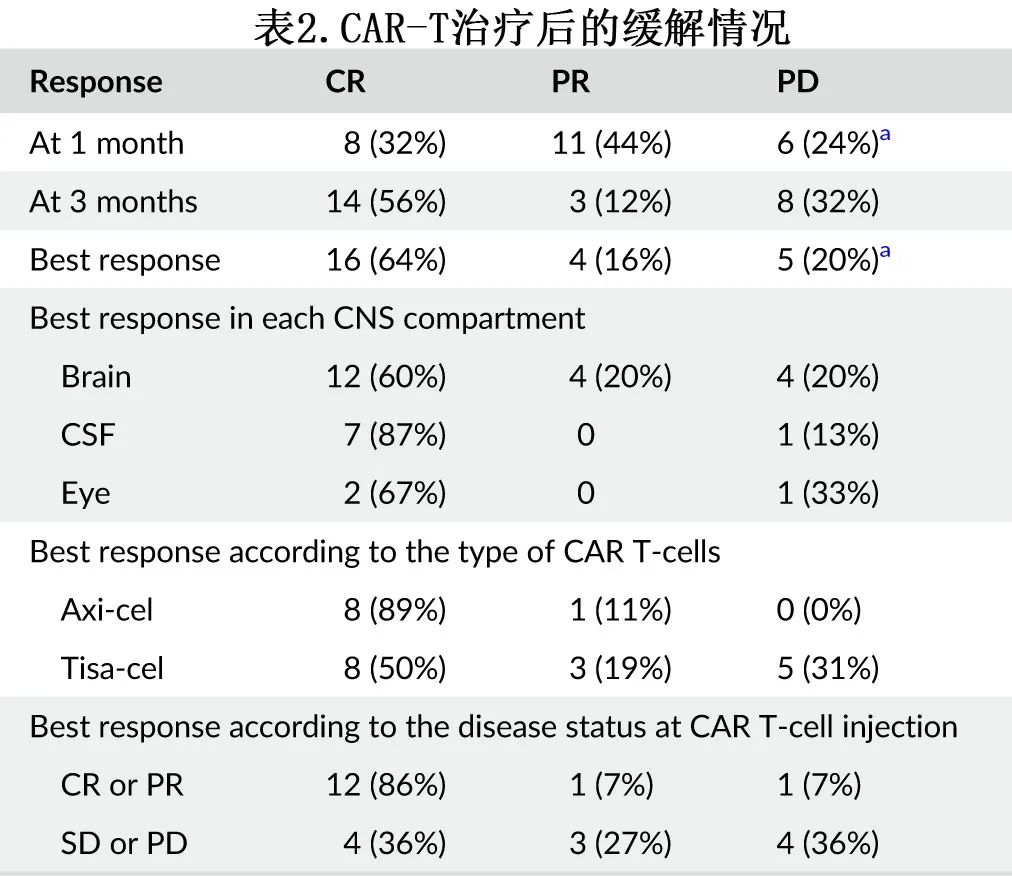
11例患者在CAR-T治疗后复发,其中7例患者接受了至少一线后续治疗,包括2例患者WBRT,除1例患者外,其余患者在中位时间4.6个月后死于淋巴瘤进展。然而对于在任何时间达到CR的16例患者,只有2例随后复发,包括1例CD19阴性CSF复发。CAR-T细胞输注后达到CR的患者的12个月RFS为87%,而未达到CR的患者为0% (p<0.001)(图2A)。
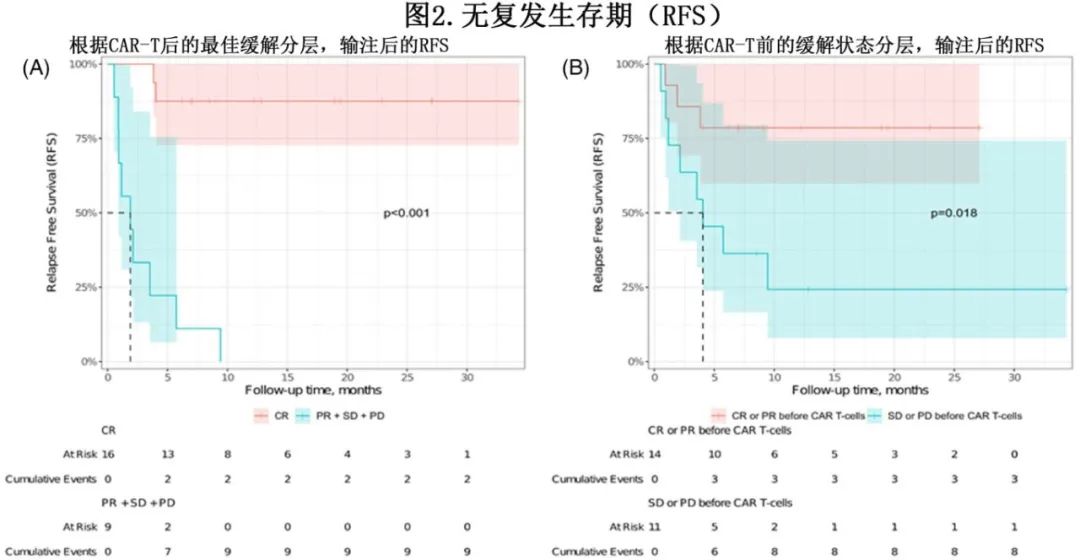
单采后的中位OS为21.2个月, 6、12和18个月OS率分别为77%、58%和51%(图1B)。CAR-T细胞输注的12个月OS率为55%。12例患者在CAR-T治疗后的随访期间死亡,10例患者死于淋巴瘤进展,1例死于SARS-CoV-2感染, 1例患者死于神经毒性。
CAR-T细胞输注前的肿瘤状态与RFS显著相关:输注前CR或PR患者12个月的RFS率为79%,而SD或PD患者为24% (p=0.02)(图2B)。在包括年龄和KPS在内的多因素分析中,肿瘤状态对RFS的预后价值仍然显著(p=0.03, HR=0.23);此外没有其他因素与RFS或OS显著相关。
安全性
23例(92%)患者出现CRS,包括2例3-4级。17例(68%)患者发生任何级别的ICANS(axi-cel有8/9例[89%],tisa-cel有9/16例[56%],p=0.2),其中5例(20%)为≥3级(两产品分别有2/9例[22%]和3/16例[19%])。从输注到CRS和ICANS发生的中位时间分别为1天和5天。CRS和ICANS的中位恢复时间分别为4天和6天。3例患者出现4级神经毒性,神经恶化持续超过3个月。其中一人死于神经毒性;1例在细胞输注后6个月完全康复;1例在输注9个月后仍在经历神经恢复。18例(72%)患者接受了托珠单抗,14例(56%)接受了类固醇治疗,用于毒性管理。9名患者(36%)发生持续28天以上的≥3级血细胞减少。9名患者(36%)需要在CAR-T细胞输注后的一个月内转入ICU。
对照组
来自LOC网络的对照组(N=247)的主要特征见表1。在单因素未校正的分析中,CAR-T细胞治疗组的PFS(中位8.4个月)明显长于LOC网络队列(中位3个月),p<0.001。未校正的单因素OS分析显示,CAR-T治疗后的OS更优,中位21.2个月,而LOC网络队列为4.7个月(p<0.001)。同样,与回顾性LOC网络队列相比,未校正的Cox比例风险模型显示CAR-T对OS的独立影响,HR为0.36 (p<0.001)。
为减少CAR-T治疗人群和LOC对照组之间的潜在偏倚,进行了逆概率加权(IPW)Cox校正分析,以平衡不同患者队列的特征。加权后协变量的平衡使用标准化平均差进行评估,显示协变量的平衡有所改善。最后,IPW调整后的Cox风险比在PFS和OS方面均表现出较强的正效应(HR=0.39和HR=0.4,均为p<0.001)(图1C、D)。
总结
从LOC网络数据库中,作者回顾性地选择了接受单采以进行≥3线CAR-T治疗的PCNSL,作为对照,纳入不适合ASCT且接受任何治疗的PCNSL(在≥3线接受该治疗)。单采患者共27例,中位年龄68岁,包括14/27既往进行过ASCT,其中25例接受了CAR-T治疗(tisa-cel:N=16,axi-cel:N=9),患者呈现出既往高度多线治疗。除一例外,所有患者都接受桥接治疗。单采后中位随访20.8个月。在16例(64%)患者中,CAR-T治疗后的最佳缓解为CR。单采后1年PFS率为43%,之后为平台期。输注前为CR或PR患者CAR-T细胞输注后的1年RFS率为79%,而SD或PD患者为24%(与系统性DLBCL相似)。中位总生存期为21.2个月。23例患者出现细胞因子释放综合征,17/25例患者(68%)出现神经毒性(5级≥3)。CAR-T的疗效终点明显优于对照组(N=247)(中位PFS 3个月,中位OS 4.7个月;均为P<0.001)。
该研究是报道CAR-T治疗PCNSL的最大队列,证实CAR-T在复发性PCNSL中是有效的,具有较高长期缓解率(46%的患者长期缓解,CR患者更高,输注前获得缓解似乎是高持续缓解率的必要条件)和可靠的耐受性(尽管神经毒性风险在频率和严重程度上可能略高于系统性DLBCL,但在大多数情况下似乎是可以接受的)。该结果似乎明显优于其他治疗手段,甚至与CAR-T治疗系统性DLBCL的结果一致(12个月PFS率40%),因此不应阻止CAR-T在PCNSL中的使用。但为确定CAR-T是否能够治愈PCNSL,还需要进行更长的随访,以及进一步的研究,从而有助于更好地了解预后因素,并在PCNSL的治疗库中定位其作用。此外,CAR-T治疗PCNSL的疗效仍有提高空间,例如可以联合PD-1单抗、免疫调节剂或BTK抑制剂等,或者开发其他CAR-T细胞以提高疗效。
参考文献
Choquet S, Soussain C, Azar N, et al.CAR T-cell therapy induces a high rate of prolonged remission in relapsed primary CNS lymphoma: Real-life results of the LOC network. Am J Hematol. 2024;1‐10. doi:10.1002/ajh.27316