腹主动脉瘤(Abdominal Aortic Aneurysm, AAA)以腹主动脉局部瘤样扩张为特征,是临床最常见的动脉瘤。尽管大多数动脉瘤患者并无症状,但是一旦AAA破裂死亡率可高达近90%。当前,全世界每年将近有20万人死于AAA。开放性手术和腔内动脉瘤修复术仍是临床上AAA患者预防破裂导致死亡的两种最有效的干预手段。然而,目前手术治疗存在严格的临床适应证和禁忌证。因此,患者对AAA药物干预措施的需求日益增加。
近年来,越来越多的证据表明,中性粒细胞在AAA的发病中起着至关重要的作用。中性粒细胞可以释放促炎/氧化介质和蛋白酶,同时促进腔内血栓形成与介导单核细胞募集。研究显示,中性粒细胞胞外诱捕网(Neutrophil Extracellular Traps, NETs)在AAA的发病机制中起到不可或缺的作用。通过抑制NETs来调节中性粒细胞炎症进而减缓主动脉扩张是AAA的一种潜在的、有前景的新型治疗模式。
纳米药物递送系统是一种高效靶向治疗心血管疾病的新策略,可以有效增强药物在病变部位的蓄积,减少非特异性分布。一方面,纳米药物可以通过受损的内皮屏障或搭便车效应被炎症细胞转运,从而靶向心血管疾病病变部位。此外,可以通过在纳米药物表面功能化修饰特定分子来实现主动靶向,在不同急慢性心血管疾病动物模型中呈现病灶特异性蓄积,从而发挥更好的治疗效果。
2024年2月27日,陆军军医大学张建祥教授和丁俊教授团队合作在ACS NANO上发表了题为“Pathogenesis-Guided Rational Engineering of Nanotherapies for the Targeted Treatment of Abdominal Aortic Aneurysm by Inhibiting Neutrophilic Inflammation”的研究论文,阐明了NETs抑制性纳米药物LaCD NP靶向治疗腹主动脉瘤的作用与机制,为其他各类心血管疾病的靶向治疗拓展新的研究方向。

首先,研究者基于AAA形成过程中炎性细胞浸润情况以及课题组前期研究发现,将鲁米诺键合环糊精材料合成了生物活性纳米粒LaCD NP。在氯化钙诱导大鼠AAA的模型中,证明了LaCD NP可以在大鼠AAA病变局部有效聚集,并与炎症相关细胞,尤其中性粒细胞产生共定位。进而,该纳米药物通过减少炎性细胞募集,抑制炎性细胞活化,降低MMPs表达,抑制弹性蛋白降解,减轻腹主动脉内钙沉积等方式,有效地缓解大鼠AAA的进展。
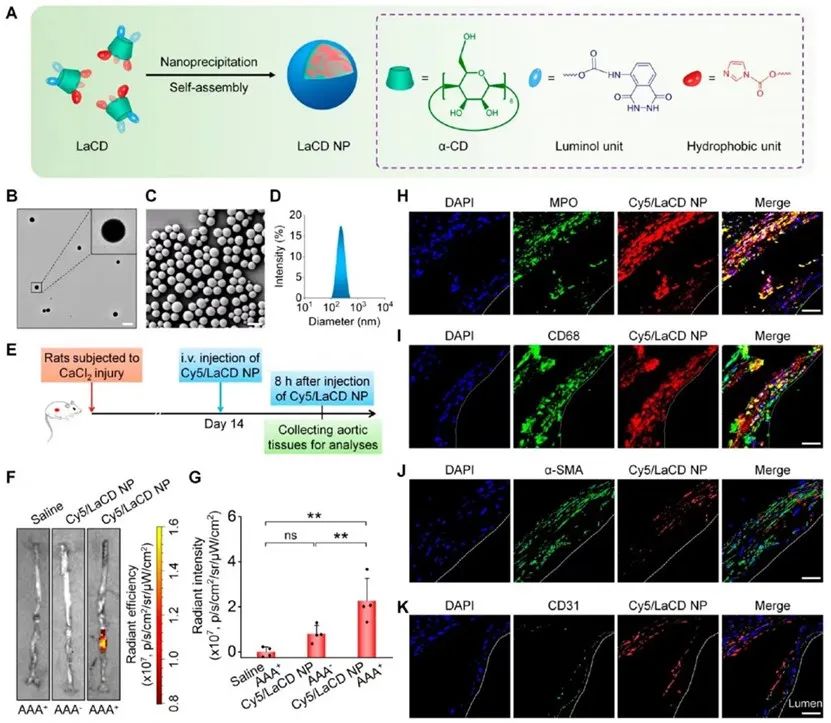
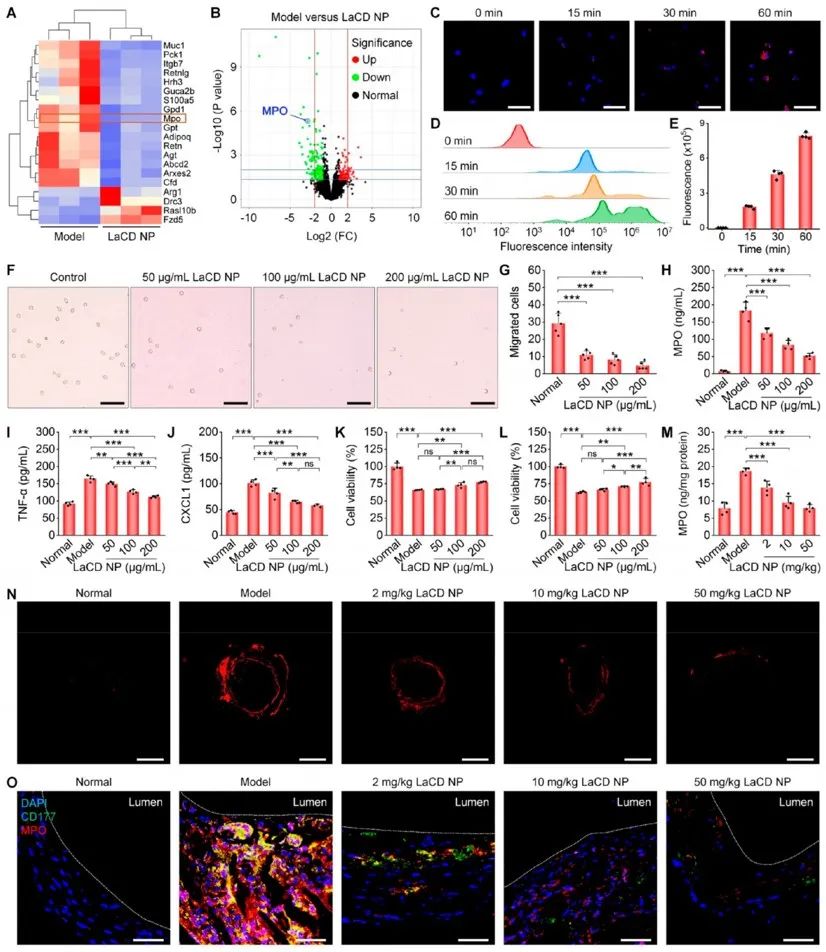
为阐明LaCD NP靶向治疗AAA的作用机制,研究者结合动脉组织转录组测序分析发现:纳米药物治疗组中与中性粒细胞激活以及中性粒细胞炎症密切相关的Mpo基因显著下调。接下来,作者证实了LaCD NP可以被中性粒细胞有效摄取并抑制了中性粒细胞的迁移与中性粒细胞诱导巨噬细胞迁移的功能。同时,LaCD NP可以通过抑制中性粒细胞活化减轻中性粒细胞炎症。此外,体内外实验均表明该纳米药物可以通过调节血管内NETs形成进而抑制血管中层平滑肌细胞凋亡,恢复了主动脉组织的自我修复能力,最终达到治疗AAA的作用。
为了进一步提高该纳米药物的体内靶向能力,研究者基于AAA及其他炎性心血管疾病形成过程中出现的明显钙沉积现象,通过在LaCD NP表面修饰与骨矿物质中的钙离子具有高亲和力的功能分子阿仑膦酸钠(ALN),合成并筛选了主动靶向AAA的纳米药物ALaCD NP,在有效增强了LaCD NP靶向能力的同时,提高了该纳米药物的抗动脉瘤活性。最后,作者模拟了一种更加贴近临床的给药方式以及在弹性蛋白酶诱导的大鼠AAA模型中再次验证了该纳米药物的疗效。
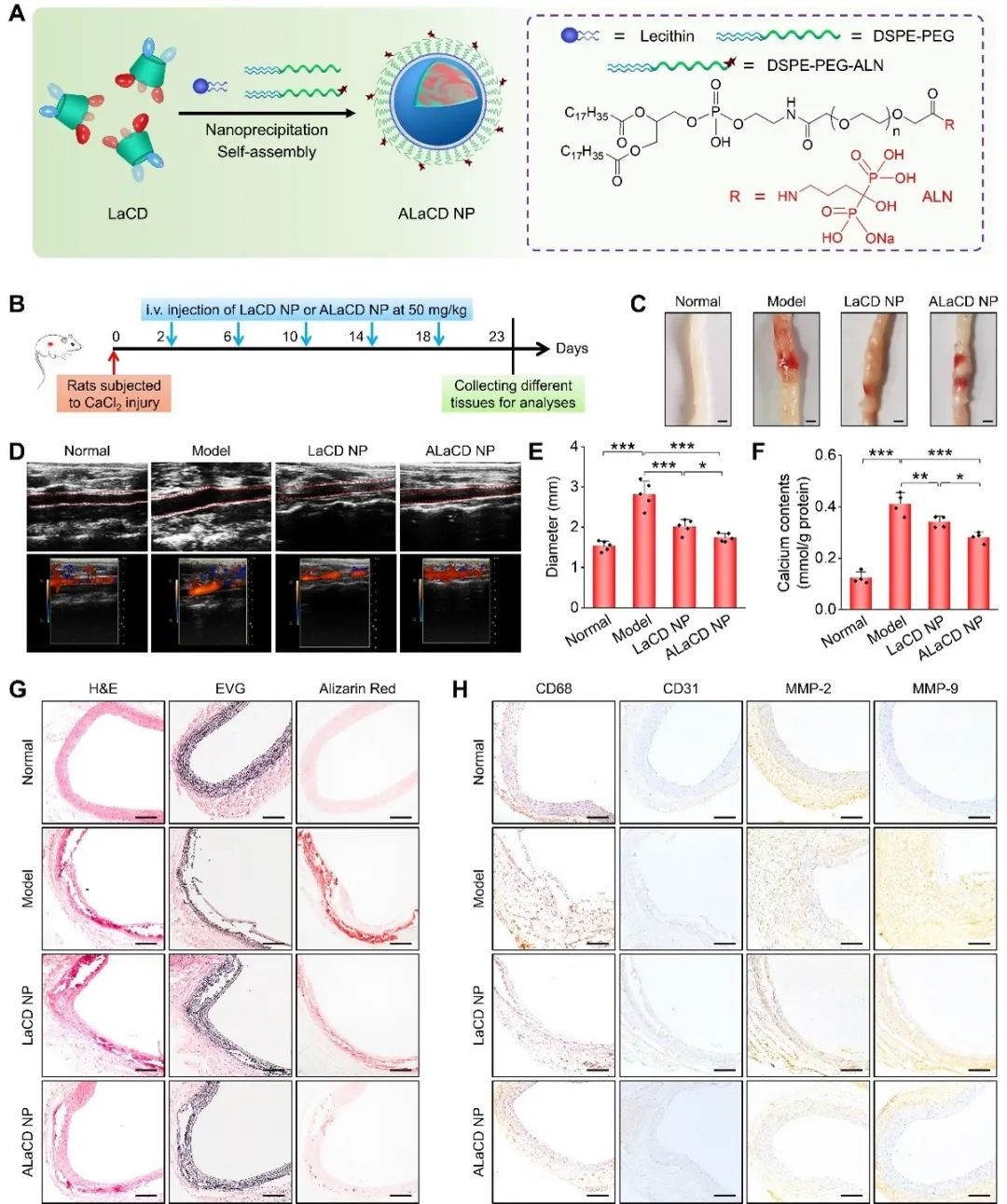
综上所述,该研究成功设计并合成了一种基于生物活性材料的纳米药物LaCD NP。经静脉给药后,LaCD NP对氯化钙诱导的大鼠AAA模型具有良好的靶向性与疗效。随后,作者深入研究了该纳米药物防治AAA的作用机制,证明其可以有效抑制NETs形成与调节中性粒细胞炎症进而发挥治疗效果。最后,通过在LaCD NP表面功能化修饰主动靶向单元ALN进一步提高其靶向能力与疗效。该研究为AAA及其他炎性心血管疾病防治药物的开发奠定了基础并提供了新思路。

该研究由陆军军医大学药学与检验医学系张建祥教授和陆军军医大学附属西南医院丁俊教授合作完成。陆军军医大学药学与检验医学系胡凯耀硕士、钟玲硕士和林文杰硕士为本文共同第一作者。该工作得到国家自然科学基金、重庆市科技创新领军人才计划等项目资助。
原文链接:
https://doi.org/10.1021/acsnano.4c00120