疑难病例 | 术中发生恶性高热,早期症状被脊髓损伤相关的体温调节障碍掩盖
时间:2024-03-07 16:04:37 来源 网络 作者:网络
前言
『恶性高热』MH是一种具有家族遗传性的亚临床肌肉病,主要由吸入麻醉药或琥珀酰胆碱所触发的骨骼肌异常高代谢状态所致。MH临床罕见,易感者一旦发病,病情进展迅速,临床诊治较为困难。
MH主要表现为全身肌肉痉挛、体温急剧持续升高、耗氧量急速增加、CO2 大量生成,发生呼吸性和代谢性酸中毒。
第六胸椎以上脊髓损伤(SCI)与交感/副交感神经通路功能障碍相关,包括体温调节功能障碍,表现为寒冷环境中由于血管舒张和热损失而体温过低。这种效应可以减轻或掩盖MH事件。
病例分享
患者男,27岁,体重140Kg,身高180cm,第六颈椎骨折,上肢肌力下降,下肢无活动和反射,乳头间线以下感觉异常。在损伤后24h内,体温在35-38.3℃之间,行甲基泼尼松龙500mg.hr-1治疗。
受伤后约24h,进行了颈椎关节融合术。采用心电图(DII、V)、血氧饱和度、二氧化碳监测、动脉压、双谱指数(BIS)、体温(红外鼻温探头)进行监测,并使用可进行温度调节的毯子和床垫。术中未行神经肌肉监测。
麻醉诱导包括瑞芬太尼、异丙酚、罗库溴铵(预处理以减少琥珀胆碱诱导的肌束震颤)和琥珀胆碱。在喉镜下放置气管导管,未发现咬肌僵直。麻醉期间用异氟醚和瑞芬太尼泵注维持。
诱导后1h,即脊髓损伤后约25h,患者出现类似肌阵挛的全身性肌肉挛缩。BIS读数为42,诊断为神经肌肉阻滞不足,给予8mg泮库溴铵,肌肉挛缩消除。随后,患者出现低血压(90/55 mmHg)和心动过速(100 min-1);给予晶体和间羟胺治疗。
诱导后约3.5h,动脉血气(ABG)分析显示代谢性酸中毒(表1)。估计失血量为800 mL,术中输入3个单位的红细胞和新鲜冷冻血浆。手术持续4.5h结束。病人仍低血压和心动过速,体温增加到38.5℃(红外鼻温探头),呼末二氧化碳(ETCO2)从39mmHg上升到65mmHg,血压从90/60mmHg下降到80/50mmHg,出现肌肉僵硬和心律失常(室上性心动过速,频繁早搏)。
患者诊断为可疑恶性高热,第二次ABG分析显示代谢性和呼吸性酸中毒(表1)。停止异氟烷吸入和保温毯,手动通风并给予纯氧吸入。给予丹曲林钠2.42 mg/ kg-1、去甲肾上腺素、多巴胺、碳酸氢钠和胺碘酮处理。
连续给了17瓶丹曲林,同时进行降温,并进行其他心脏支持措施。每一次使用丹曲林后,心动过速和高碳酸症状暂时有所改善。但体温仍持续上升到44℃,并伴有进一步的低血压(60/30 mm Hg),并出现心动过缓(30min-1)。
诱导后约5小时,发生心脏骤停,给予肾上腺素和阿托品。ABG显示为缺氧、高钾血症、代谢性和呼吸性酸中毒恶化(表1)。患者出现两次心脏骤停,并在诱导6小时后死亡。未见可乐色的尿液。对父母进行检查,发现肌酸激酶水平正常,体外挛缩试验呈阳性。
他的母亲携带一种雷诺丁受体1型(RYR1)基因(c.14918C>T)的变异,该基因与MH相关。从此病例中,需要注意的是:脊髓损伤引起的体温调节功能障碍可能掩盖MH的早期诊断,导致致命的结局。
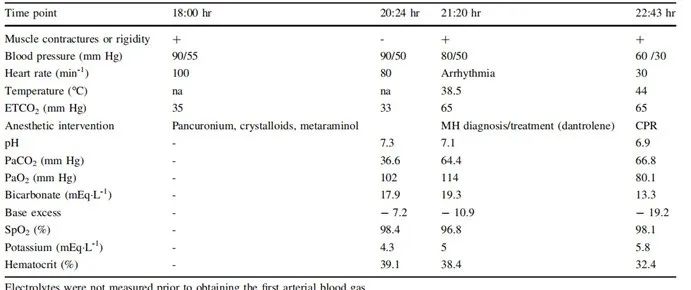
表1 术中检查结果
讨论
01 恶性高热的诊断以及与脊髓损伤的鉴别
MH临床评分标准从肌肉僵硬、肌溶解、呼吸性酸中毒、体温升高、心律失常及其他等方面对患者进行评估,总分在50分以上,基本可以确诊。该患者MH评分68分(全身肌肉僵硬,15分;在适当的控制呼吸条件下PET CO2 >55 mmHg,15 分;围手术期体温异常快速地升高,15分;异常的心动过速,3分;动脉血气显示碱剩余低于-8 mEq/L,10分;动脉血气显示pH<7. 25,10 分)。

表2 恶性高热的临床评分标准

表3 恶性高热临床评分结果与发生恶性高热可能性
目前,国际上公认咖啡因-氟烷骨骼肌收缩试验为确诊MH易感者的金标准。该试验一般在8岁以上、体重超过20 kg的患者中实施。具体操作程序:取患者股四头肌或其他长肌近肌腱部位的肌纤维2~3 cm,固定于37 ℃恒温Krebs液内并持续通入含5% CO2的氧气,连接张力传感器和电刺激仪,给予一定电刺激,测定不同浓度氟烷和(或)咖啡因作用下肌肉张力的改变。根据欧洲MH研究组和北美MH研究组不同的实验条件和相应结果作出诊断。
欧洲MH诊断标准要求氟烷及咖啡因试验均为阳性才诊断为MH易感者,均为阴性时诊断为非MH易感者,如果仅咖啡因试验阳性则诊断为咖啡因型可疑MH(MHEc);如果仅氟烷试验阳性则诊断为氟烷型可疑MH(MHEh)。北美MH诊断标准则强调氟烷及咖啡因试验中任一试验阳性就诊断为MH易感者,均阴性才诊断为非MH易感者。在RYR1、CACNA1S或STAC3基因中发现已知的致病变异也可以诊断。
第6胸椎(T6)以上脊髓损伤与交感/副交感神经系统失调相关,表现为病变部位下交感神经活性增加,病变部位上副交感神经活性增加,可持续数周至数年。
患者可表现为心血管系统功能障碍(表现为高血压、心律失常或神经源性休克伴心动过缓/低血压)、呼吸系统(表现为通气功能不全)和体温调节功能障碍。体温调节功能障碍可表现为高热、运动诱导高热和四肢瘫痪热(表现为不伴有感染或炎症的特发性极端高热)。高热可能导致MH危象的诊断延迟。此外,在手术室寒冷环境下无法维持体温,以及麻醉期间温度下降,可能掩盖MH的发展。
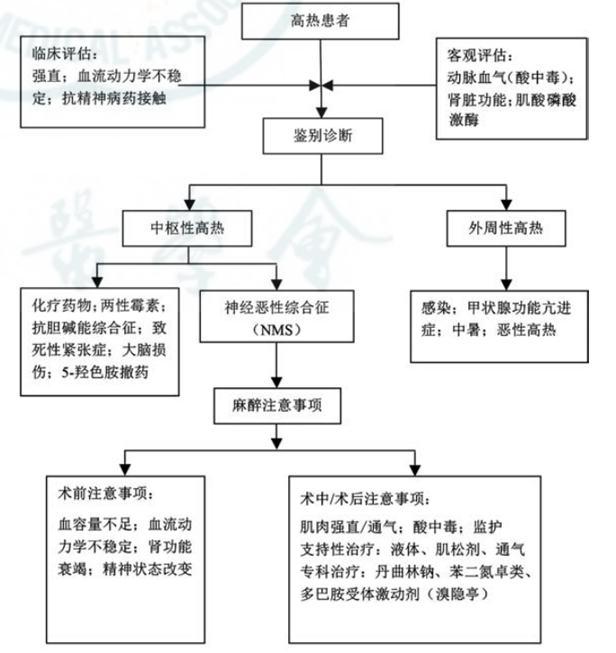
图1 高热患者的鉴别诊断流程
02 恶性高热的预防和治疗
对于MH易感者,关键是避免MH发作,应做到以下几点:
-
仔细询问家族麻醉史;
-
评估患者对MH的易感性,具体处理流程见图2;
-
充足、适合的人员和设备;
-
避免使用诱发MH的麻醉药物:对于可疑或确诊的MH易感者,区域麻醉是较好的选择。一般情况下,局部麻醉药物均可安全使用。如果必须实施全身麻醉,应避免使用禁用药物;
-
如果麻醉过程无异常,术后观察患者至少3h。如果观察到任何MH反应的显著征象,在MH征象最终消失后的12~24 h密切观察患者;
-
建议MH患者及家属进行实验室诊断及基因检测;
-
告知患者及其家属MH相关信息并进行随访。如果他们今后要接受麻醉,嘱其主动向麻醉科医师告知MH家族史。
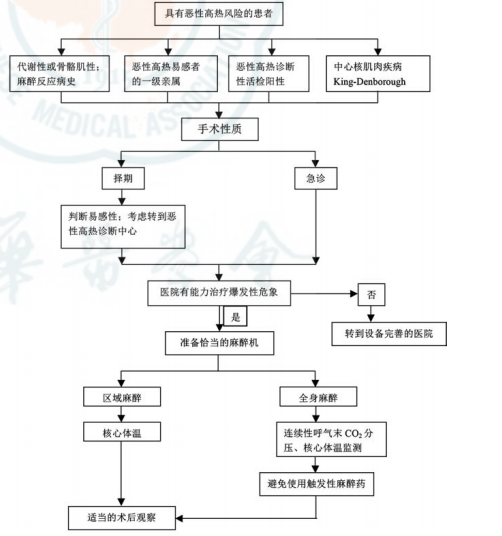
图2 恶性高热易感者的麻醉管理流程

表4 恶性高热易感者禁用及可安全使用的药物
『丹曲林钠』是目前治疗MH的唯一特效药物,自20世纪 80 年代投入临床使用后,世界各国MH患者的病死率由接近100%降至5%~10%。
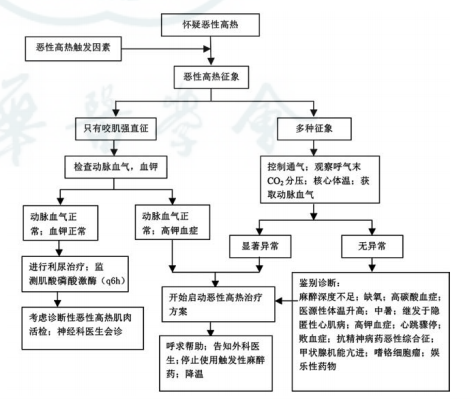
图3 临床怀疑恶性高热的处理流程
有丹曲林钠的情况
尽快获取丹曲林钠,立即终止吸入麻醉药和琥珀酰胆碱等,更换钠石灰和呼吸管路,呼吸环路吸入和呼出两侧加用活性炭过滤器(至少每1小时更换),并用高流量氧进行过度通气洗脱挥发性麻醉药物并降低呼气末CO2,尽快结束手术,如不能短时间内结束手术,应更换为使用不诱发MH的药物维持麻醉。大孔径通路静脉注射丹曲林钠,首次剂量2.5 mg/kg,必要时,丹曲林应用可能超过10 mg/kg,一般不超过40 mg/kg。重复应用,直至MH体征消退。
对症处理
-
核心体温>39 ℃时立即降温(包括戴冰帽及酒精擦浴、静脉输注冷生理盐水、体腔内冰盐水灌洗、甚至体外循环降温等),体温降到38 ℃时停止降温,防止体温过低;
-
纠正酸中毒(过度通气,pH<7.2时静滴碳酸氢钠);
-
纠正电解质紊乱,主要治疗高钾血症(过度通气、碳酸氢钠、葡萄糖、胰岛素和钙剂等,难以纠正时及早考虑血液净化治疗)并监测血糖;
-
纠正心律失常(纠正酸中毒和高钾血症通常有效);
-
适当应用血管活性药等,以稳定血流动力学;
-
持续监测呼气末二氧化碳分压(ETCO2)、分钟通气量、电解质、血气分析、CPK、核心体温、尿量和颜色、凝血功能等,监测尿量,如果CPK和(或)钾离子短时间迅速升高或者尿量降至0.5ml·kg-1·h-1以下,应用利尿药物以维持尿量>1ml·kg-1·h-1,并用碳酸氢钠碱化尿液,防止肌红蛋白尿导致肾功能衰竭。
没有丹曲林钠的情况
除了以上处理,如条件允许,通过相关专科评估积极进行血液净化治疗,主要考虑解决酸碱失衡和电解质紊乱、肌红蛋白尿、高体温等问题。
参考文献
[1]Andrade, Pamela V., Souza, Lucas S., Santos, Joilson M., Alves, José F F., Lutke, Claudia.. Spinal cord injury-related thermoregulatory impairment masks a fatal malignant hyperthermia crisis: a case report. Canadian journal of anaesthesia = Journal canadien d'anesthesie, 2021, 69(3):369-373.
[2]邓梦秋,蒋鑫,陈巍等.疑似家族遗传性恶性高热抢救成功一例[J].临床麻醉学杂志,2020,36(02):204-205.
[3]中华医学会麻醉学分会骨科麻醉学组. 中国防治恶性高热专家共识[J]. 中华医学杂志,2018,98(38):3052-3059. DOI:10.3760/cma.j.issn.0376-2491.2018.38.002.
[4]中国防治恶性高热专家共识工作组.中国防治恶性高热专家共识(2020版)[J]. 2021.DOI:10.3760/cma.j.cn131073.20210102.00107.


