血管衰老是机体各器官系统衰老、增龄性血管疾病的病理生理基础,是各种慢性疾病的共同发病机制,在细胞和器官水平上参与了机体衰老的生理和病理过程,同时也是机体衰老的始动环节。内皮细胞衰老在血管衰老中有重要作用,这一过程常伴随内皮功能障碍,导致血流异常,炎症因子粘附增加等。因此,研究血管衰老及血管内皮细胞衰老的具体机制,对于延缓衰老、减少其他各类疾病的发生与发展有重要作用。
血管衰老涉及的分子机制包括慢性炎症、氧化应激、线粒体功能障碍和细胞衰老等。炎症细胞因子积累加速O2-生成,而活性氧则进一步诱导细胞产生炎症相关的趋化因子、细胞因子等,即衰老相关分泌表型(Senescence associated secreted phenotype, SASP)。这种长期低度的无菌性炎症状态就是炎性衰老。氧化应激和慢性炎症相互促进,可以导致机体大血管的结构和功能改变。慢性炎症在血管衰老中发挥重要作用。抗炎相关分子可能通过减轻衰老相关的慢性低度炎症,从而延缓血管衰老的发生与发展。
抗炎分子膜联蛋白A1 (ANXA1)是一种糖皮质激素诱导蛋白,具有抑制中性粒细胞聚集、趋化、迁移,调控巨噬细胞等作用,与心血管疾病、代谢综合征、神经退行性病变以及糖尿病等衰老相关疾病有密切关系。然而,ANXA1在血管衰老和血管内皮细胞衰老中的作用和机制尚不清楚。
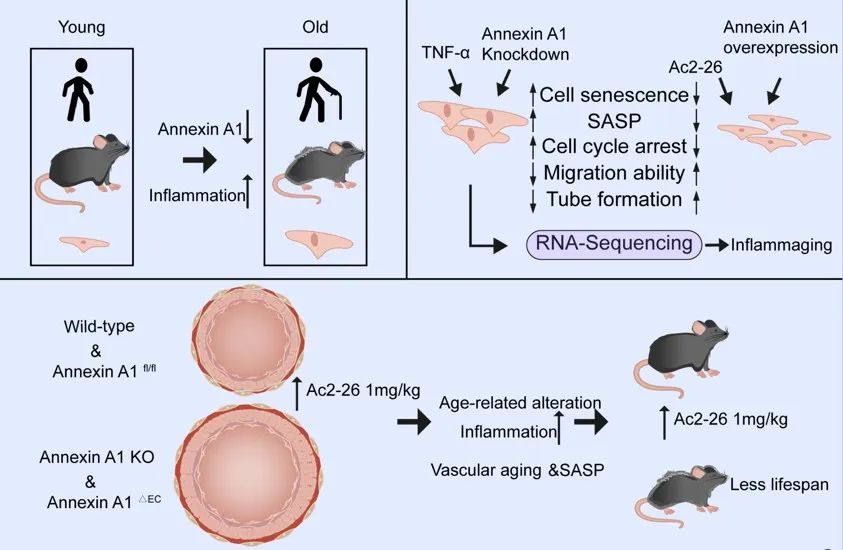
2024年2月15日,福建医科大学附属协和医院洪华山教授团队在Advanced Science上发表了题为“Loss of Endothelial Annexin A1 Aggravates Inflammation-Induched Vascular Aging”的研究论文。该研究首次探讨了人群和小鼠中ANXA1减少或缺失对血管衰老的影响,在发现人体血清ANXA1水平与血管衰老呈显著负相关的基础上,进一步的动物和细胞实验结果表明缺乏ANXA1促进慢性炎症累积、衰老相关蛋白表达上调、衰老相关的分泌表型增加、内皮细胞周期停滞和细胞衰老,导致血管结构和功能的恶化,从而促进血管衰老。

作者首先发现随年龄增加即青年、中年、老年血清的ANXA1水平逐渐下降。其次在不同周龄的小鼠中,ANXA1表达减少分别与年龄和脉搏波传导速度呈负相关。免疫荧光提示,ANXA1随增龄表达下降定位在主动脉内皮细胞(图1)。
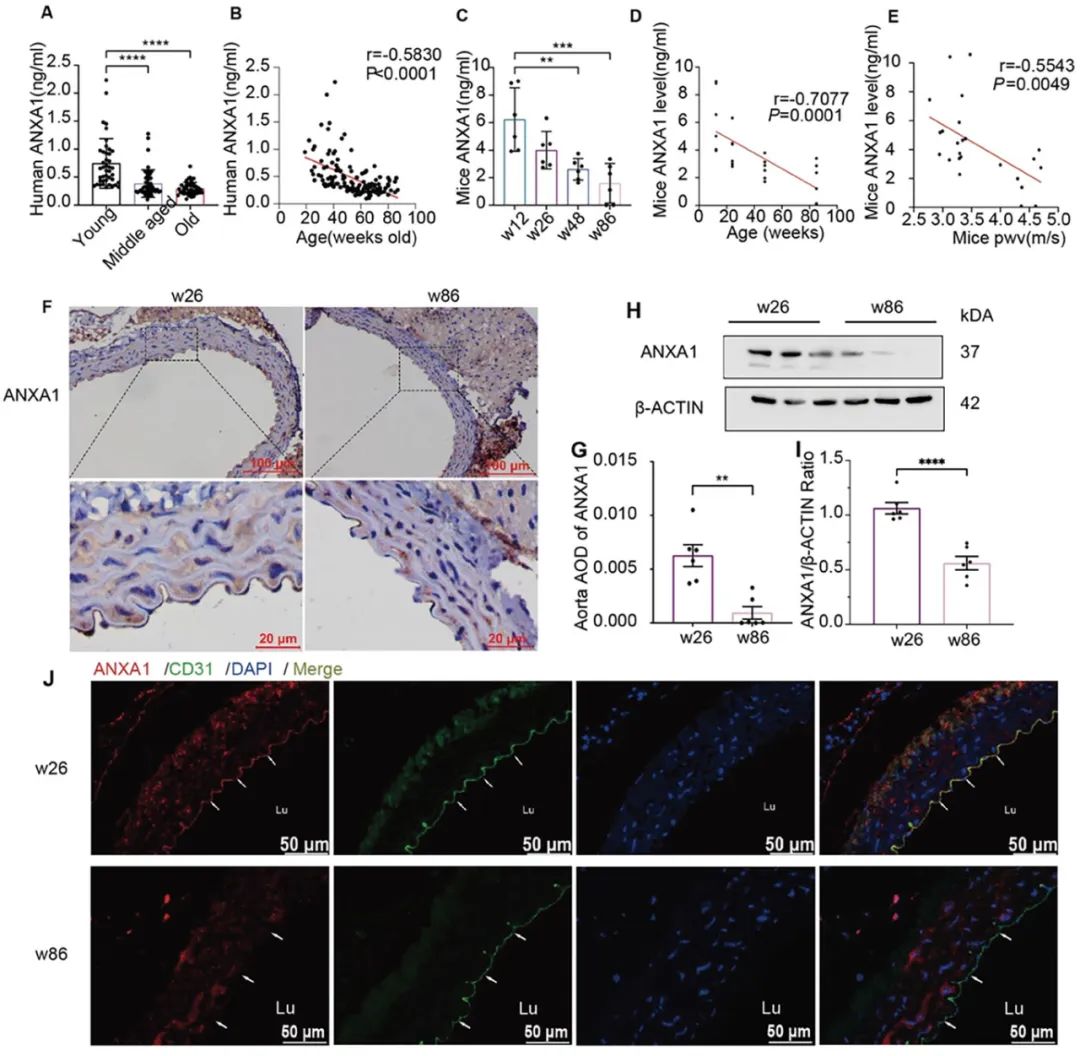
图1. 在人和小鼠中,Anxa1水平随增龄下降
在此基础上,为了明确ANXA1在血管衰老中的作用,作者利用ANXA1敲除小鼠模型,发现饲养到68周左右,小鼠出现死亡。与68周龄对照组相比,敲除ANXA1血管衰老明显加重,表现为敲除ANXA1后脉压增大、内皮依赖性血管舒张功能减退、脉搏波传导速度增加、血管内皮衰老染色阳性率增加、主动脉管腔增大、管壁增厚、胶原纤维沉积增加和弹性纤维断裂增加等,其衰老程度与正常100周龄的小鼠衰老相似(图2)。
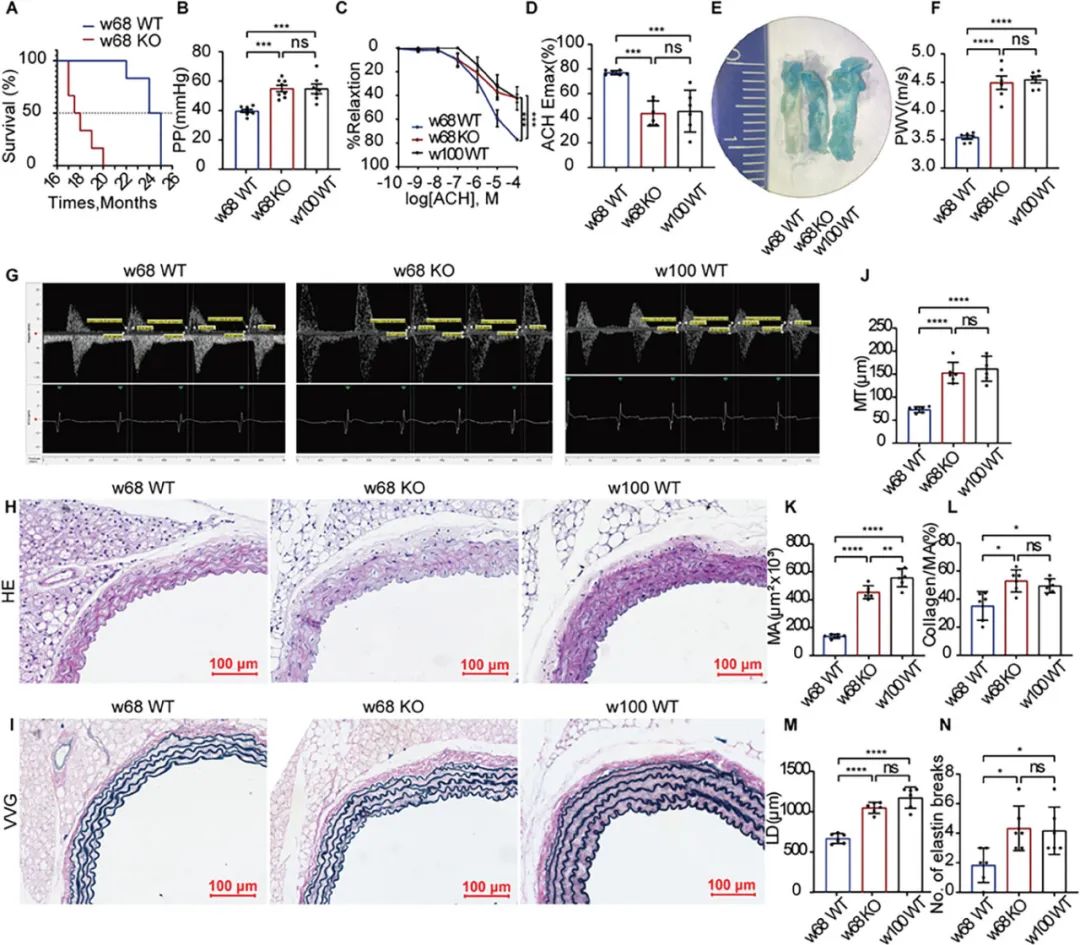
图2. ANXA1敲除后,年龄相关的主动脉改变加重
68周龄ANXA1-/-小鼠与68周WT小鼠相比,衰老相关蛋白P53和P21、炎症因子TNF-α、IL-6等在主动脉的表达都明显升高,这和100周龄自然衰老WT小鼠表现类似。此外,小鼠血清检测结果显示,68周龄ANXA1-/-小鼠CRP和MCP1水平升高,和100周龄自然衰老WT小鼠一致(图3)。

图3. 68周龄ANXA1 KO小鼠炎症相关蛋白升高
同时,作者使用Ac2-26 (一种ANXA1的模拟肽)干预36周龄ANXA1-/-小鼠4个月,结果发现,补充Ac2-26能显著改善ANXA1敲除所致的血管衰老改变,表现为毛发稀疏、白发、主动脉内皮衰老染色阳性率减少,内皮依赖性血管舒张功能恢复、脉压减小、脉搏波传导速度减少、主动脉结构恢复、主动脉衰老相关蛋白和炎症指标表达下降等(图4-5)。
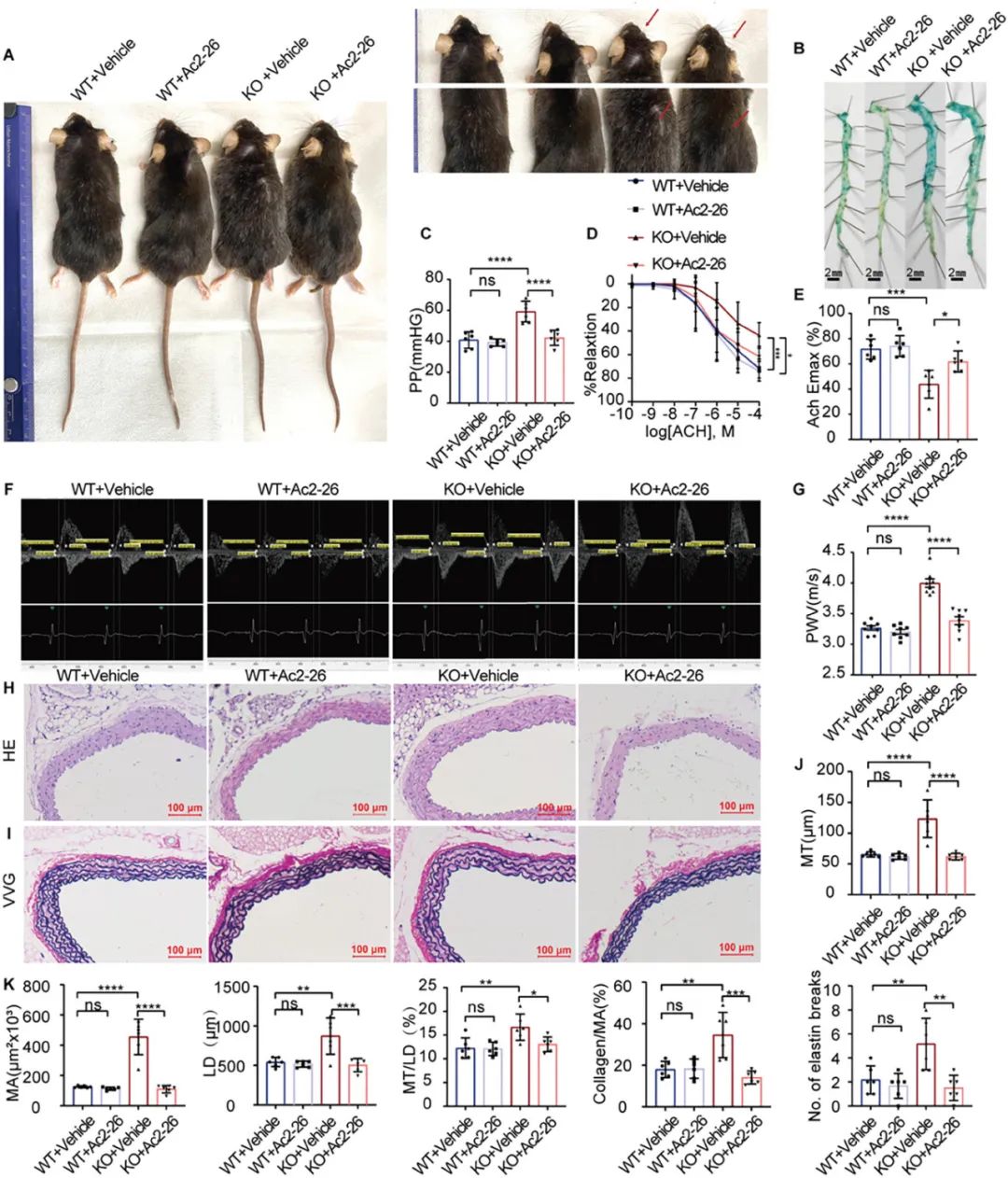
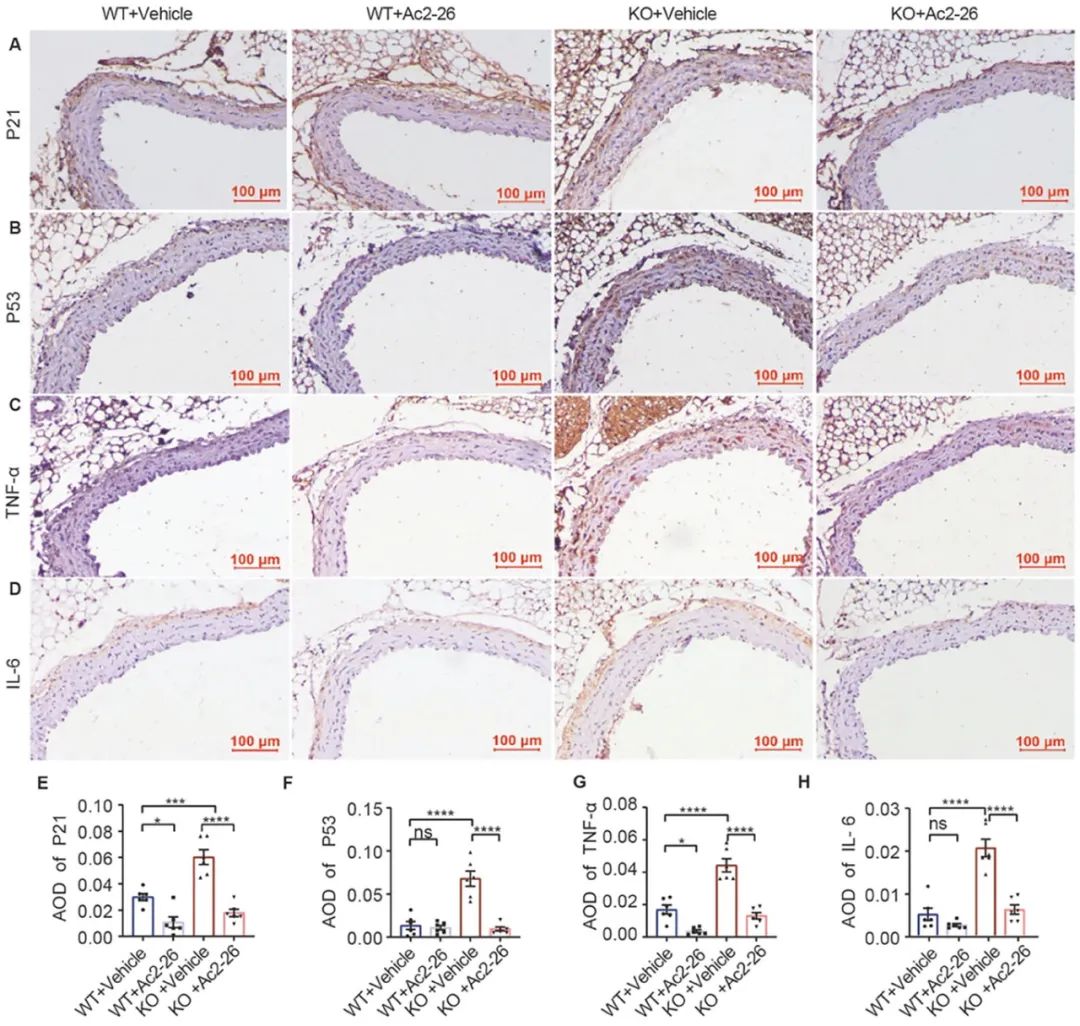
图4-5. Ac2-26治疗可缓解ANXA1-/-小鼠主动脉衰老
为了明确ANXA1在血管内皮细胞衰老中的作用,作者进一步利用68周龄的ANXA1内皮特异性敲除(ANXA1△EC)小鼠,结果发现,ANXA1△EC小鼠血管衰老明显加重,表现为主动脉内皮衰老染色阳性率增加、内皮依赖性血管舒张功能降低、脉压增大、脉搏波传导速度增加、主动脉管腔增大、管壁增厚、主动脉衰老相关蛋白和炎症指标表达增加等。作者还使用蛋白质组细胞因子微阵列证实,ANXA1△EC小鼠血清中炎症因子表达明显升高。这些发现进一步说明是内皮ANXA1缺失导致血管衰老(图6)。

图6. ANXA1△EC小鼠主动脉年龄相关性改变加剧,主动脉炎症因子水平增加
为了进一步明确ANXA1在血管内皮细胞衰老中的作用,作者使用慢病毒载体在人脐静脉内皮细胞(HUVECs)中敲低ANXA1,结果发现内皮ANXA1表达下降可致衰老相关蛋白表达、衰老相关分泌表型增加,细胞周期停滞、细胞迁移能力、内皮细胞成管能力下降等细胞衰老的表现,而应用Ac2-26可以逆转ANXA1敲低后内皮细胞的衰老表型(图7)。

图7. Ac2-26治疗可逆转ANXA1敲低后内皮细胞的炎症性衰老
作者进一步应用TNF-α诱导内皮细胞炎症性衰老模型,在此基础上过表达ANXA1,结果发现细胞衰老明显减轻,表现为衰老染色阳性率、细胞周期停滞、衰老及炎症相关蛋白表达减少等(图8)。抑制ANXA1受体FPR2后,细胞衰老染色阳性率明显增加,说明ANXA1可能通过受体FPR2延缓血管内皮细胞衰老。

图8. ANXA1可能通过FPR2受体发挥抗炎作用
综上所述,洪华山教授团队的研究首次阐明ANXA1表达下调可促进或加速血管衰老的发生与发展,其机制可能是通过ANXA1与受体FPR2结合产生抗炎作用,改善内皮细胞迁移与管形成能力等内皮细胞功能,影响衰老相关分泌表型、细胞周期,调控并延缓血管内皮细胞衰老,从而维持正常血管结构和功能,在血管发挥抗炎性衰老的作用。补充ANXA1是预防血管衰老的潜在方法,该研究有望为血管衰老的进一步研究开辟新途径。
本研究由福建医科大学附属协和医院、福建省血管衰老重点实验室、福建省老年血管衰老和脑老化临床研究中心洪华山教授团队完成,福建医科大学附属协和医院为唯一通讯单位。福建医科大学附属协和医院老年医学科游沁怡博士、柯一郎助理研究员、福建医科大学附属第二医院心内科医师陈啸峰为论文的共同第一作者。洪华山教授为论文的唯一通讯作者。该研究工作得到了国家自然科学基金、福建省科技创新联合等项目的资助。
原文链接:
https://doi.org/10.1002/advs.202307040