IL-23 是IL-12 细胞因子家族中的一员,是一种异二聚体促炎细胞因子,这些异二聚体分子有着深刻的结构相似性,IL-12 细胞因子家族和受体结合都需要一个共同的亚基p40。同时,IL-23作为重要的促炎因子,在肠道稳态和炎症以及其他多种疾病中发挥着重要作用。
Mirikizumab 是一种在研的白细胞介素 23(IL-23)p19 拮抗剂,已被批准用于治疗溃疡性结肠炎。VIVID-1研究的主要目的是证明 Mirikizumab与安慰剂相比在中重度克罗恩病患者中的疗效和安全性。研究结果在近日举办的欧洲克罗恩病和结肠炎组织第19届大会(ECCO 2024)上发布。

VIVID-1是一项评估Mirikizumab 安全性和有效性的 3 期研究,积极治疗组中的所有患者从 12 周的诱导期开始,接受初始剂量治疗,直至第 52 周进入研究的维持部分。在第 12 周,未达到临床反应的安慰剂患者(无反应者)转为盲法 Mirikizumab 治疗。
研究人员将成人受试者(N=1065)按 6:3:2 随机分配到Mirikizumab(N=579)(每 4 周静脉注射 (IV) 900 毫克至 第12周,然后皮下注射 (SC) 300 毫克至第52周)、乌司奴单抗(N=287)(静脉注射约 6 毫克/千克剂量,然后皮下注射 90 毫克至 第52周)或 PBO(N=199)(每 8 周注射一次)。主要终点为12周时取得PRO临床应答的患者在52周取得内镜应答和临床缓解,观察Mirikizumab是否优于安慰剂。
结果显示,各治疗组的基线特征相似。安慰剂组和Mirikizumab组分别有48.7%和48.5%的患者曾至少使用过一种生物制剂。安慰剂组和Mirikizumab组分别有15.6%和18.3%的患者使用过2种及更多生物制剂且治疗失败。

Mirikizumab单抗治疗12周时取得PRO应答的患者继续治疗至52周,38.0%的患者取得内镜应答,45.4%取得临床缓解,显著高于安慰剂组(分别为9.0%和19.6%),P值均<0.000001。
另外,在所有的关键次要终点上,Mirikizumab单抗也显著优于安慰剂,其中12周的内镜缓解率比较P<0.001,12周的CDAI临床缓解率比较P=0.001,其余比较P值均<0.000001。总体安全性与Mirikizumab已知安全性一致。
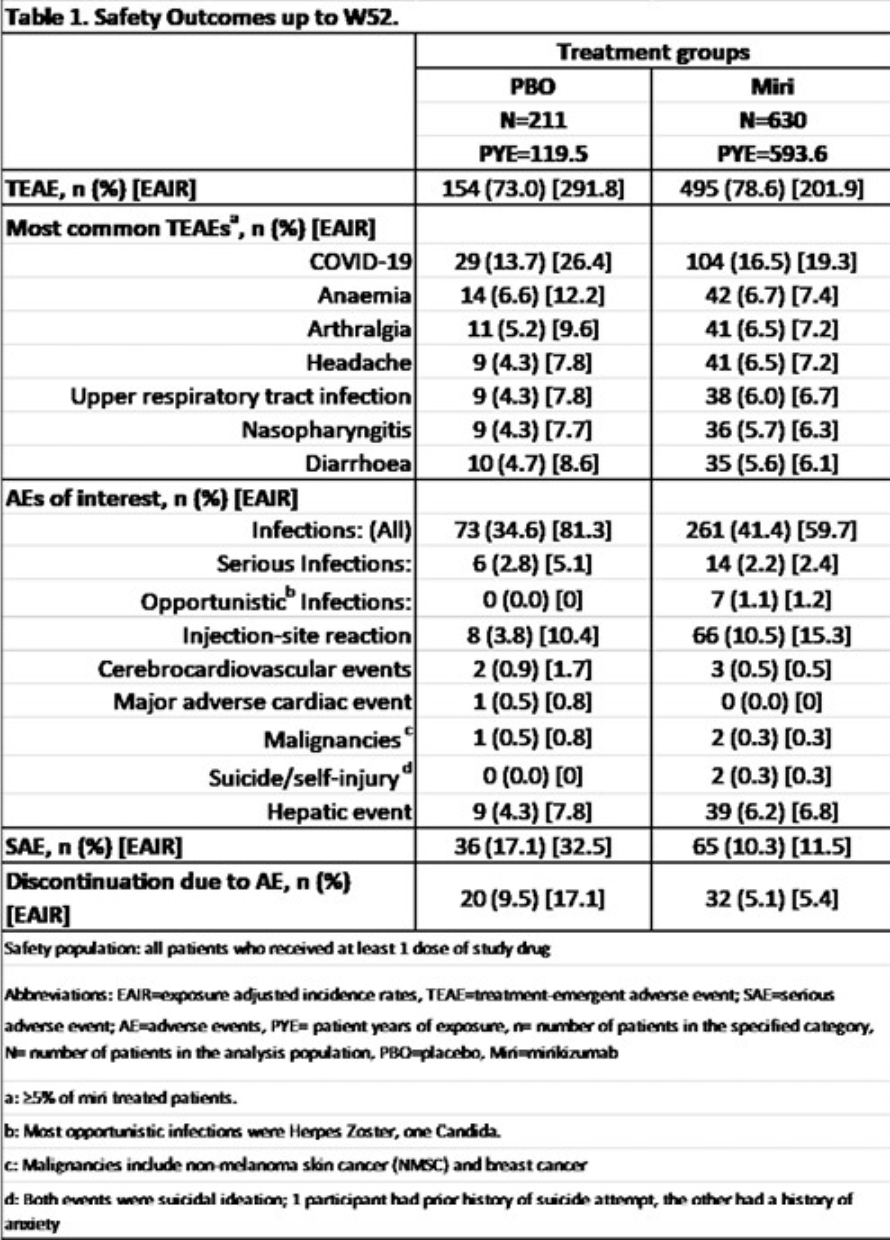
总之,与安慰剂相比,在联合主要复合终点和所有关键次要终点上,Mirikizumab单抗都有显著的统计学意义和临床意义的改善,而具有可接受的安全性。
参考资料
M Ferrante, S Danese, M Chen, G D'Haens, S Ghosh et al. Primary efficacy and safety of mirikizumab in moderate to severe Crohn’s Disease: results of the treat-through VIVID 1 study.Journal of Crohn's and Colitis, Volume 18, Issue Supplement_1, January 2024, Pages i7–i9, https://doi.org/10.1093/ecco-jcc/jjad212.0005