脑膜转移(LM)是非小细胞肺癌(NSCLC)一种棘手的并发症。利用下一代测序(NGS)技术对脑脊液(CSF)游离DNA(cfDNA)进行分析,有助于深入了解耐药机制并探索潜在的治疗策略。本研究于2022年2月至2023年4月开展,纳入来自台湾5家医院的复发性或晚期NSCLC合并脑膜转移患者。采用118个基因的靶向 panel 对这些患者进行脑脊液cfDNA的NGS分析,并收集完整的临床资料。
在25例入组患者中,22例(88.0%)存在EGFR突变,3例(12.0%)分别存在EML4-ALK融合、KIF5B-RET融合及ERBB2 A775_G776insSVMA突变。对25例患者的27份样本进行脑脊液cfDNA测序,均证实了其原始驱动突变。在整个队列中,18例患者(72.0%)接受了鞘内注射培美曲塞(ITP)治疗,从开始ITP治疗到死亡的中位生存时间为7.4个月(95%CI:3.3-11.6)。其中,10例(55.6%)患者生存期超过6个月。值得注意的是,MET拷贝数增加(CNG)与ITP治疗后生存期超过6个月显著相关(p=0.007)。EGFR T790M与EGFR非依赖性耐药变异同时存在时,与ITP治疗后较短的生存期相关,中位生存期为1.9个月,而无EGFR T790M的患者中位生存期为9.9个月(p=0.010)。
本研究结果强调了脑脊液cfDNA NGS在了解脑膜转移耐药机制和预测ITP疗效方面的潜力。MET CNG对接受ITP治疗的患者的生存有积极影响,而EGFR T790M与EGFR非依赖性耐药机制同时存在则会导致不良结局。
-
脑脊液cfDNA测序揭示了NSCLC脑膜转移的耐药机制和治疗途径;
-
鞘内注射培美曲塞对靶向治疗后合并脑膜转移的NSCLC患者显示出前景;
-
MET拷贝数增加可预测脑膜转移NSCLC患者鞘内注射培美曲塞治疗后超过6个月的生存期。
研究背景
脑膜转移(LM)是晚期非小细胞肺癌(NSCLC)的一种不良并发症,发生率为3%-5%。由于靶向治疗延长了患者的生存期,在具有致癌驱动基因的NSCLC患者中,脑膜转移发生率正在上升,特别是在EGFR突变(9.4%)和ALK重排(10.3%)亚组中。尽管随着能够穿透脑和脊髓蛛网膜下腔的药物的出现,脑膜转移诊断后的中位总生存期(OS)已从1-3个月提高到3-11个月,例如用于ALK重排非小细胞肺癌的第二代(布加替尼和阿来替尼)和第三代(洛拉替尼)ALK抑制剂,以及用于EGFR突变患者的奥希替尼,但获得性耐药不可避免地会发生,后续治疗选择仍然有限。
在靶向治疗进展后,对肿瘤组织或血浆游离DNA(cfDNA)进行全面的分子谱分析可能会揭示耐药机制,并为克服耐药性提供进一步的可用药分子靶点。然而,已有报道称非小细胞肺癌脑膜转移患者的脑脊液cfDNA与血浆cfDNA或原发组织之间的基因组变异存在不一致。由于获取脑膜转移的活检样本存在困难,且由于血脑屏障的存在,血浆中cfDNA的检测受到限制,源自脑脊液的cfDNA是检测和监测脑膜转移患者基因组变异的理想选择。脑脊液cfDNA的基因组谱分析显示出更多独特的变异,并且在检测拷贝数变异方面优于血浆,能够准确反映脑膜转移治疗匹配的耐药机制。对于根据脑脊液cfDNA基因组谱分析没有匹配靶向治疗的患者,后续的全身化疗可能是一种治疗选择,但其疗效有限。
除了全身化疗外,鞘内化疗(ITC)允许药物绕过血脑屏障治疗脑膜转移患者。在一项非小细胞肺癌鞘内化疗的汇总分析中,基于细胞学、临床和影像学标准的缓解率分别为55%、64%和53%。此外,(治疗开始后的)中位生存时间确定为6.0个月。在一项I/II期临床试验中,50mg剂量的鞘内注射培美曲塞(ITP)显示出84.6%的临床缓解率和9个月的中位总生存期,超过了接受常规鞘内注射药物的患者。大多数入组患者在奥希替尼治疗期间出现进展性脑膜转移,而鞘内注射培美曲塞被证明对接受奥希替尼治疗后进展的非小细胞肺癌脑膜转移患者有效。
本研究主要关注经过大量治疗、具有驱动突变且在接受靶向治疗后发生脑膜转移的非小细胞肺癌患者。本研究回顾性分析了脑脊液cfDNA的基因组谱,以探讨其在识别靶向治疗耐药机制、预测鞘内注射培美曲塞疗效以及影响生存结局方面的能力。
研究结果
研究人群与患者特征:
初步确定了28例接受腰椎穿刺并收集脑脊液进行NGS的复发性或晚期NSCLC患者。然而,3例患者因MRI未检测到LM而被排除在研究之外。最终纳入25例患者。数据截止日期为2023年6月30日。
25例入组患者的中位年龄为59岁。其中,15例(60.0%)为女性,21例(84.0%)为不吸烟者(表1)。5例患者(20.0%)接受过复发性NSCLC治疗,11例(44.0%)在开始全身治疗时存在脑转移。25例入组患者的组织学类型均为腺癌。
关于驱动癌基因,11例患者(44.0%)存在EGFR L858R突变,8例(32.0%)存在EGFR外显子19缺失(19DEL),3例(12.0%)存在罕见或复合EGFR突变,3例(12.0%)存在其他致癌驱动基因,包括1例EML4-ALK融合、1例KIF5B-RET融合和1例ERBB2 A775_G776insSVMA(表1)。
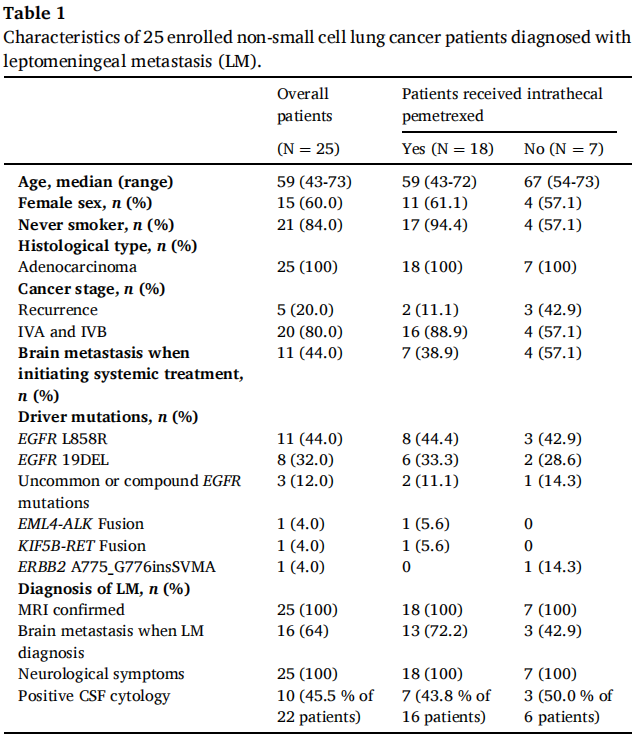
表1
所有25例脑膜转移患者均表现出神经系统症状,如视野改变、头晕、意识改变、步态不稳等(表1和表2)。16例患者(64.0%)在脑膜转移诊断时经脑部MRI证实存在脑转移。然而,在22例接受脑脊液细胞学检查的患者中,仅10例(45.5%)发现恶性细胞(表1)。
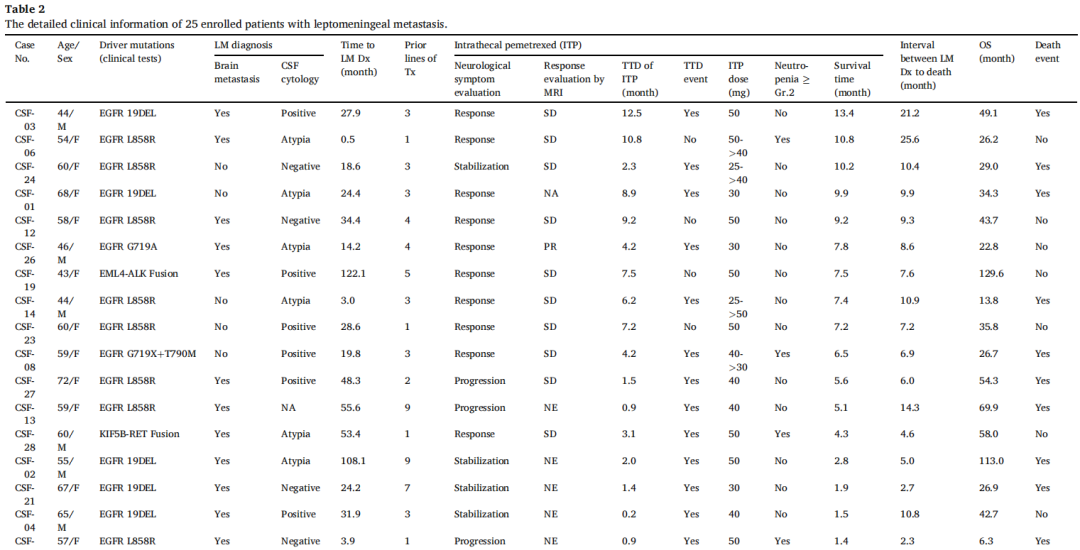

表2
在该队列中,从复发性或晚期非小细胞肺癌诊断到确认脑膜转移的中位间隔为19.8个月(95.0%CI,6.2-33.5)。对22例EGFR突变患者进行分析,EGFR突变患者从非小细胞肺癌诊断到脑膜转移诊断的中位间隔为18.6个月(95.0%CI,7.4-29.7)。此外,11例EGFR L858R患者和8例EGFR 19DEL患者从非小细胞肺癌诊断到脑膜转移诊断的中位间隔分别为15.8个月(95.0%CI,0.0-31.6)和24.4个月(95.0%CI,19.2-29.5)(p=0.400)。
这25例患者在脑膜转移诊断后接受的全身治疗线数中位数为3(范围,1-9)(表2)。
脑脊液cfDNA的NGS分析质量控制(QC):
研究者共分析了来自25例患者的27份脑脊液cfDNA测序结果,其中2例患者各提供了2份样本(CSF-03和08)。随后将这些结果与患者先前的分子检测结果进行了比较(表3)。所有27份样本的原始驱动突变均呈阳性。在27份样本中共鉴定出167个变异,变异数范围为1-13。
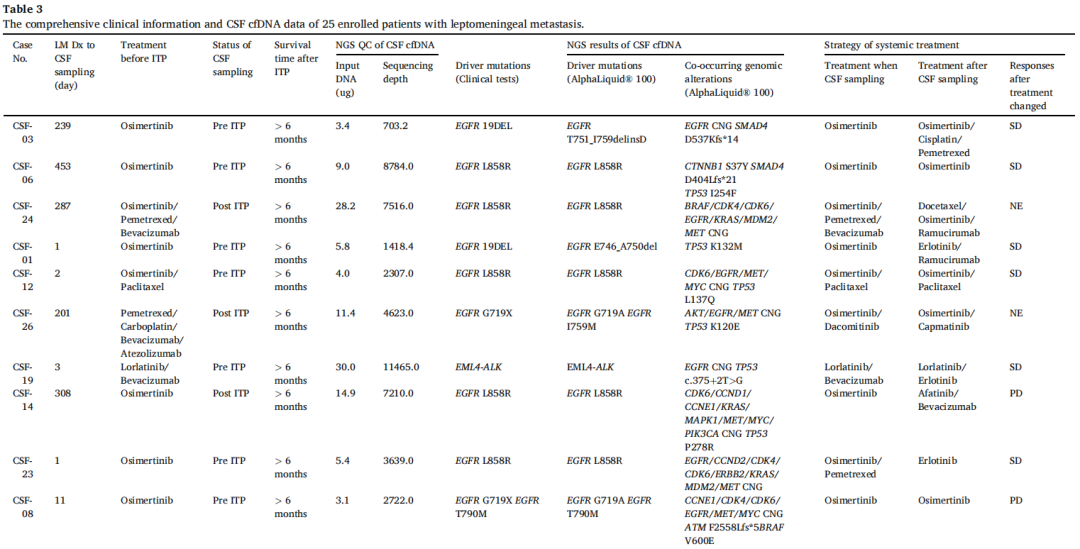
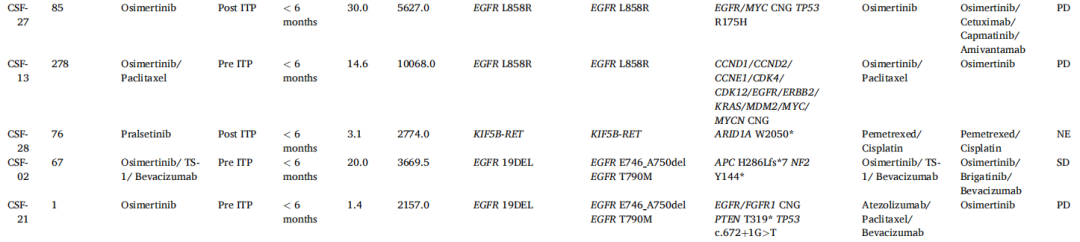
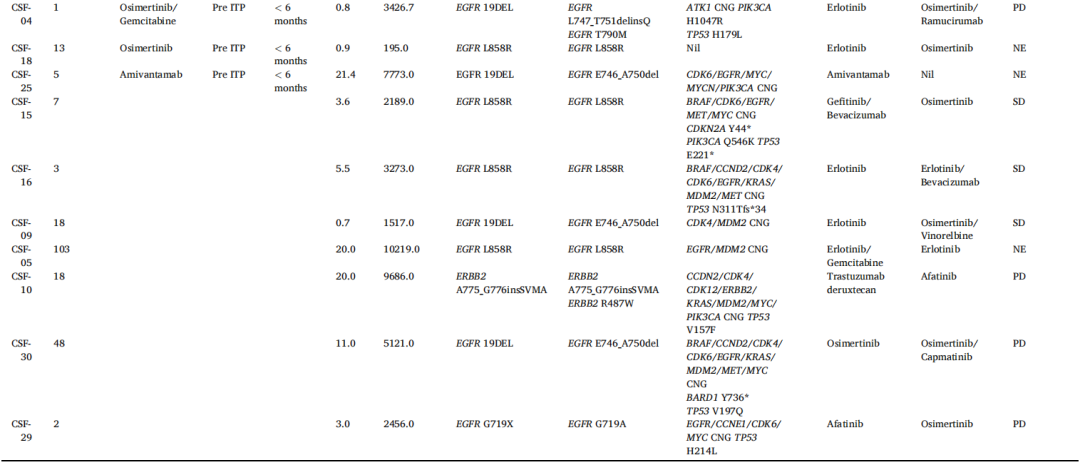
表3
从脑膜转移诊断到脑脊液样本收集的中位间隔为18天(范围,1-453天)。cfDNA的中位核酸输入量为9ng(范围,0.7-30.0ng),而中位分子测序深度达到3669(范围,195-13874)(表3)。低输入DNA与较低的分子深度相关。平均插入片段大小约为160bp(主峰)和320bp(次峰),与先前报道的脑脊液cfDNA标本结果一致。大多数cfDNA浓度测量值低于1ng/μl,仅2份样本超过3ng/μl,最大输入DNA为30ng。值得注意的是,尽管cfDNA输入量适中,但本研究始终能得出阳性结果。
在27份脑脊液样本中,11份恶性细胞检测呈阳性,7份显示可疑/非典型结果,6份为阴性,3份未获得细胞学评估结果(表2)。在6份细胞学结果为阴性的样本(CSF-09、12、16、18、21和24)中,除CSF-24外,所有样本的输入cfDNA均低于6ng。细胞学阳性和非典型样本的cfDNA输入量往往高于阴性结果样本。即使对于6份细胞学阴性样本,从脑脊液cfDNA中识别驱动突变的敏感性也为100%。
对来自25例入组患者(N=25)的27份脑脊液标本(n=27)的分析显示,最常见的共存变异是EGFR CNG(n=19,70.4%),其次是TP53变异(n=14,51.9%)、CDK6 CNG(n=11,40.7%)、MET CNG(n=10,37.0%)、MYC CNG(n=10,37.0%)、CDK4 CNG(n=9,33.3%)和MDM2 CNG(n=8,30.0%)(图1A)。中位TMB为9.44 Muts/Mb,范围为0-25.16(图1A)。
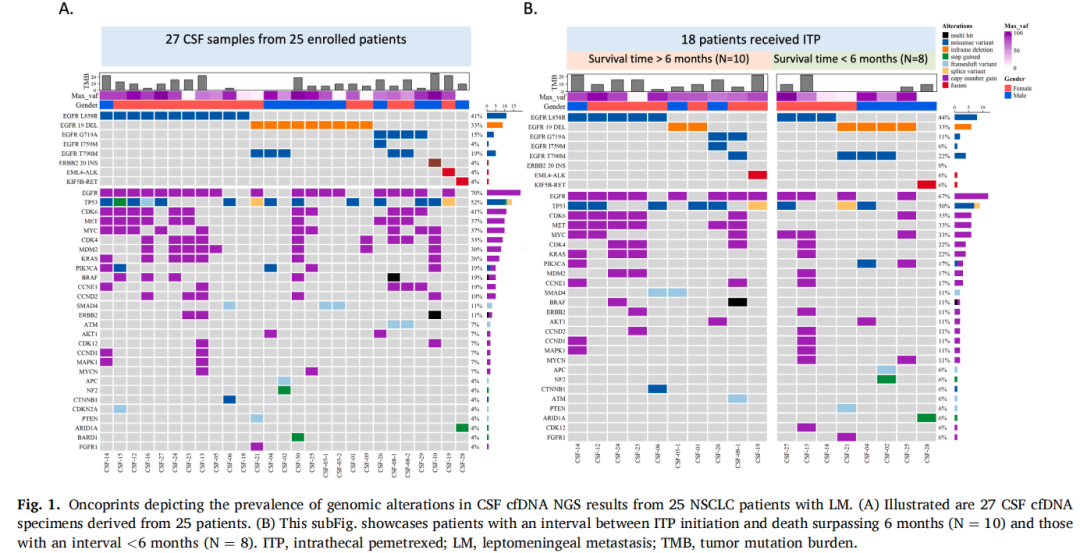
图1
非小细胞肺癌脑膜转移患者的鞘内注射培美曲塞治疗:
在25例患者中,18例(72.0%)接受了ITP治疗,如表1和表2所示。在18例接受ITP治疗的患者中,16例存在EGFR突变,1例存在EML4-ALK融合,其余1例存在KIF5B-RET融合。16例EGFR突变患者中有14例在接受奥希替尼治疗出现疾病进展后接受了ITP治疗。1例存在EML4-ALK融合的患者和1例存在KIF5B-RET融合的患者分别在接受洛拉替尼和普拉替尼治疗出现进展后接受了ITP治疗。ITP的中位治疗终止时间为3.1个月(95.0%CI,0.4-5.7个月)(表2)。
根据神经系统症状和脑部MRI图像的变化评估ITP的疗效。在18例接受ITP治疗的患者中,10例(55.6%)表现出积极的神经系统反应,4例(22.2%)症状稳定,4例(22.2%)症状进展,如表2所示。然而,接受ITP治疗的脑膜转移患者在后续脑部MRI图像中观察到的改善并不显著,仅1例患者(5.6%)的脑部MRI显示部分缓解(表2)。
给予的ITP固定剂量为25-50mg。在18例患者中,4例(22.2%)尽管接受了叶酸和维生素B12补充,仍出现2级或更严重的中性粒细胞减少。值得注意的是,中性粒细胞减少的发生与ITP的给药剂量或治疗终止时间无显著相关性。脑膜转移患者从开始ITP到死亡的中位生存时间为7.4个月(95.0%CI,3.3-11.6)。在18例接受ITP治疗的脑膜转移患者中,10例(55.6%)的生存时间超过6个月(表2)。
探索临床因素/共存基因组变异与ITP生存结局的相关性:
为了确定与ITP治疗后生存时间>6个月相关的预测因素,研究者探究了各种临床因素,包括脑膜转移诊断时合并脑转移、既往脑放疗、既往抗血管生成治疗、脑脊液细胞学检查阳性以及ITP治疗前的既往全身治疗线数。然而,这些临床因素与脑膜转移患者生存时间>6个月缺乏显著相关性。
此外,研究者分析了脑脊液cfDNA谱中存在的共存基因组变异,根据患者生存时间超过6个月和低于6个月进行分类(图1B)。研究者研究了队列中常见的共存基因组变异,包括EGFR T790M、TP53突变,EGFR、MET、MYC、MDM2、CDK4/CDK6/CCND1/CCND2的拷贝数增加,BRAF突变,SMAD4突变和TMB。值得注意的是,接受ITP治疗且存在MET拷贝数增加的患者与生存时间超过6个月显著相关(p=0.007)(图2A)。在6例脑脊液cfDNA中检测到MET拷贝数增加的患者中,5例同时存在CDK6/BRAF拷贝数增加。值得注意的是,这三个基因(CDK6、MET和BRAF)位于7q染色体上。脑脊液中存在EGFR T790M与生存时间<6个月的脑膜转移患者相关(p=0.163)(图2B)。然而,尽管CDK6拷贝数增加和较高TMB与接受ITP治疗且生存时间>6个月的脑膜转移患者相关,但这些关联未达到统计学显著性(分别为p=0.094)(图2C)或(p=0.067)。
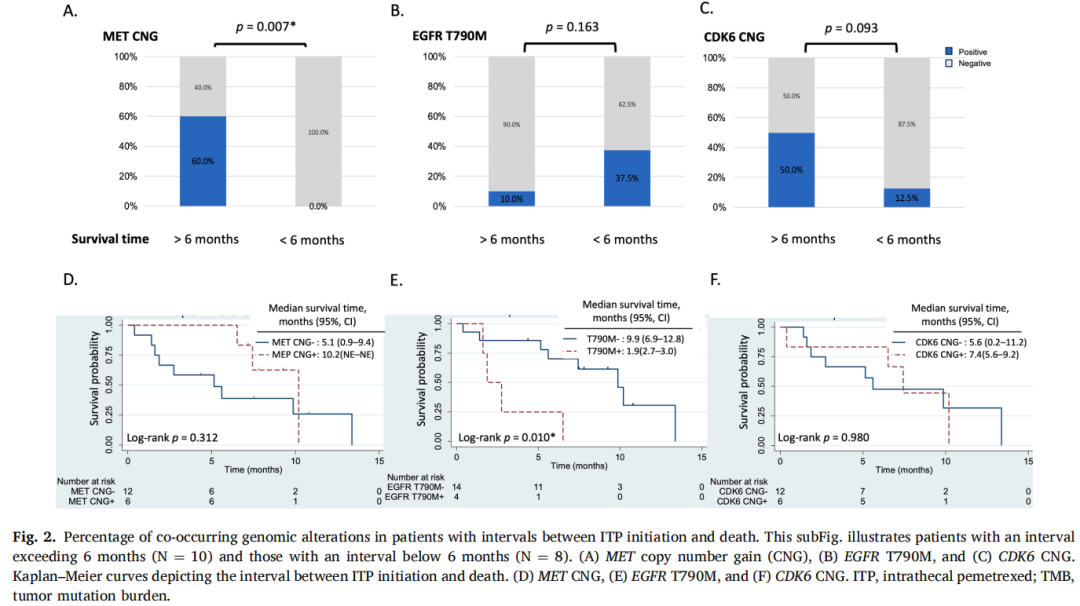
图2
因此,研究者进行了额外分析,深入研究这些特定基因组变异的Kaplan-Meier曲线。脑脊液cfDNA中存在EGFR T790M的患者生存时间显著短于不存在EGFR T790M的患者,ITP治疗后的中位生存时间分别为1.9个月和9.9个月(p=0.010)(图2E)。然而,MET、CDK6、MYC拷贝数增加以及TMB高于或低于9.4的中位值在生存时间上没有显著差异(图2D&F)。
在4例脑脊液cfDNA存在EGFR T790M的患者中,2例在接受奥希替尼治疗期间发生脑膜转移。其余2例在接受奥希替尼治疗期间出现脑膜转移进展。这4例患者的脑脊液cfDNA基因组谱显示EGFR T790M与EGFR非依赖性耐药机制共存(表3)。
关于NGS结果是否指导临床医生的治疗策略,25例入组患者中有18例(72.0%)在脑脊液cfDNA NGS研究结果出来后改变了全身治疗方案(表3)。在根据脑脊液cfDNA NGS结果改变全身治疗方案的18例患者中,7例未接受ITP治疗。其中,3例患者的神经系统症状有所改善(1例同时接受了脑室-腹腔分流术),其余4例患者症状进展。
脑膜转移非小细胞肺癌患者的生存结局:
在25例入组患者中,从脑膜转移诊断到死亡的中位时间间隔(LM-death)为10.4个月(95.0%CI,5.5-15.3)。在18例接受ITP治疗的患者中,LM-death时间间隔略长于未接受ITP治疗的患者,中位间隔分别为10.4个月和7.0个月(p=0.409)。此外,在通过脑脊液cfDNA检测确诊脑膜转移时已存在脑转移的患者中,与无合并脑转移的患者相比,从脑膜转移到死亡的时间间隔有缩短的趋势,中位间隔分别为7.0个月和10.9个月(p = 0.105)。
此外,研究者调查了17例在确诊脑膜转移后接受奥希替尼作为全身治疗的患者的临床结局。17例患者中有14例选择ITP治疗脑膜转移。14例接受ITP治疗的患者的LM-death中位间隔长于其余3例未接受ITP治疗的患者,中位间隔分别为10.4个月和4.8个月(p=0.184)。
25例入组患者的中位总生存期为45.2个月(95.0%CI,26.2-64.2)。接受和未接受ITP治疗的患者的中位总生存期分别为49.1个月和45.2个月(p=0.345)。
脑脊液cfDNA的连续监测:
病例CSF-03,一名41岁男性复发性EGFR突变非小细胞肺癌患者,最初对一线阿法替尼和贝伐珠单抗治疗反应良好,临床改善持续28个月(图3)。在联合治疗期间,通过后续脑部MRI发现新的脑转移和脑膜转移,导致治疗终止。脑脊液细胞学检查未发现恶性肿瘤证据。改用奥希替尼和全脑放疗后,病情稳定7个月,随后出现头痛、眩晕和恶心等进展性症状。后续脑部MRI显示双侧大脑和小脑半球软脑膜信号异常。脑脊液细胞学检查发现腺癌。再分期CT显示疾病进展,纵隔淋巴结肿大,出现新的骨转移灶。患者接受静脉化疗(顺铂-培美曲塞)、ITP和奥希替尼联合治疗,获得5个月的缓解。
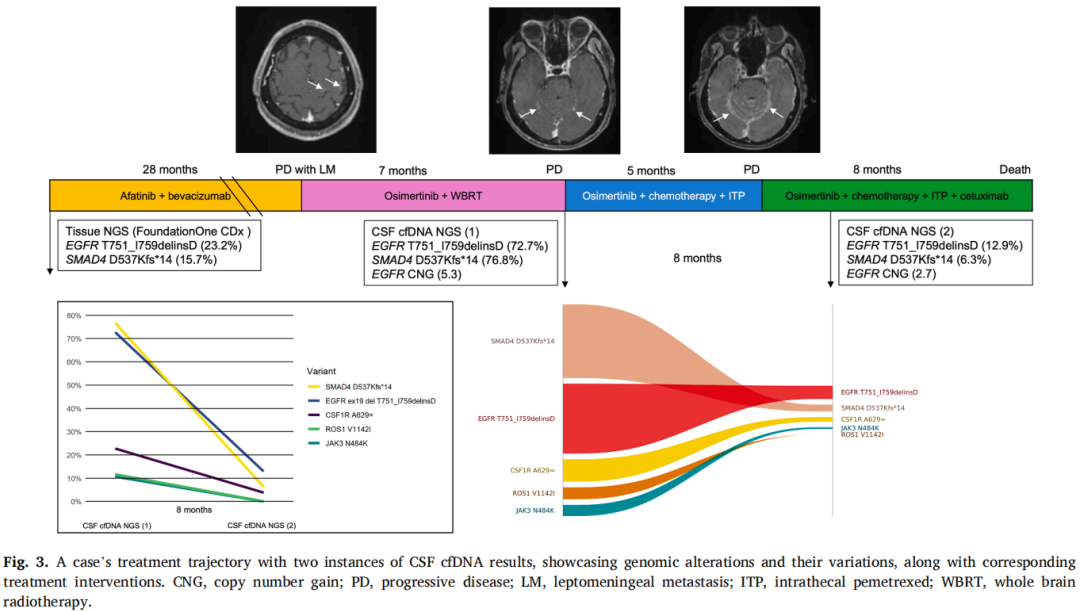
图3
开始ITP治疗前,脑脊液cfDNA分析显示EGFR T751_I759delinsD、SMAD4 D537Kfs*14和EGFR拷贝数增加。ITP治疗5个月后,患者出现进行性认知障碍、近期记忆丧失和全身无力。后续脑部MRI显示幕上和幕下脑区软脑膜强化进展。随后在治疗方案中加入静脉西妥昔单抗,联合奥希替尼、静脉培美曲塞和ITP。联合治疗3个月后,脑脊液cfDNA分析显示脑脊液cfDNA浓度降低(从12.4pg/ul降至6.7pg/ul),EGFR和SMAD4突变等位基因频率降低,以及EGFR拷贝数减少。患者在开始联合治疗后神经系统状态稳定了8个月。不幸的是,他因肺炎去世,从脑膜转移诊断起的总生存期为20个月。
讨 论
本研究旨在探讨脑脊液cfDNA在LM NSCLC患者中的临床应用价值,并探索ITP作为治疗策略的疗效。研究结果揭示了ITP的潜在益处,患者在开始ITP治疗后的中位生存时间为7.4个月。脑脊液cfDNA中同时存在EGFR T790M与EGFR非依赖性耐药变异,与ITP治疗后较短的生存时间相关;而脑脊液cfDNA中存在MET CNG,则与ITP治疗后生存时间超过6个月相关。此外,对脑脊液cfDNA的连续监测显示,随着时间推移,基因组变异会因治疗反应而发生变化。
临床中经常观察到,即使存在明显的脑膜转移,脑脊液中的肿瘤细胞也可能数量稀少或不存在,或因形态异常而难以诊断。相反,先前的研究已证实脑脊液上清液是肿瘤源性DNA的宝贵来源。在本研究中,27份脑脊液cfDNA样本(包括6份细胞学检查阴性的样本)均检测到了原始驱动突变,包括EML4-ALK和KIF5B-RET融合,证实了脑膜转移疾病的分子诊断。本研究结果与先前的研究结果相似,即无论细胞学结果如何,对脑脊液上清液进行基因分型都是一种更灵敏的检测突变和确认脑膜转移受累的方法(对6份细胞学阴性样本的敏感性为100%),即使在cfDNA浓度较低的情况下也是如此。在7例未接受ITP治疗但根据脑脊液cfDNA NGS结果调整了全身治疗方案的患者中,3例(42.9%)获得了神经系统症状的缓解。尽管通常建议在诊断时利用肿瘤或血浆样本通过NGS技术指导晚期非鳞非小细胞肺癌患者的精准治疗,但脑膜转移与脑实质转移相比,具有独特的生长模式和分子特征,且其基因组谱可能与原发肺肿瘤存在差异。因此,通过组织样本再活检或血浆cfDNA的NGS结果来指导脑膜转移的治疗,其疗效可能并不理想。
在本研究中,18例患者接受了ITP治疗,所有患者在接受ITP治疗前均在靶向治疗期间出现了有症状的脑膜转移进展。在这18例患者中,14例(77.8%)通过ITP治疗实现了对神经系统症状的有效控制。仅有4例(22.2%)患者出现了2级或更严重的中性粒细胞减少不良反应。ITP治疗后的中位生存时间为7.4个月,这与先前报道的研究结果一致。因此,本研究结果支持ITP在经过大量治疗、且在靶向治疗后出现脑膜转移进展的非小细胞肺癌患者中具有临床获益和安全性。
在探索性分析中,MET拷贝数增加可作为ITP治疗后生存时间超过6个月的预测指标。MET基因的局灶性拷贝数增加会导致癌基因成瘾,这是 NSCLC 中一种可用药的驱动变异。这种变异可以作为原发性驱动因素出现,也可以作为TKIs治疗后获得性耐药的机制。II期VISION试验的B队列研究了特泊替尼在MET扩增非小细胞肺癌患者中的疗效,该研究分析了基线时的血浆cfDNA生物标志物。分析结果表明,局灶性MET扩增比非局灶性MET扩增与更有利的结局相关。在II期INSIGHT 2研究中,评估了特泊替尼联合奥希替尼在先前接受过奥希替尼治疗的EGFR突变合并MET扩增的非小细胞肺癌患者中的疗效,但未根据MET扩增的局灶性来分析联合治疗的疗效。
此外,目前尚无临床研究探索在获得性MET扩增的脑膜转移患者中,联合使用EGFR抑制剂和MET抑制剂的疗效。在本研究中,所有6例接受ITP治疗且存在MET拷贝数增加的患者,其生存时间均超过6个月。在这些MET拷贝数增加的病例中,有5例基于同时存在7q染色体上的CDK6/BRAF拷贝数增加,被确定为非局灶性。根据II期VISION试验B队列的研究结果,对于非局灶性MET拷贝数增加的患者,加用MET抑制剂可能无法带来临床获益。根据本研究结果,对于合并获得性MET拷贝数增加的非小细胞肺癌脑膜转移患者,无论MET拷贝数增加是否为局灶性,ITP都可被视为一种潜在的治疗选择。
在本分析中,4例脑脊液cfDNA中检测到EGFR T790M的患者,其生存时间显著短于未检测到EGFR T790M的患者。在这4例患者中,1例存在EGFR G719A突变和新发T790M突变的患者,除了在脑脊液cfDNA中检测到亚克隆BRAF V600E外,还同时存在EGFR、MET、MYC、CDK4、CDK6、CCNE1和BRAF的拷贝数增加。其余3例存在EGFR外显子19缺失和获得性T790M突变的患者,其脑脊液cfDNA中分别存在NF2 Y144*、PTEN T319*和PIK3CA H1047R等共存变异。EGFR-TKIs治疗后,由于肿瘤异质性,会出现EGFR T790M与EGFR非依赖性耐药变异共存的情况。具有多种预先存在的耐药机制(如T790M和MET变异)的患者,在接受第三代EGFR TKI(罗西替尼,rociletinib)治疗时,往往表现出较差的应答。同样,初始和后续的ctDNA谱分析显示,在具有EGFR T790M突变的亚克隆肿瘤中,PIK3CA变异富集,这被证明会导致对奥希替尼的耐药。本研究结果强调了EGFR突变非小细胞肺癌脑膜转移患者中肿瘤异质性的重要性。
本研究存在一些局限性。尽管小样本量足以进行初步研究,但更大的队列可能会提供更可靠的见解。此外,本队列中突变的多样性可能会导致影响生存结局的混杂因素。这项回顾性研究在数据收集方面存在固有的局限性,且可能存在选择偏倚。然而,本研究的优势在于,纳入了来自台湾5家医院的更广泛的患者群体和治疗场景,真实反映了实际临床实践,包括对非小细胞肺癌脑膜转移患者ITP治疗的综合分析,以及脑脊液样本细胞学结果的可变性如何通过NGS分析获得成功。
本研究聚焦于复发性或晚期非小细胞肺癌脑膜转移患者,强调了ITP的疗效以及特定基因组变异在预测生存结局中的意义。研究结果为非小细胞肺癌脑膜转移患者的管理提供了重要见解,为个性化治疗方案提供了依据,并揭示了脑脊液cfDNA分析在监测疾病进展和治疗反应方面的潜力。
参考文献:
Liang SK, Liao WY, Shih JY, et al. Clinical utility and predictive value of cerebrospinal fluid cell-free DNA profiling in non-small cell lung cancer patients with leptomeningeal metastasis. Neoplasia. 2025;60:101113. doi:10.1016/j.neo.2024.101113
