高血压是全球性健康问题,可导致血管内皮损伤、动脉硬化等心血管并发症,但内皮修复的具体机制尚不完全清楚。CD34+细胞是一种具有多向分化潜能的干细胞/祖细胞,存在于骨髓、血液和血管壁,被认为参与血管再生,但其在高血压相关内皮修复中的作用尚未明确。传统研究多关注骨髓来源的CD34+细胞,但近年发现非骨髓来源(如血管壁驻留)的CD34+细胞可能具有独特的修复功能。IKCa (钙激活钾通道)在血管功能调节中起重要作用,但其如何影响CD34+细胞的迁移和修复能力尚不清楚。
2025年7月9日,西南医科大学心血管医学研究所程俊教授团队联合浙江大学蒲祥元、徐清波教授团队在Hypertension上发表题为“Impact of IKCa Channels on CD34+ Cells in Arteriole Remodeling in Angiotensin II-Induced Hypertension Model Mice”的研究论文。该研究揭示了非骨髓来源的CD34+干细胞在高血压诱导的动脉内皮损伤修复中的关键作用,并阐明了其机制。研究发现,血管壁驻留的CD34+细胞在血管紧张素II (Ang II)刺激下通过激活IKCa通道和ERK/P38信号通路,促进细胞迁移和内皮修复。单细胞RNA测序进一步揭示了CD34+细胞的异质性及其表型转换过程。这些发现为高血压相关血管损伤的治疗提供了新的靶点,即通过调控IKCa通道或ERK/P38信号通路来增强CD34+干细胞的修复能力,从而改善血管功能。

该研究首先基于CD34谱系示踪小鼠通过建立药物诱导小鼠高血压模型,利用免疫荧光染色技术发现Ang II (血管紧张素II)处理4周后,小鼠肠系膜动脉内皮结构的完整性被破坏;而在停止Ang II输注6周后,内皮完整性部分恢复。统计结果显示,停止Ang II输注6周组中,内皮层tdTomato+CD31+细胞的比例显著高于对照组和Ang II处理4周组,表明CD34+干细胞可能分化为内皮细胞并参与修复过程(图1)。
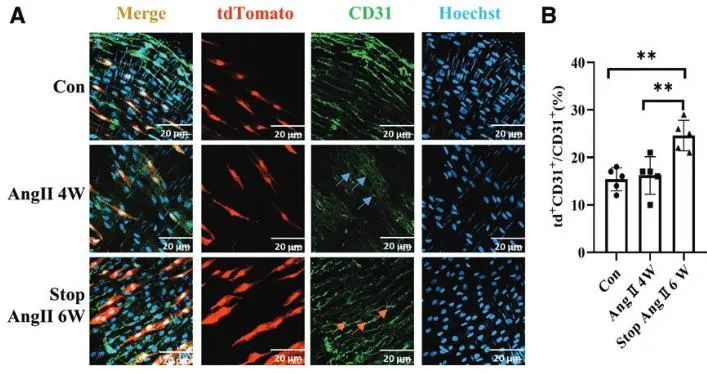
图1. CD34+干细胞参与高血压所致小鼠小动脉损伤的内皮修复
随后,为了探讨非骨髓来源的CD34+干细胞在高血压小鼠内皮修复中的作用。通过骨髓移植实验,发现接受C57小鼠骨髓的CD34-tdTomato小鼠中,内皮标记物CD31与tdTomato的共定位增加;而接受CD34-tdTomato骨髓的C57小鼠内皮层未观察到tdTomato+细胞。此外,两组小鼠在停止Ang II输注6周后的内皮依赖性舒张功能无显著差异,表明非骨髓来源的CD34+干细胞参与了内皮修复。此外,研究人员取肠系膜动脉进行血管环张力实验发现,对照组和停止输注Ang II组中血管本身的舒缩功能两者并无差异,这在功能上证实了血管功能的恢复改善,这种功能上的改善与免疫荧光结果相一致(图2)。
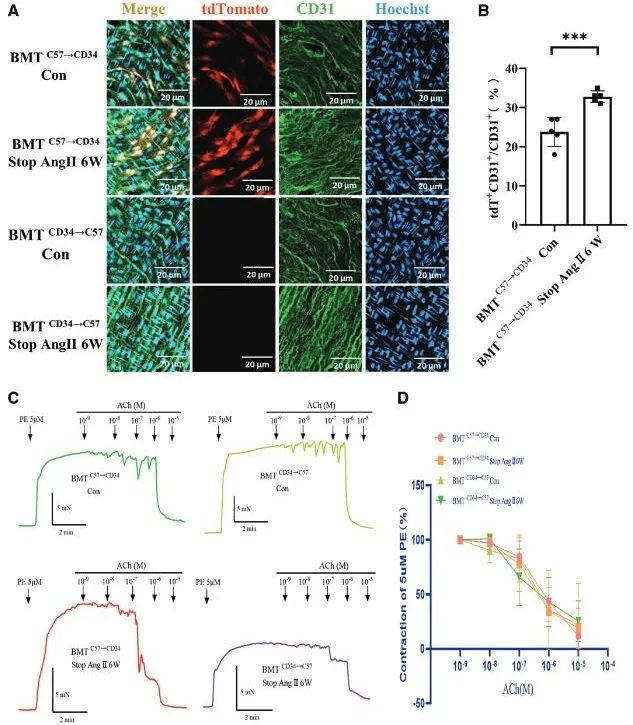
图2. 非骨髓源性CD34+干细胞参与高血压小鼠小动脉内皮修复
进一步,研究为了探明CD34+干细胞的具体亚型和在内皮修复中的关键作用。通过单细胞RNA测序技术,分析了高血压和正常小鼠肠系膜动脉内皮细胞的异质性。研究发现了4个不同的内皮细胞亚群,其中一个亚群(Cluster 1)高表达干细胞标志物(如CD34、Flk-1和Sca-1)。伪时间轨迹分析显示,这些细胞可能通过表型转换参与内皮修复过程,早期与内皮发育相关,晚期与炎症反应和伤口愈合相关(图3)。
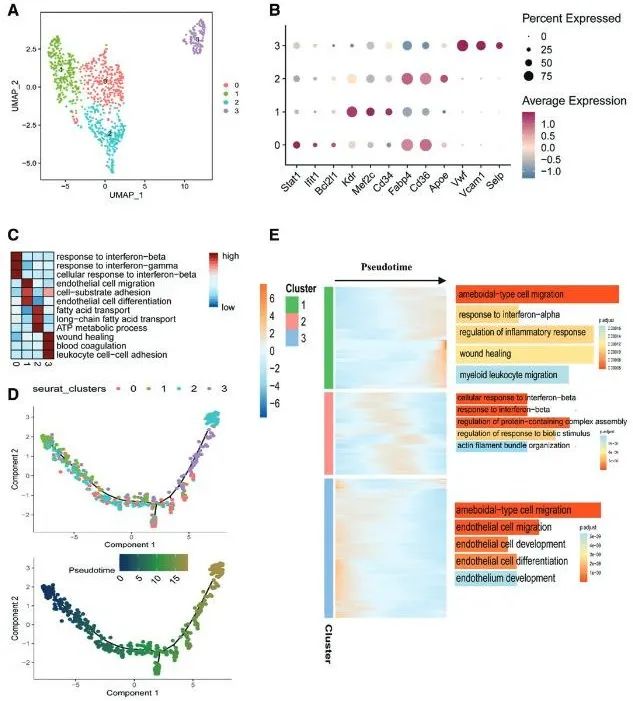
图3. 高血压与正常小鼠肠系膜动脉内皮细胞的单细胞测序分析
为了进一步探明IKCa通道在CD34+干细胞迁移中的作用。研究团队利用免疫荧光和Western blot发现,Ang II处理显著增加了CD34+细胞中IKCa通道的表达,并引起细胞骨架重排。体外实验表明,IKCa通道特异性抑制剂TRAM-34能够抑制Ang II诱导的CD34+细胞迁移,证实IKCa通道在细胞迁移中的关键作用(图4)。而为了探清Ang II对IKCa通道电流和细胞内钙离子浓度的影响,研究人员利用全细胞膜片钳实验技术对细胞的该通道电流进行了记录,结果表明Ang II显著激活了IKCa通道电流,而TRAM-34可逆转这一效应。此外,Ang II还引起细胞内钙离子浓度快速升高,进一步支持IKCa通道在CD34+细胞迁移中的作用(图5)。
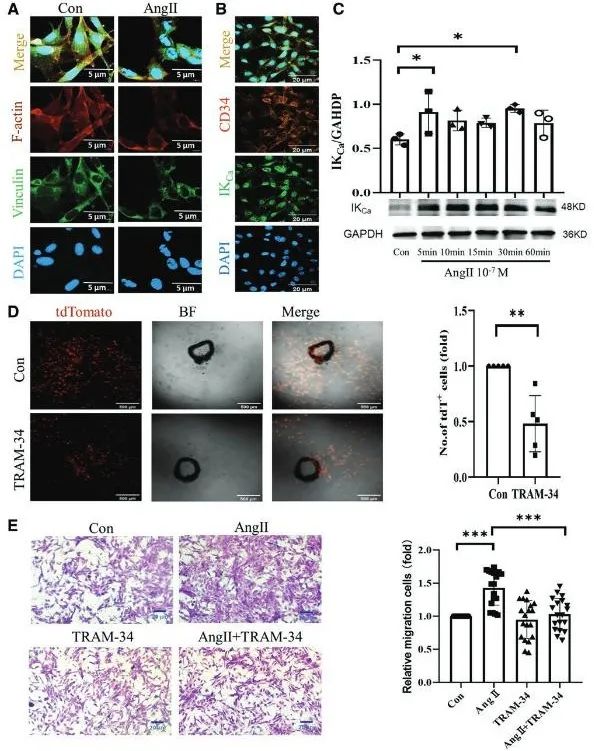
图4. IKCa通道调控血管紧张素II (Ang II)诱导的CD34+干细胞的迁移
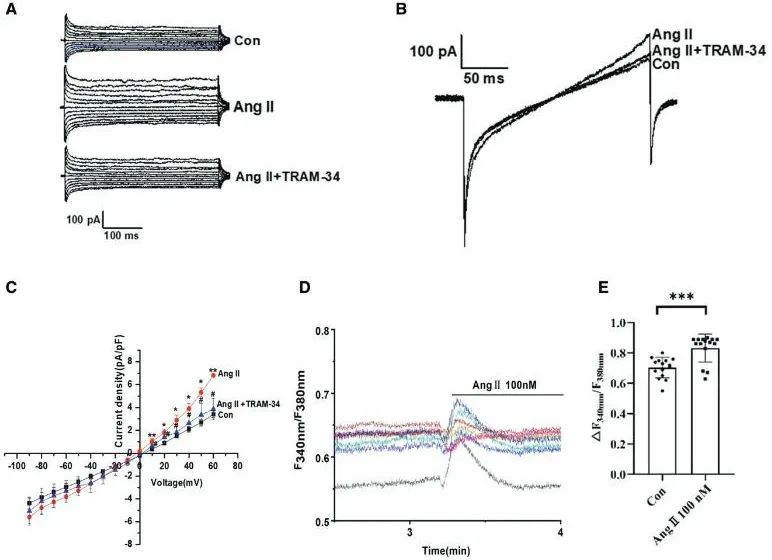
图5. Ang II (血管紧张素II)对CD34+干细胞上IKCa通道电流和细胞内钙离子浓度的影响
为了进一步探究IKCa通道促进CD34+干细胞迁移的分子机制,研究利用Western blot对细胞内的相关第二信使进行分析,结果表明Ang II激活了ERK和P38的磷酸化,而TRAM-34抑制了这一过程。Transwell实验证实,ERK抑制剂PD98059显著减少了Ang II诱导的CD34+细胞迁移,表明ERK/P38信号通路在迁移中起重要作用(图6)。
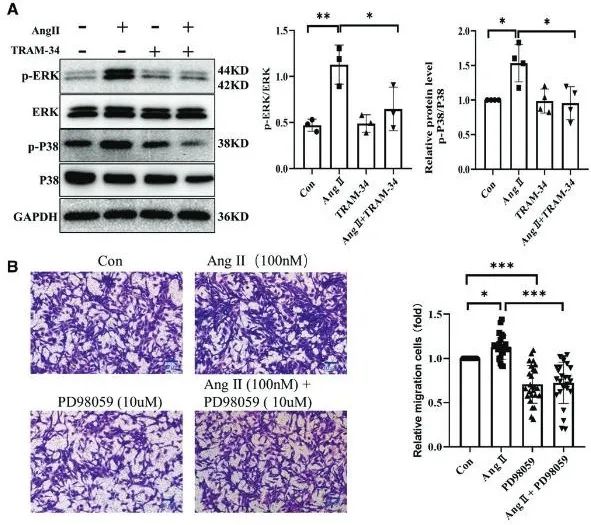
图6. IKCa通道介导的信号通过ERK/P38通路调控CD34+干细胞迁移
综上所述,该研究表明,在Ang II诱导的高血压模型中,血管壁的CD34+细胞通过激活IKCa通道和ERK/P38通路促进迁移,参与小动脉内皮修复。单细胞测序揭示了其异质性和表型转换。实验证实,抑制IKCa通道(用TRAM-34)或ERK/P38通路会阻碍细胞迁移。这揭示了高血压血管损伤修复的新机制,为其靶向治疗提供了新思路。
西南医科大学心血管医学研究所田海、廖心,广州华商职业学院谢诚为文章共同第一作者,西南医科大学心血管医学研究所程俊教授、浙江大学附属第一医院蒲祥元、徐清波教授为该文章的共同通讯作者。同时该研究得到了西南医科大学心血管医学研究所杨艳教授和李鹏云教授的大力支持。
该工作得到了国家自然科学基金、浙江省自然科学基金、四川省科技厅以及泸州市人民政府与西南医科大学科技战略合作项目的资助。
原文链接:
https://www.ahajournals.org/doi/10.1161/HYPERTENSIONAHA.124.24537