全球肝脏疾病总体发病率呈逐年上升趋势,已成为第五大致死疾病。全世界每年约有200万人死于肝病,其中约50%死于肝硬化并发症,50%死于病毒性肝炎相关肝衰竭和肝癌。然而,各种原因导致的慢性肝病进展为肝硬化及肝癌的分子机制尚未完全阐明。肿瘤坏死因子超家族因子14(TNFSF14,即LIGHT)是肿瘤坏死因子超家族的重要成员,参与调节T淋巴细胞增殖与细胞因子分泌、活化和诱导未成熟树突状细胞(iDC)成熟、诱导肿瘤细胞凋亡等多种生物学过程,在炎症性疾病、纤维化疾病、抗肿瘤免疫中发挥着重要的调节作用。本文就LIGHT在慢性肝病进展为肝硬化、肝癌过程中的作用及可能机制作一综述,旨在为逆转或阻断慢性肝病的不良进展提供新的理论依据和治疗靶点。
1LIGHT的生物学功能
1.1 LIGHT的结构和分布
LIGHT也被称为疱疹病毒进入介质配体(HVEM-L),由Mauri等于1997年首次报道。LIGHT是由240个氨基酸组成的细胞表面Ⅱ型跨膜糖蛋白,其结构包括N端胞内区、跨膜区及C末端胞外区。LIGHT可经细胞表面的基质金属蛋白酶切割后产生分泌型LIGHT(sLIGHT),作为可溶性细胞因子分泌到细胞外,进而发挥其生物学作用。
LIGHT在不同组织和细胞中呈现选择性表达。研究表明,LIGHT在脾脏中呈高表达,而在心脏、肺、肝、肾等组织中呈低表达。LIGHT主要来源于免疫组织中的免疫细胞,如活化的T淋巴细胞、iDC及活化的自然杀伤细胞(NK细胞)。其功能包括刺激T淋巴细胞增殖、诱导iDC成熟、促进Th1型细胞因子产生及促进NK细胞激活等。此外,激活的外周血单核细胞及脂多糖刺激的中性粒细胞中也可检测到LIGHT的表达。
1.2 LIGHT受体的结构和分布
目前已证实可与LIGHT结合的三种受体分别为疱疹病毒进入介质(HVEM/TR2)、淋巴毒素β受体(LTβR)及可溶性诱饵受体3(DcR3/TR6),三者均属于TNFRSF成员。HVEM、LTβR为Ⅰ型跨膜蛋白,其结构包括3个主要区域:胞外区、跨膜区和胞内区。然而,HVEM和LTβR不具备TNFRSF典型的死亡结构域,但含有肿瘤坏死因子受体相关因子(TRAF)家族成员的结合位点。DcR3缺乏跨膜区,可作为可溶性LIGHT的受体,发挥抑制作用。
LIGHT通过与其3个不同的受体HVEM、LTβR及DcR3结合,发挥不同的生物学作用。HVEM主要表达于静止的T淋巴细胞、B淋巴细胞、单核细胞、NK细胞及iDC。LIGHT与HVEM的结合,可为T淋巴细胞激活提供共刺激信号,从而刺激T淋巴细胞增殖,促进IFN-γ分泌。LTβR主要表达于基质细胞和肿瘤细胞,而在淋巴细胞和树突状细胞(DC)中不表达。LIGHT与LTβR结合所传递的信号可诱导细胞凋亡,并促进细胞因子的产生。DcR3表达于内皮细胞、激活的Jurkat细胞及部分肿瘤细胞系(如大肠癌细胞SW480)。DcR3可与HVEM或LTβR竞争性结合LIGHT,抑制LIGHT介导的T淋巴细胞增殖和肿瘤细胞凋亡效应,在调节LIGHT功能中发挥重要作用。
1.3 LIGHT信号通路及其生物学效应
LIGHT可与HVEM、LTβR和DCR3 3种受体结合,通过与TRAF介导的信号转导途径,传递激活或抑制信号,进而引发多种生物学效应,包括刺激T淋巴细胞增殖,诱导iDC成熟、炎症反应及细胞凋亡等。LIGHT的信号转导的研究主要集中在其对T淋巴细胞的激活和诱导肿瘤细胞凋亡方面。HVEM和LTβR介导的信号转导通路均依赖于TRAF。LIGHT与HVEM结合后,可招募并激活TRAF2和TRAF5,通过激活凋亡信号调节激酶1,进而诱导核因子-κB(NF-κB)和c-Jun N末端激酶(JNK)/激活蛋白1信号通路的激活,促进T淋巴细胞增殖分化和IFN-γ的分泌。此外,与肿瘤细胞表面的LTβR结合后,可招募TRAF2和TRAF3,激活NF-κB信号通路,促进细胞凋亡。同时,LIGHT还可激活半胱天冬酶(caspase)介导的细胞凋亡途径。LIGHT的主要信号转导通路机制见图1。
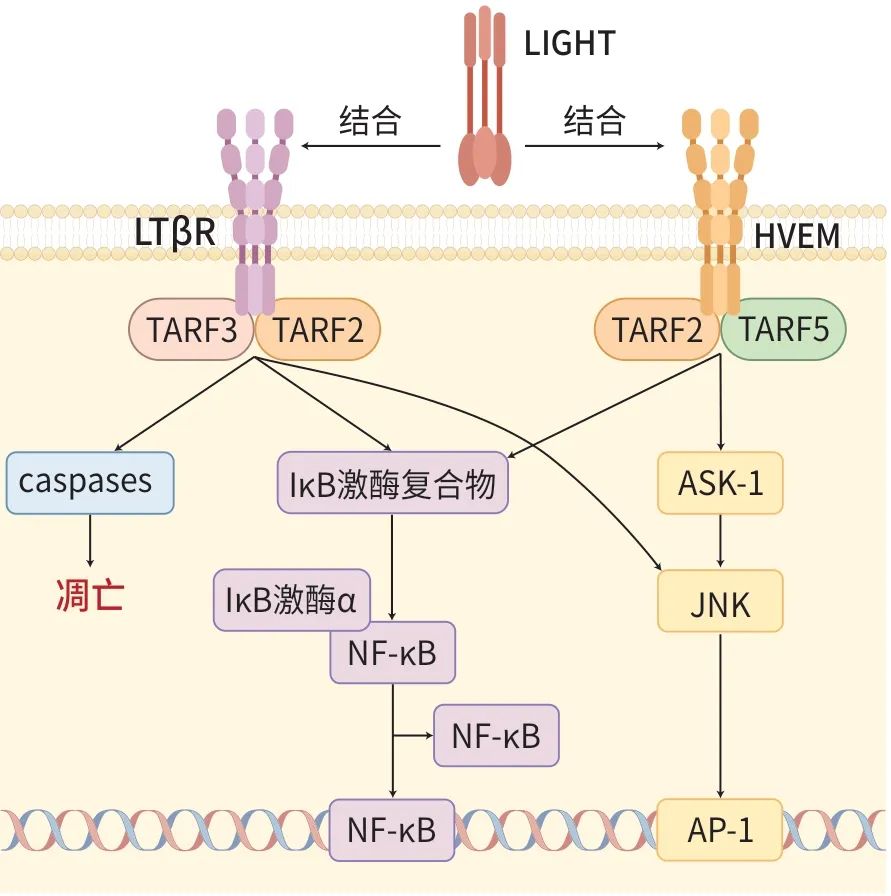
注: ASK-1,凋亡信号调节激酶1;AP-1,激活蛋白1。
图1 LIGHT的主要信号转导通路机制
2LIGHT与慢性肝病
2.1 LIGHT与肝脏炎症
肝脏炎症是指肝脏因病毒、药物、酒精或代谢异常引起的炎症改变。可溶性LIGHT作为促炎因子参与炎症反应,引起组织损伤。因此,LIGHT可作为组织炎症的重要促进剂及炎症激活的潜在标志物。研究表明,慢性丙型肝炎患者血浆中LIGHT水平升高,活化的T淋巴细胞是可溶性LIGHT的主要来源,提示LIGHT在全身炎症激活中发挥重要作用。另有研究报道,慢性乙型肝炎及慢性丙型肝炎患者肝组织中LIGHT mRNA水平较健康对照者显著升高,表明LIGHT参与了慢性病毒性肝炎的发生发展过程。与上述研究结果一致,另有研究发现,临床重症肝炎患者肝组织中LIGHT、HVEM、LTβR mRNA水平较健康对照者显著升高。此外,该研究在3型鼠肝炎病毒诱导的暴发性病毒肝炎模型中发现,与LIGHT基因敲除组相比,野生型小鼠肝组织坏死明显,且HVEM、LTβR mRNA水平显著升高,提示LIGHT可能通过HVEM和/或LTβR相互作用促进肝炎的发生发展。另一项研究探讨了LIGHT在病毒性肝炎中的作用机制,采用腺相关病毒制备HBV持续感染小鼠模型,发现腺病毒载体表达的LIGHT可增强CD8+T淋巴细胞诱导的肝脏炎症并清除腺相关病毒。此外,在LTβR基因敲除小鼠中,LIGHT未引起显著的肝脏炎症,提示LIGHT与LTβR相互作用在肝脏炎症中起关键作用。
大多数病毒性肝炎涉及Toll样受体3(TLR3)的激活。有研究在TLR3激动剂聚肌胞苷酸(PIC)诱导的病毒性肝炎小鼠模型中发现,小鼠肝组织中LIGHT蛋白和mRNA表达水平显著升高,这种诱导作用依赖于NF-κB的激活,用NF-κB抑制剂预处理小鼠可抑制LIGHT的上调。此外,用重组LIGHT受体HVEM蛋白阻断LIGHT信号通路可减轻PIC诱导的肝脏炎症。上述结果表明,NF-κB介导的LIGHT在TLR3参与的肝炎中发挥重要作用,提示LIGHT可能成为肝脏炎症治疗的潜在药物靶点。
近年来,研究发现HBV DNA质粒和LIGHT质粒的共免疫可引起更强的体液免疫和细胞免疫应答,因此LIGHT作为HBV DNA接种疫苗的有效免疫佐剂成为研究热点。在HBV转基因小鼠模型研究中,重组LIGHT腺病毒载体修饰的DC组成的HBV DNA疫苗可增强HBV诱导的CD8+T淋巴细胞应答,并降低血清中HBsAg和HBV DNA水平。体外实验进一步研究发现,自噬在T淋巴细胞活化中发挥重要作用,阻断自噬可促进凋亡,抑制CD8 +T淋巴细胞进入S期,并减弱LIGHT介导的DC诱导的T淋巴细胞反应。以上结果表明,靶向DC慢病毒载体(LVDC-UbHBcAg-LIGHT)的HBV DNA疫苗可能被用作治疗策略,以更高的安全性抵抗持续的HBV感染。
代谢相关脂肪性肝病(MAFLD)是与脂质代谢紊乱、胰岛素抵抗等代谢综合征有关的肝病。有研究报道,MAFLD患者血清中LIGHT及HVEM、LTβR水平均升高,且与疾病严重程度呈正相关,在细胞实验中进一步发现,LIGHT以时间和剂量依赖性方式显著增加Huh7肝细胞IL-8的释放,且活性氧(ROS)(来源于H2O2)增强了Huh7细胞中LIGHT介导的IL-8释放,提示LIGHT可能通过ROS相互作用促进肝脏炎症。有研究进一步探讨了LIGHT对小鼠MAFLD发病机制的影响,发现高脂肪高胆固醇喂养的野生型小鼠肝组织中LIGHT及HVEM和LTβ水平显著升高。与野生型小鼠相比,LIGHT基因敲除小鼠中糖耐量减低和胰岛素抵抗均改善,且肝组织中CD3+T淋巴细胞和F4/80+巨噬细胞均降低,以及脂肪组织中F4/80+CD11c+巨噬细胞减少,同时,脂肪组织促炎因子单核细胞趋化蛋白1、TNF-α和IL-17,以及全身炎症因子TNF-α和IL-6水平均降低,且参与MAFLD发病机制的关键基因Krüppel样因子6和TLR4水平均降低。上述结果表明,在高脂高胆固醇喂养条件下,阻断LIGHT可改善糖耐量异常及胰岛素抵抗,减轻非酒精性脂肪肝及肝脏炎症反应,提示阻断LIGHT依赖性信号传导可能有助于恢复肝脏稳态和抑制MAFLD的发生发展。与上述研究结果一致,另一项研究也表明LIGHT可促进MAFLD的发生发展,抑制LIGHT可预防MAFLD。该研究发现,高脂肪高胆固醇喂养的MAFLD小鼠血清中LIGHT表达水平升高,且游离脂肪酸刺激肝细胞后LIGHT水平升高并诱导细胞凋亡。敲低LIGHT或LTβR可减弱游离脂肪酸诱导的肝细胞凋亡。通过通路分析进一步发现,作为LIGHT启动子的上游调控因子HES5表达下调。机制研究表明,HES5与沉默信息调节因子1(SIRT1)相互作用,促使LIGHT启动子上的组蛋白p/p去乙酰化,进而抑制LIGHT转录。敲低HES5可增强LIGHT诱导的凋亡作用。上述结果揭示了游离脂肪酸通过抑制HES5表达促进LIGHT升高诱导肝细胞凋亡的新机制。
与上述研究结果相反,有研究表明LIGHT改善了MAFLD的发生发展。在高脂肪喂养的野生型小鼠模型中,小鼠血清LIGHT水平升高,且LIGHT来源于肝脏和白色脂肪组,与对照组相比,LIGHT敲除小鼠表现出更严重的葡萄糖不耐受、胰岛素抵抗、肝脂肪变性、线粒体功能障碍及肥胖。肝细胞因子分析结果进一步发现,IL-6水平降低在LIGHT敲除小鼠的代谢紊乱中可能发挥重要作用。此外,在高脂肪饮食诱导的肥胖小鼠模型中,TNFSF14的衍生分子TNFSF14 7肽改善了高脂肪饮食诱导的葡萄糖不耐受、胰岛素抵抗和高胰岛素血症,且显著减少了肝脂肪变性。此外,TNFSF14 7肽激活磷酸化AMPK信号通路,提示LIGHT可能为MAFLD患者开辟一条全新的治疗途径。上述不同的研究结果提示,LIGHT在肝脏代谢性疾病中发挥着复杂的作用,推测与不同的实验设置、饮食喂养条件和使用的小鼠模型有关。
2.2 LIGHT与肝纤维化/肝硬化
最新研究表明,LIGHT在纤维化环境中高表达,主要来源于活化的T淋巴细胞,是纤维化和组织重塑的重要驱动因素,可促进纤维化疾病如哮喘、特发性肺纤维化、肾纤维化、心脏纤维化、食管纤维化等的进展。机制上,LIGHT作用于上皮细胞、成纤维细胞及免疫细胞等细胞中HVEM或淋巴毒素-β(LT-β)受体信号通路,促进促纤维化因子如TGF-β、IL-13和TSLP,以及趋化因子、黏附因子和金属蛋白酶的表达,随后导致上皮细胞、成纤维细胞和平滑肌细胞等细胞增殖,细胞外基质沉积,血管损伤,以及免疫炎症反应,共同形成纤维化。因此,LIGHT被视为阻止组织纤维化的潜在新靶点。
为探讨LIGHT在肝纤维化中的作用,一项对原发性硬化性胆管炎(PSC)肝组织进行全基因组关联研究发现,PSC肝组织中LIGHT及其受体TNFRSF14表达增加,且免疫组化结果进一步证明,LIGHT在PSC胆管上皮细胞的表达率(53%)高于原发性胆管炎(15%)和健康人群(0),且LIGHT与纤维化进展呈正相关,提示LIGHT与PSC发生发展密切相关。另一项研究发现,PSC、原发性胆管炎等慢性肝病患者肝组织中转录因子NF-κB家族成员RELB核易位水平及下游基因LT-β水平均升高。在胆汁淤积性肝纤维化小鼠模型(CyldΔLPC)中发现,肝脏中RELB及下游因子LIGHT、LT-β mRNA表达水平升高且胆小管反应及胆道纤维化显著增加,提示LIGHT可能与胆汁淤积性肝纤维化发生发展密切相关。此外,该研究还发现,RELB在CyldΔLPC小鼠的胆管反应和胆管纤维化的发展中是必需的,敲除RELB可以保护小鼠避免发生胆汁淤积性肝纤维化。与上述结果研究相似,在另一项研究的小鼠胆总管结扎胆汁淤积模型中,小鼠肝组织RELB及其下游基因LIGHT水平显著升高。此外,该研究发现,雷公藤甲素不仅通过降低RELB表达来抑制人肝内胆管上皮细胞增殖,且通过降低RELB及LIGHT水平缓解胆管反应、肝脏炎症及纤维化,从而抑制胆汁淤积性肝纤维化的发展,提示LIGHT是胆汁淤积性肝纤维治疗的潜在靶点。有研究进一步提供了LIGHT过度表达导致肝硬化的证据,在肝硬化脾功能亢进患者和刀豆蛋白A诱导的肝纤维化小鼠模型中,血清LIGHT水平升高,LIGHT主要来源于脾和肝巨噬细胞,脾切除术后LIGHT水平下降。细胞实验进一步发现,LIGHT处理共培养的巨噬细胞系RAW264.7和肝星形细胞系JS1细胞后,LIGHT通过激活JNK/TGF-β促进JS1细胞纤维化和αSMA水平升高。此外,该研究还发现,在脾切除的情况下给予小鼠重组LIGHT蛋白诱导肝纤维化,阻断LIGHT蛋白改善了肝纤维化。提示LIGHT通过激活JNK/TGF-β1信号通路促进肝星状细胞活化并导致肝纤维化,脾切除术通过降低LIGHT的表达减轻肝纤维化。以上结果表明,LIGHT促进肝纤维化的进展,可作为肝纤维化治疗的潜在靶点。
2.3 LIGHT与肝癌
LIGHT的抗肿瘤效应是最早被揭示的生物学效应之一。研究表明,LIGHT具有直接诱导肿瘤细胞凋亡的作用,同时对T淋巴细胞具有共刺激作用,因此在肿瘤免疫治疗中展现出广阔的应用前景。多项研究显示,LIGHT可直接诱导肝癌细胞凋亡,并可协同增强IFN-γ诱导的肿瘤细胞凋亡。Han等研究发现,LIGHT通过下调B淋巴细胞瘤-2基因和生存素表达,分别通过线粒体途径及p53非依赖途径诱导肝癌细胞HepG2凋亡。另一体外实验研究表明,LIGHT与LTβR结合,激活caspase-9和caspase-3,同时抑制STAT3磷酸化,下调B淋巴细胞瘤-XL表达,进而诱导肝癌细胞HepG2和Hep3B凋亡,提示线粒体凋亡途径可能是LIGHT诱导细胞凋亡的重要机制。此外,在Hep3BT2肝癌细胞的研究中,LIGHT可通过与LTβR相互作用,经caspase非依赖的信号传导途径诱导细胞凋亡,这一特殊凋亡途径进一步丰富了LIGHT诱导肿瘤细胞凋亡的机制。研究表明,LIGHT作为促凋亡因子在肿瘤细胞凋亡中发挥重要作用。笔者团队研究发现,硫化氢通过JNK/JunB信号通路上调TNFSF14的转录,从而促进肝癌细胞凋亡,而敲低TNFSF14可抑制硫化氢诱导的细胞凋亡(相关数据待发表)。
此外,在抗肿瘤过程中,LIGHT可刺激效应T淋巴细胞增殖和分化,抑制调节性T淋巴细胞活性。对96例行结直肠癌肝转移切除术的肝肿瘤组织进行基因芯片分析发现,TNFSF14/LIGHT基因表达水平升高与患者总生存期和无复发生存期的改善显著相关。免疫组织化学染色结果进一步证实,肿瘤组织中较多的肿瘤浸润淋巴细胞(TIL)以及TIL中LIGHT高表达与患者总生存期和无复发生存期的改善相关。上述研究结果表明,LIGHT基因是影响结直肠癌肝转移切除术后患者生存预后的重要因素。
在结直肠癌肝转移免疫活性同基因动物模型中,原发灶和肝转移灶肿瘤微环境中TIL数量较少,且TIL中LIGHT表达水平较低。通过增加原发肿瘤或肝转移灶肿瘤微环境中LIGHT表达,在细胞毒性T淋巴细胞介导的抗肿瘤免疫作用下,可触发原发肿瘤的消退,并减缓肝转移灶的生长。这些反应与TIL数量的显著增加以及肝转移灶中淋巴细胞归巢信号表达水平升高相对应。上述研究结果表明,在原发肿瘤和结直肠癌肝转移中,增加LIGHT表达可增强T淋巴细胞增殖、活化和浸润,从而增强肿瘤特异性免疫介导的肿瘤消退。基于上述研究结果,LIGHT有望成为治疗肝脏肿瘤的一种新型免疫治疗策略。
此外,LIGHT可能成为肝细胞癌(HCC)治疗的潜在生物标志物。对18例接受索拉非尼联合信迪利单抗或仑伐替尼联合信迪利单抗一线治疗的HCC患者标本进行RNA测序和T淋巴细胞受体测序分析,结果显示,与肝脏代谢和免疫微环境相关的8个基因,包括TNFSF14等,其信使RNA和长链非编码RNA表达水平在部分缓解/疾病稳定组与疾病进展组之间存在显著差异,提示这些指标可用于预测治疗效果并进行疗效分层。TNFSF14有望成为HCC患者接受一线联合免疫治疗疗效分层的潜在生物标志物。
LIGHT还可能作为HCC的潜在预测生物标志物。近年研究发现,脂质代谢紊乱在HCC的发生发展中起重要作用。过氧化物酶体增殖物激活受体α(PPARα)作为一种配体激活的转录因子,参与调节脂肪酸氧化和炎症反应。研究表明,MAFLD/代谢相关脂肪性肝炎患者肝组织中PPARα表达水平随纤维化进展而降低。另一项研究采用WGCNA(加权基因共表达网络分析)算法,构建了PPARα激动剂WY-14643处理的肥胖人肝组织中差异表达基因的共表达网络,鉴定出8个核心枢纽基因,其中TNFSF14等基因与PPARα激动剂处理呈负相关,提示TNFSF14可能是HCC中与PPARα活性相关的候选生物标志物。
3小结和展望
LIGHT主要表达于活化的T淋巴细胞、激活的NK细胞及iDC表面,其受体在肿瘤细胞与淋巴细胞上广泛表达。在慢性肝病中,LIGHT通过与受体结合,刺激T淋巴细胞和诱导细胞凋亡,在调节炎症反应、促进纤维化及抗肿瘤免疫等过程中发挥重要作用。目前,关于LIGHT调控肝脏疾病的作用机制研究主要集中在病毒性肝炎、MAFLD和HCC等领域。然而,LIGHT在肝纤维化发生发展中的作用机制尚未得到广泛探索,其对其他慢性肝脏疾病的调控作用也尚未明确。因此,深入探讨LIGHT在肝脏疾病发生、发展及治疗中的分子机制,对肝脏疾病的预防和治疗具有重要意义。靶向LIGHT可能为肝脏疾病的治疗提供新的潜在靶点。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50427
