从软骨“缺电”说起:为什么需要可降解“自供电贴片”?
软骨是一种高度依赖力学电信号维持功能的组织,其压电特性与胶原变形密切相关,能够通过机械应变诱导应变电位(SGP),进而激活细胞信号通路、调控细胞分化与基质生成。在骨关节炎(OA)患者中,这种天然电刺激环境被严重破坏,造成软骨再生极为缓慢甚至不可逆退化。
为此,科学界提出利用可植入的生物电子器件在人体运动过程中产成电荷,以模拟SGP,辅助修复软骨。尽管现有压电、摩擦电贴片等装置已在动物实验中初现疗效,但其存在体内电荷输出不足、依赖外部激发、降解性和刺激强度存在矛盾等问题,严重制约了其临床转化。
创新设计:压电+摩擦电协同,材料与结构协同
2025年7月1日,浙江大学信电学院骆季奎教授、浙江大学医学院附属第二医院冯刚教授、中国科学院北京纳米能源与系统研究所王中林院士等团队在《ACS Nano》期刊发表题为《Biodegradable Piezo-triboelectric Charge Nanogenerator Patch for Cartilage Regeneration》的最新研究成果(DOI: 10.1021/acsnano.4c18811),共同第一作者为张凯航和吴怡梵。团队开发出一种植入式可降解压电-摩擦电耦合纳米发电贴片(PTEG),可在关节运动过程中自发产生电荷,恢复软骨天然电环境,从而显著促进软骨再生,为骨关节炎治疗提供了一种“无需外源供能”的全新策略。

本研究提出的PTEG贴片在设计上融合了结构增强与材料功能两大策略。其核心结构采用了3D打印反模配合温度梯度冷冻干燥(IMFD)工艺,构筑出宏观金字塔和微观多孔结构的双层膜材料,一层为掺杂六方氮化硼纳米片(BNNS)的聚乙烯醇(PVA)膜,一层为明胶膜,从而极大提升了表面接触面积和摩擦电效应。
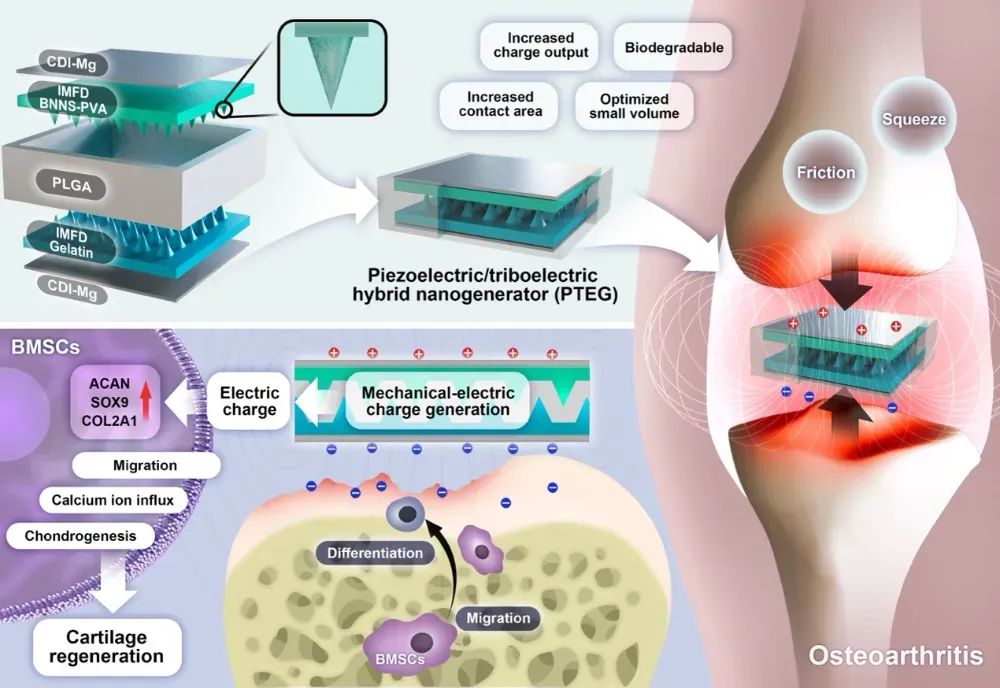
图1 可降解PTEG及其电荷介导的骨关节炎治疗机制示意图
更重要的是,BNNS在PVA膜中实现了垂直取向排列,赋予其无需极化即具压电性能,压电系数高达24.3 pC N-1。宏观形貌增强了摩擦电,微观结构激发了压电,二者耦合产出的单位面积电荷密度达到了体外的242 μCm-2、体内的84 μCm-2,超过现有可植入发电装置一个数量级以上。
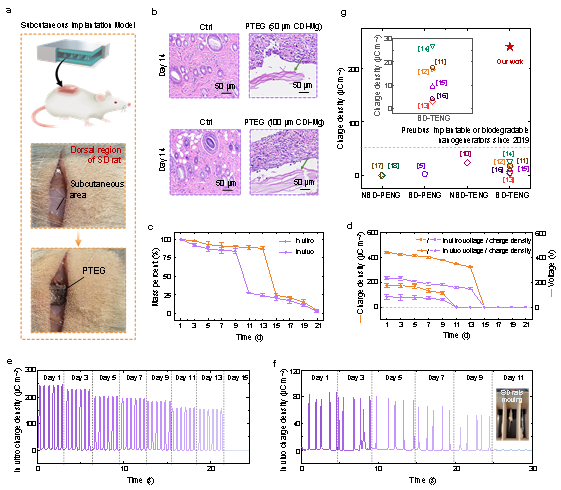
图2 PTEG的生物降解性与输出变化
此外,PTEG器件表现出良好的可控降解性(15~60天)、优异的生物相容性与组织适配性,无明显免疫反应或器官毒性。
植入式贴片:“走路即可发电”,软骨再生显著提升
该贴片可以通过关节运动产生机械压力,实现自发电。在OA模型大鼠中,研究人员将贴片植入膝关腔内,并每日进行30分钟跑步刺激。实验显示,PTEG贴片显著促进了骨髓间充质干细胞(BMSCs)迁移,增强了细胞钙离子内流,并上调了软骨分化标志基因(SOX9、COL2、ACAN)表达。
组织切片显示,PTEG组大鼠在4~8周时的关节软骨形貌保持良好,胶原分布均匀,骨赘体积明显减少。相比对照组,骨赘体积减少近50%,OARSI评分显著下降,再生软骨中COL2和ACAN含量显著升高。
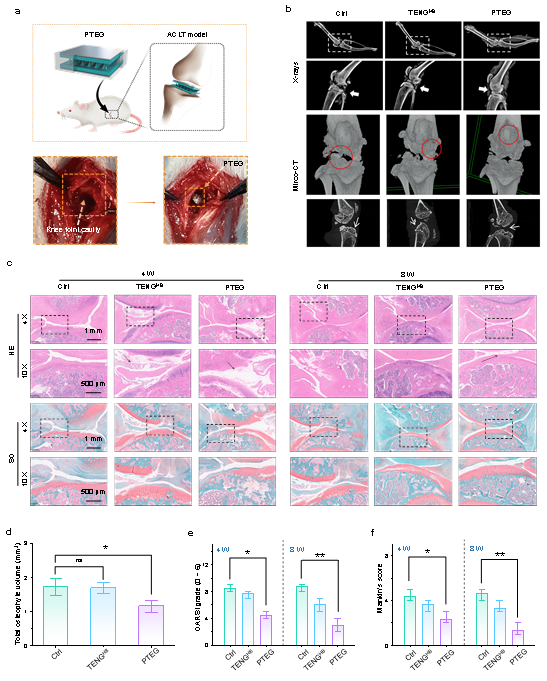
图3 PTEG在骨关节炎大鼠模型中的治疗效果
走向“植入即忘”的新一代生物电子治疗
与依赖外部能量源或遗传调控的传统方法不同,本研究提出的PTEG贴片依靠患者自然运动驱动,自动激活电治疗信号,实现“无电池、无导线、可吸收”的软骨电刺激治疗路径。
研究团队指出,这一工作不仅突破了生物电子领域长期以来对“电输出+生物降解”的双重瓶颈,也为运动诱导式个性化医疗提供了全新解决思路。后续研究将系统探索“电荷剂量-修复效率”的量化关系,推动个性化自供能治疗方案的临床落地。
原文链接:
http://10.1021/acsnano.4c18811