根据国际糖尿病联合会的统计,全球约4.5亿成年人患有2型糖尿病。胰岛素抵抗是2型糖尿病发病的关键因素。青春期是青少年新陈代谢发生急剧变化的时期,也是从代谢健康转变为代谢不健康的关键阶段[1],常伴随胰岛素敏感性下降和胰岛素抵抗发生。在青少年时期控制胰岛素抵抗是预防成年期2型糖尿病的有效策略。维生素D是人体重要的脂溶性维生素,可在全身多种组织中广泛发挥作用,包括骨骼、骨骼肌、心脏、免疫系统等。
25-羟维生素D[25(OH)D]是反映维生素D营养状况的主要指标,来自成人的流行病学研究表明,低水平25(OH)D与心血管疾病、胰岛素抵抗和2型糖尿病等多种代谢性疾病风险相关[2],提示维生素D可能与胰岛素抵抗有关。青春期是维生素D代谢发生改变的重要时期,研究表明,进入青春期的青少年维生素D缺乏较青春期前更常见[3-4]。由此可见,青春期是青少年维生素D营养状况和胰岛素抵抗发生急剧变化的重要时期,青春期胰岛素抵抗的发生可能与维生素D营养状况改变有关。
然而,仅少数研究在青春期青少年中探究了维生素D缺乏与胰岛素抵抗的潜在关联[5-6],且存在参与者并非一般青少年人群或混杂因素调整欠缺的潜在偏倚,难以反映青春期阶段的真实状况。本研究通过纳入一般青春期青少年人群,并进行充分的混杂因素调整,旨在揭示青春期人群维生素D营养状况和胰岛素抵抗的相关性,从而为青春期青少年通过补充维生素D改善胰岛素抵抗提供依据。
1资料与方法
1.1 研究对象
本研究为横断面观察性研究。 研究对象为2023年6月5日于山东省济宁市第七中学招募的2021级(初二年级)青少年学生。该校为当地一所规模适中、招生范围覆盖本区多数社区的全日制公立中学,学生来源相对多样,具有一定的代表性。该中学对本研究给予支持,学生及家长配合度较高,具备良好的调查实施条件。因此,本研究采用便利抽样法选取该校在校学生作为调查对象。在抽样过程中,研究团队首先与学校沟通并获得同意,随后按照年级整群方式邀请初二年级学生参加调查。
纳入标准:(1)处于青春期,即第二性征开始发育,年龄为12~15岁;(2)自觉健康,无身体不适。
排除标准:(1)既往有心、脑、肺、肾及运动系统等严重器质性病变者;(2)使用生长激素等直接影响生长发育的药物者;(3)有精神病史者;(4)存在早发2型糖尿病家族史;(5)因未采集血液样本导致资料不全或顺应性差者。
本研究已通过北京协和医院伦理审查委员会审批(审批号: K3298),所有研究对象均签署知情同意书。
1.2 研究方法
通过问卷调查记录每日户外活动时间、糖尿病家族史、发育情况,现场体格检查测量身高、体重、腰围、臀围、腰臀比、收缩压、舒张压、心率,并评估骨龄和男女青春期第二性征发育情况。基于身高和体重,计算体质量指数(BMI),并根据《中国儿童肥胖诊断评估与管理专家共识》[7]推荐的标准确定是否超重或肥胖。骨龄测定方法:拍摄左腕关节正位X线片获得骨龄相,由经验丰富的阅片医师根据Greulich-Pyle法评定骨龄。青春期第二性征由经验丰富的医生检查并结合自我报告发育情况综合判断,女性青春期发育情况通过双乳Tanner分期、月经来潮情况评价,男性通过睾丸计测量睾丸、变声、遗精情况评价。
采集空腹静脉血检测空腹血糖(FBG)、空腹胰岛素( FINS)、胰岛素抵抗指数( HOMA-IR)及25(OH)D。其中FBG的测定采用罗氏Cobas c702全自动生化检测仪,FINS、25(OH)D的测定采用化学发光法。HOMA-IR=FBG(mmol/L)×FINS(μU/mL)/22.5。根据《中国儿童维生素D营养相关临床问题实践指南》[8],25(OH)D<30 nmol/L(12 μg/L)时判定为维生素D缺乏,30~50 nmol/L(12~20 μg/L)时为维生素D不足,>50 nmol/L(20 μg/L)时为维生素D充足。
1.3 样本量估算
采用PASS 15.0软件,根据多元线性回归分析的样本量估算方法进行样本计算[9]。设定显著性检验水平(α)为0.05,检验效能(1-β)为0.90,预测模型中计划纳入5个自变量(包括维生素D水平、年龄、性别、BMI、每日户外活动时间),设定中等效应量(f2)为0.15。根据Cohen提出的标准:f2=0.02为小效应,f2=0.15为中等效应,f2=0.35为大效应。结合既往类似研究中观察到的维生素D与代谢指标的相关性强度,预计本研究中变量间的效应量属中等水平。基于上述参数,经计算所需最低样本量为80。
1.4 统计学处理
采用SPSS 26.0软件进行统计学分析。年龄、身高、体重等正态分布计量资料以均数±标准差表示,组间比较采用单因素方差分析;骨龄、FINS、HOMA-IR等偏态分布计量资料以中位数(四分位数)表示,组间比较采用Kruskal-Wallis H 检验。计数资料以频数(百分数)表示,组间比较采用卡方检验。采用Spearman相关性分析法初步评估血清维生素D水平与FBG、FINS、HOMA-IR的相关性,然后将偏态分布资料进行对数转换(如lnFINS、lnHOMA-IR)至大致符合正态分布后,采用线性回归模型进一步评估血清维生素D水平与FBG、FINS、HOMA-IR之间的关联性(方差膨胀因子<10时认为不存在共线性)。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
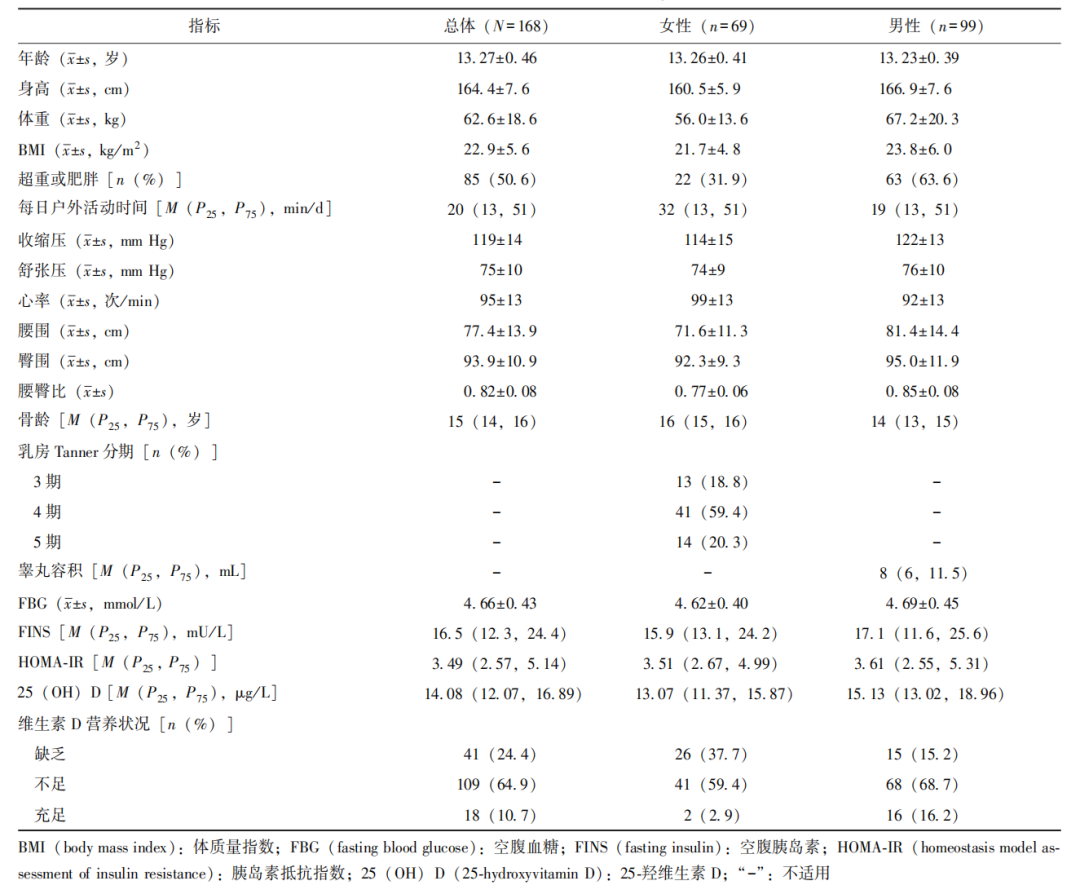
最终入选符合纳入和排除标准的青春期青少年168人。其中女性69人(41.1%),男性99人(58.9%);平均年龄为(13.27±0.46)岁;超重或肥胖85人(50.6%);所有参与者均已启动青春发育。维生素D缺乏41人(24.4%),维生素D不足109人(64.9%),维生素D充足18人(10.7%)。即89.3%的青少年存在维生素D缺乏或不足,其中女性青少年维生素D缺乏或不足比例达97.1%,男性青少年为83.9%。研究对象基本资料见表1。
表1 168名青少年基本资料
2.2 不同维生素D营养状况青少年的临床特征
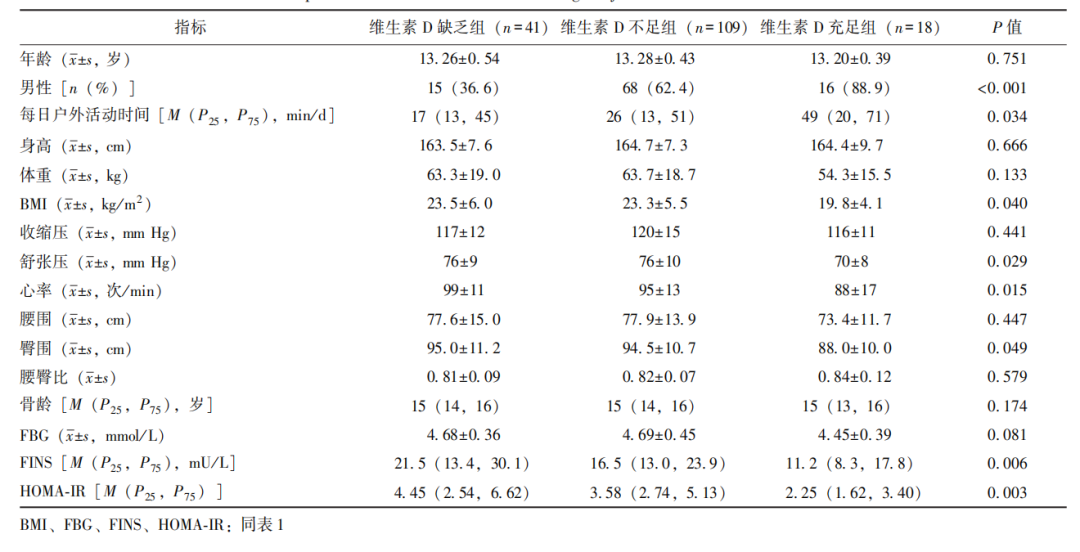
维生素D缺乏组、维生素D不足组、维生素D充足组之间骨龄无统计学差异(P>0.05),提示三组青少年发育情况大致相仿。FINS、HOMA-IR在维生素D缺乏组、维生素D不足组、维生素D充足组之间呈逐渐降低趋势,组间比较差异具有统计学意义(P均<0.05),见表2。
表2 不同维生素D营养状况青少年临床资料比较
Spearman相关性分析显示,血清25(OH)D水平与FBG(r=-0.171,P=0.027)、FINS(r=-0.234,P=0.002)及HOMA-IR(r=-0.250,P=0.001)均呈负相关性(图1)。
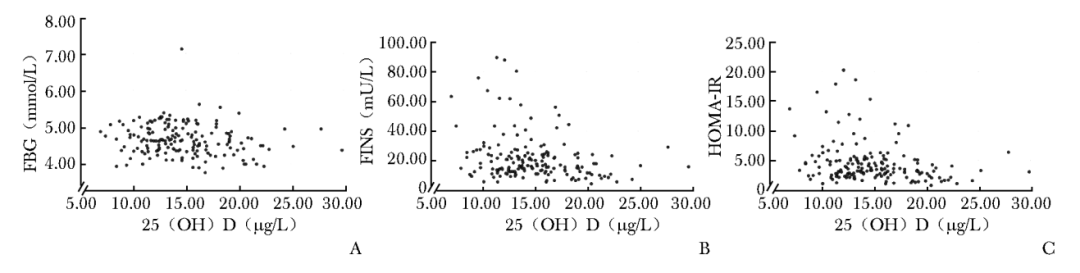
图1 维生素D与FBG(A)、FINS(B)、HOMA-IR(C)相关性的散点图
FBG、FINS、HOMA-IR、25(OH)D:同表1
2.3 血清维生素D水平与血糖、胰岛素及HOMA-IR的相关性
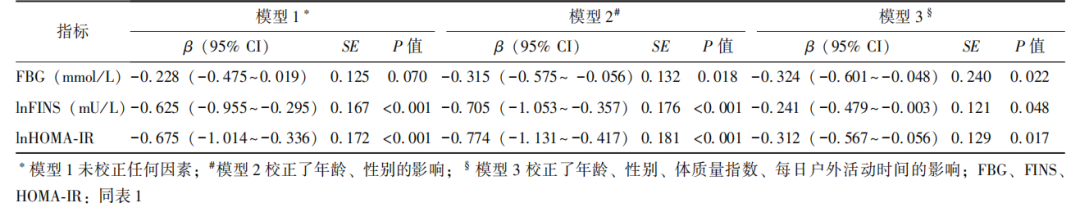
将FINS、HOMA-IR、25(OH)D进行对数转换后,采用多因素线性回归模型逐步引入潜在影响维生素D水平及胰岛素抵抗指标的混杂因素进行校正,以更准确地评估二者之间的独立相关性。模型1未校正任何其他因素,结果显示对数转换的血清25(OH)D水平仅与lnFINS、lnHOMA-IR呈负相关性,模型2仅校正年龄、性别的影响,而模型3进一步校正了BMI、每日户外活动时间的影响,结果均显示对数转换的血清25(OH)D水平与FBG、lnFINS及lnHOMA-IR呈负相关性(表3)。
表3 维生素D与血糖、胰岛素、HOMA-IR的多因素线性回归分析
3 讨论
本研究通过横断面调查,分析了青春期青少年维生素D营养状况/水平与胰岛素抵抗的相关性,结果显示参与调查的168名青春期青少年中,89.3%存在维生素D缺乏或不足。Spearman相关性分析显示,血清25(OH)D水平与HOMA-IR(r=-0.250, P=0.001)存在负相关性,线性回归模型校正年龄、性别、BMI、每日户外活动时间的影响后证实,对数转换的血清25(OH)D水平与lnHOMA-IR仍存在负相关性(β=-0.312, P=0.017)。
维生素D是一种重要的脂溶性维生素,其受体在人体组织中广泛分布,不仅可促进骨骼健康,还在心血管、代谢、免疫、肿瘤发生等方面产生影响,对维持青少年的健康成长具有重要作用。人体维生素D的主要来源包括皮肤经阳光作用合成的维生素D3,以及食物中的维生素D2和D3。青少年常存在维生素D不足或缺乏现象,从而影响其生长发育。本研究中89.3%的青少年存在维生素D缺乏或不足,其中女性青少年尤为严重。
以20 μg/L作为维生素D不足的临界值,既往研究显示不同国家/地区青少年人群的维生素D不足或缺乏率分布于28%~90%[10],提示青春期青少年普遍存在维生素D营养状况不足。本研究接近90%的青少年维生素D营养状况不达标,这可能与本研究地域处于较高纬度、日照相对不足地区,青少年户外活动时间较短相关。另一方面,青春期青少年处于快速生长发育的阶段,对维生素D的营养需求相对增加,也可能是导致其维生素D缺乏或不足的原因之一。
维生素D缺乏可对身体健康产生诸多影响。其中胰岛素抵抗和糖尿病是近年来发现的与维生素D营养状况密切相关的疾病[11]。针对成人的流行病学研究显示,低水平25(OH)D与胰岛素抵抗具有一定相关性[2]。既往探究维生素D与儿童青少年胰岛素抵抗相关性的横断面研究亦得到类似结论。
例如,我国北方地区一项纳入326名3~7岁儿童的研究[12]、我国南方地区一项纳入278名8~18岁儿童青少年的研究[13]及墨西哥一项针对533名5~20岁儿童青少年的研究[14]均发现血清维生素 D水平与胰岛素抵抗存在关联。然而,此种关联大多从成人或广泛的儿童青少年人群的流行病学研究中获得,而在处于生理功能发生急剧变化的青春期青少年中研究尚不充分。既往虽有2项针对青春期青少年的研究,但未发现血清维生素 D水平与胰岛素抵抗存在显著相关性[5-6],但其纳入对象肥胖程度过高,难以代表一般人群,且研究中未充分校正混杂因素的影响,因此结论的可靠性存疑。
本研究针对一般的青春期青少年开展调查,发现血清25(OH)D水平与FBG、FINS、HOMA-IR均存在显著负相关性,即使在校正BMI、每日户外活动时间等因素后相关性依然存在,进一步在青春期青少年中证明维生素D营养状况与血糖代谢的关系。既往2项研究[5-6]中,研究对象肥胖程度较为严重(BMI均值分别为43.3 kg/m2和26.0 kg/m2),高水平肥胖可能掩盖该人群中维生素D与胰岛素抵抗的关联性。
首先,从生物机制上看,肥胖个体常存在体内慢性低度炎症、脂肪因子分泌异常等代谢紊乱状态,为胰岛素抵抗的强烈驱动因素,且其效应可能远强于维生素D缺乏带来的影响,从而“掩盖”后者的独立作用。
其次,维生素D为脂溶性维生素,在肥胖人群中更易被脂肪组织储存并“稀释”,导致其在血清中的可检测水平下降,无法准确反映实际生物利用度,从而干扰其与代谢指标之间的真实关系。
再次,在统计分析方面,肥胖作为一个强混杂因素,其与维生素D及胰岛素抵抗均高度相关,若未进行充分分层或校正,可能导致观察到的维生素D与胰岛素抵抗之间的相关性被“中和”或“遮蔽”。
因此,在肥胖人群中,单纯分析维生素D与代谢参数的相关性,可能难以发现其真实效应。本研究纳入对象为一般中学生群体,肥胖比例较低,代谢状态较为稳定,更能揭示维生素D与胰岛素抵抗之间潜在的负相关关系。
此外,既往研究未对潜在混杂因素进行校正或校正不充分,而本研究除校正性别、年龄这些常见的人口统计学变量外,还将BMI和户外活动时间纳入考量范围。
如上文所述,BMI是评估肥胖程度的常用指标,肥胖不仅与胰岛素抵抗密切相关,也可能导致维生素D在脂肪组织中的“稀释效应”,从而影响其血清水平。户外活动时间与紫外线暴露密切相关,是影响体内维生素D合成的关键行为因素;同时,户外活动还可间接影响胰岛素敏感性及能量代谢。因此本研究将上述混杂因素纳入模型加以校正。总体而言,本研究纳入的调查对象为普通中学的学生群体,其整体相对健康,且对潜在混杂因素进行更充分的校正,可更好地反映青春期青少年维生素D营养状况与胰岛素抵抗的相关性。
维生素D与胰岛素抵抗关联存在多种潜在机制。首先,维生素D可通过直接作用于胰岛β细胞,例如通过调控钙内流等方式调节胰岛素分泌[15];亦可通过保护 β 细胞免受局部炎症进而影响胰岛素分泌[16]。其次,维生素D可调节骨骼肌、脂肪组织代谢,降低炎症水平,有助于改善靶组织对胰岛素的反应性,减轻胰岛素抵抗[17-18]。在青少年阶段,伴随激素变化、体脂增加及暂时性胰岛素敏感性下降,易发生胰岛素抵抗现象,而维生素D缺乏可能进一步加重胰岛素抵抗程度。本研究中观察到的维生素D水平与胰岛素抵抗呈负相关性,可能正是上述多重机制作用下在青春期人群中的体现。
本研究具有重要的临床意义。胰岛素抵抗是2型糖尿病、代谢综合征等慢性疾病的核心病理基础之一,而青春期作为生理性胰岛素抵抗的高发阶段,其代谢状态具有高度可塑性。因此,在青春期阶段及时识别并干预可逆性危险因素具有重要意义。本研究揭示了青春期青少年维生素D与胰岛素抵抗的相关性,由于维生素D是一种可通过日照、饮食及补充剂等多种方式改善的营养素,可为改善青春期青少年胰岛素抵抗提供可行、低成本的干预靶点。
本研究优势:被调查者来自普通中学的健康学生,年龄较为集中,便于观察青春期青少年中维生素D营养状况与胰岛素抵抗的关系。本研究局限性:(1)为单中心研究,代表性受到限制;(2)为横断面调查,无法进行因果关系推断;(3)HOMA-IR主要反映肝脏胰岛素敏感性,当胰岛细胞功能减退或衰竭时,无法体现真正的胰岛素抵抗量化值。
综上,本研究发现青春期青少年普遍存在维生素D不足或缺乏,尤其在女性青少年中。青春期青少年维生素D营养状况与胰岛素抵抗存在负相关性。应加强对青春期青少年维生素D营养摄入不足的重视,以保障其正常的生长发育和代谢健康,降低成年后可能罹患糖尿病的风险。
参考文献
[1]Kelsey M M, Zeitler P S. Insulin resistance of puberty[J]. Curr Diab Rep, 2016, 16(7): 64.
[2]Contreras-Bolívar V, García-Fontana B, García-Fontana C, et al. Mechanisms involved in the relationship between vitamin D and insulin resistance: impact on clinical practice[J]. Nutrients, 2021, 13(10): 3491.
[3]Buyukinan M, Ozen S, Kokkun S, et al. The relation of vitamin D deficiency with puberty and insulin resistance in obese children and adolescents[J]. J Pediatr Endocrinol Metab, 2012, 25(1/2): 83-87.
[4]Tolppanen A M, Fraser A, Fraser W D, et al. Risk factors for variation in 25-hydroxyvitamin D3 and D2 concentrations and vitamin D deficiency in children[J]. J Clin Endocrinol Metab, 2012, 97(4): 1202-1210.
[5]Ashraf A, Alvarez J, Saenz K, et al. Threshold for effects of vitamin D deficiency on glucose metabolism in obese female African-American adolescents[J]. J Clin Endocrinol Metab, 2009, 94(9): 3200-3206.
[6]Erdönmez D, Hatun S, Çizmecioglu F M, et al. No relationship between vitamin D status and insulin resistance in a group of high school students[J]. J Clin Res Pediatr Endocrinol, 2011, 3(4): 198-201.
[7]中华医学会儿科学分会内分泌遗传代谢学组, 中华医学会儿科学分会儿童保健学组, 中华医学会儿科学分会临床营养学组, 等. 中国儿童肥胖诊断评估与管理专家共识[J]. 中华儿科杂志, 2022, 60(6): 507-515.
[8]中华医学会儿科学分会儿童保健学组, 中华儿科杂志编辑委员会. 中国儿童维生素D营养相关临床问题实践指南[J]. 中华儿科杂志, 2022, 60(5): 387-394.
[9]Gatsonis C, Sampson A R. Multiple correlation: exact power and sample size calculations[J]. Psychol Bull, 1989, 106(3): 516-524.
[10]Pérez-López F R, Pérez-Roncero G, López-Baena M T. Vitamin D and adolescent health[J]. Adolesc Health Med Ther, 2010, 1: 1-8.
[11]Sung C C, Liao M T, Lu K C, et al. Role of vitamin D in insulin resistance[J]. J Biomed Biotechnol, 2012, 2012: 634195.
[12]Liu J Y, Fu L Q, Jin S S, et al. Vitamin D status in children and its association with glucose metabolism in northern China: a combination of a cross-pal and retrospective study[J]. BMJ Open, 2022, 12(11): e061146.
[13]Wang L L, Wang H Y, Wen H K, et al. Relationship between HOMA-IR and serum vitamin D in Chinese children and adolescents[J]. J Pediatr Endocrinol Metab, 2016, 29(7): 777-781.
[14]Denova-Gutiérrez E, Muñoz-Aguirre P, López D, et al. Low serum vitamin D concentrations are associated with insulin resistance in Mexican children and adolescents[J]. Nutrients, 2019, 11(9): 2109.
[15]Taneera J, Yaseen D, Youssef M, et al. Vitamin D augments insulin secretion via calcium influx and upregulation of voltage calcium channels: Findings from INS-1 cells and human islets[J]. Mol Cell Endocrinol, 2025, 599: 112472.
[16]Altieri B, Grant W B, Della Casa S, et al. Vitamin D and pancreas: the role of sunshine vitamin in the pathogenesis of diabetes mellitus and pancreatic cancer[J]. Crit Rev Food Sci Nutr, 2017, 57(16): 3472-3488.
[17]Ryan Z C, Craig T A, Folmes C D, et al. 1α,25-Dihydroxyvitamin D3 regulates mitochondrial oxygen consumption and dynamics in human skeletal muscle cells[J]. J Biol Chem, 2016, 291(3): 1514-1528.
[18]Jefferson G E, Schnell D M, Thomas D T, et al. Calcitriol concomitantly enhances insulin sensitivity and alters myocellular lipid partitioning in high fat-treated skeletal muscle cells[J]. J Physiol Biochem, 2017, 73(4): 613-621.