急性心肌梗死作为全球致死、致残率最高的疾病之一,每年导致约860万人死亡,对医疗体系带来严峻挑战。尽管冠脉介入治疗等临床手段能够在短期内挽救大部分患者的生命,但仍有约30%的存活心梗患者在5年内进展为心力衰竭。这一事实凸显了现有治疗方法在阻断心肌级联损伤和心脏重构进程方面的局限性。最新研究发现,线粒体相关内质网膜(MAMs)偶联稳态失衡及其介导的线粒体功能障碍是心脏病理性重构的关键环节。然而,MAMs在心梗后心脏重构中的潜在调控机制仍有待进一步深入探索。
2025年6月30日,浙江大学医学院附属邵逸夫医院傅国胜、赖东武教授团队与上海中医药大学普陀医院张鹏研究员团队合作,在国际心血管病学顶级期刊Circulation 发表了题为“Mitochondrial tumor suppressor 1A attenuates myocardial infarction injury by maintaining the coupling between mitochondria and endoplasmic reticulum”的研究论文,率先揭示了线粒体肿瘤抑制因子(Mtus1)的线粒体亚型Mtus1A作为MAMs的关键调节分子,对心梗后心衰的调控作用及其分子机制。该研究从细胞器互作机制的视角,深化了对心梗后心脏重构机制的理解,并为心梗后心衰的治疗策略提供了新思路和潜在靶点。

首先,该研究团队对心肌梗死患者心脏的单细胞核转录组进行了深入分析,发现线粒体肿瘤抑制因子(Mtus1)可能是心肌缺血损伤的关键调节分子。实验结果显示,Mtus1的线粒体定位亚型Mtus1A在心肌细胞中的表达量显著高于其胞浆定位亚型Mtus1C。为验证这一发现,研究团队利用急性心肌梗死小鼠模型、氧糖剥夺(OGD)处理的新生大鼠原代心肌细胞(NRVMs)模型以及缺血性心肌病患者(ICM)样本进行实验。结果表明,在缺血心肌中,Mtus1A的蛋白水平表现为持续显著下调,而Mtus1C并未出现类似变化。这表明Mtus1A在心肌缺血损伤中可能发挥着更为重要的作用。
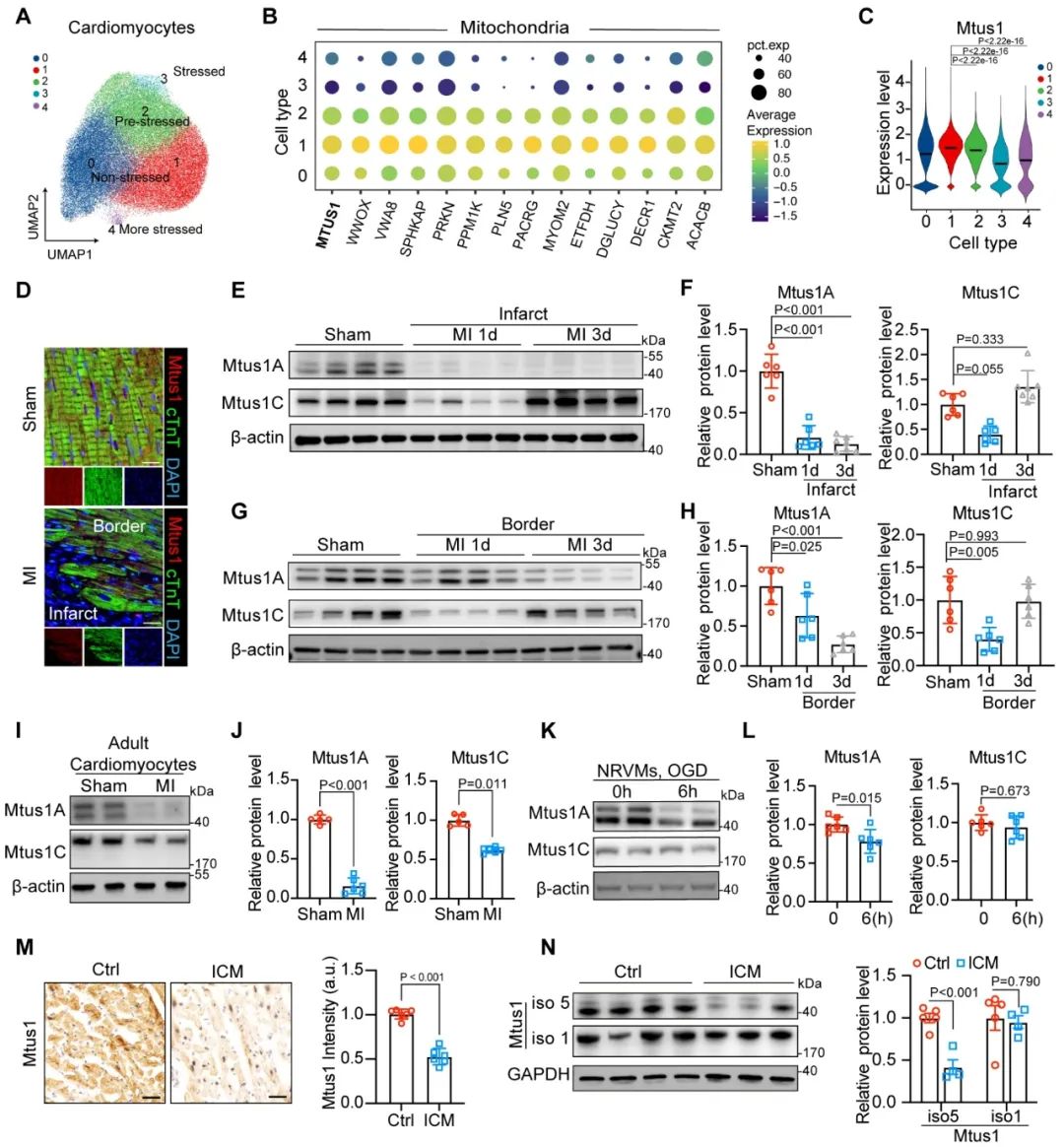
图1. Mtus1A蛋白表达在缺血心肌中明显下调
为明确Mtus1在心肌缺血损伤中的作用,课题组构建了心肌特异性Mtus1条件性敲除小鼠(Mtus1-cKO)。研究发现,cKO小鼠在基础状态下即出现轻度心功能受损;在急性心梗造模后,cKO小鼠较对照小鼠表现为更严重的心功能下降、更大的心梗面积以及更高的心肌细胞凋亡率。在OGD诱导的NRVMs细胞模型中,通过siRNA分别敲降Mtus1A及Mtus1C,结果显示,敲降Mtus1A显著增加心肌细胞的损伤水平,而敲降Mtus1C无明显影响。这些结果证实了Mtus1,尤其是Mtus1A亚型,在维持心脏功能和防止心梗后心衰中发挥着至关重要的作用。
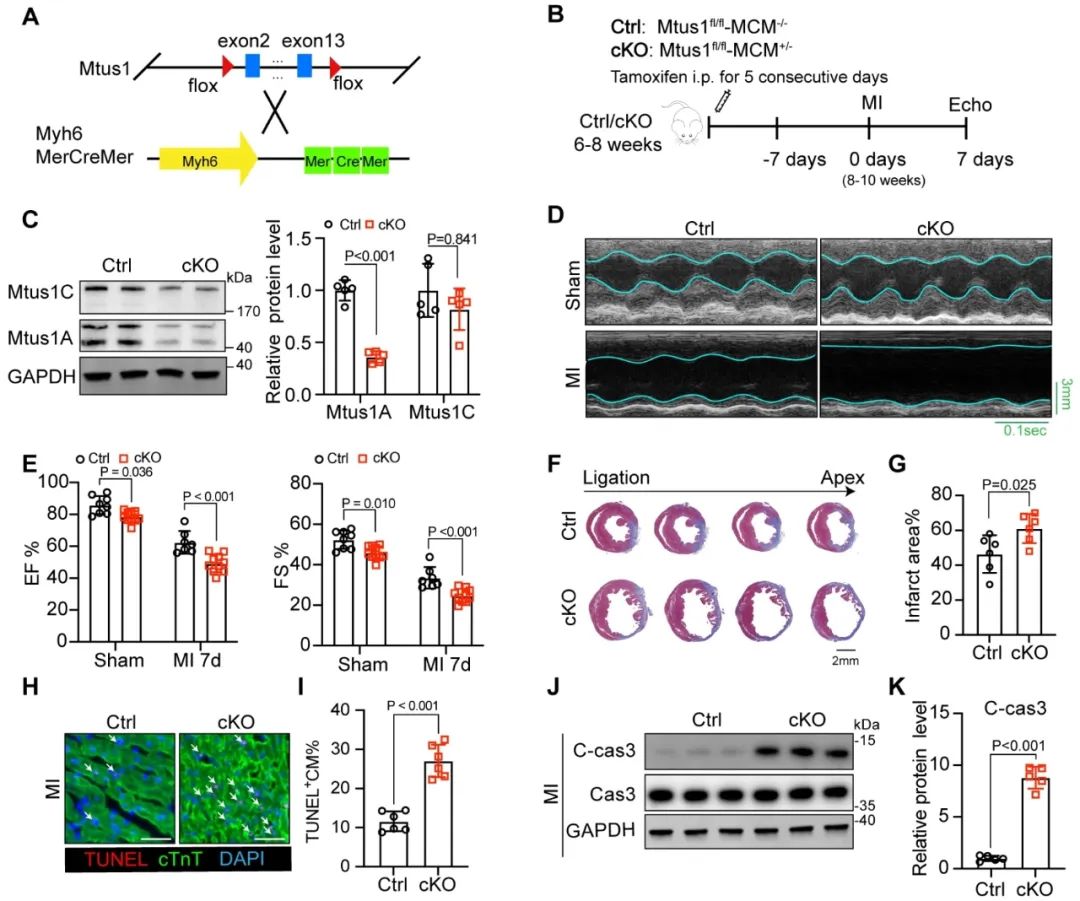
图2. Mtus1的缺失加重心肌缺血损伤
鉴于Mtus1A主要定位于线粒体外膜,课题组观察了Mtus1A缺失对心肌线粒体形态和功能的影响。透射电镜结果显示,cKO小鼠心肌和siMtus1A处理的NRVMs中,线粒体的网络结构出现紊乱,嵴密度显著降低。功能检测表明,敲降Mtus1A会降低心肌细胞的线粒体膜电位,同时显著降低心肌细胞的最大呼吸能力和储备呼吸能力。
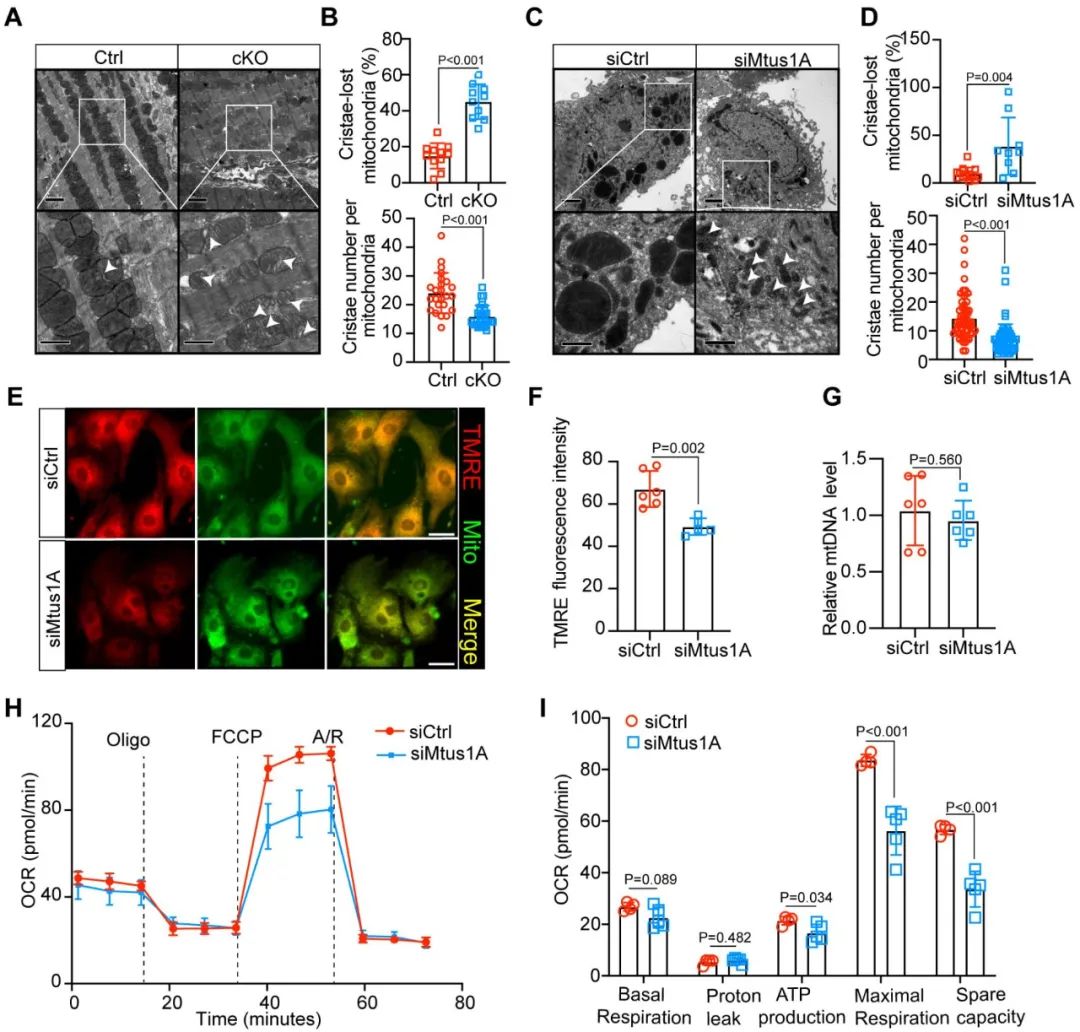
图3. Mtus1A缺失导致线粒体形态和功能异常
为深入探究Mtus1A对线粒体的调控机制,课题组通过转录组测序发现,敲降Mtus1A显著影响MAMs相关生物学通路;超分辨细胞成像结果显示,Mtus1A主要定位于线粒体外膜,并与内质网存在共定位;亚细胞组分蛋白检测进一步证实了部分Mtus1A位于MAMs上。实验表明,Mtus1A缺失显著降低内质网-线粒体的偶联水平,而过表达工具腺病毒Tether (增加MAMs偶联)可改善Mtus1A缺失导致的线粒体膜电位的丢失和钙离子传递异常。这些结果表明,MAMs偶联机制介导Mtus1A对线粒体的调控作用。
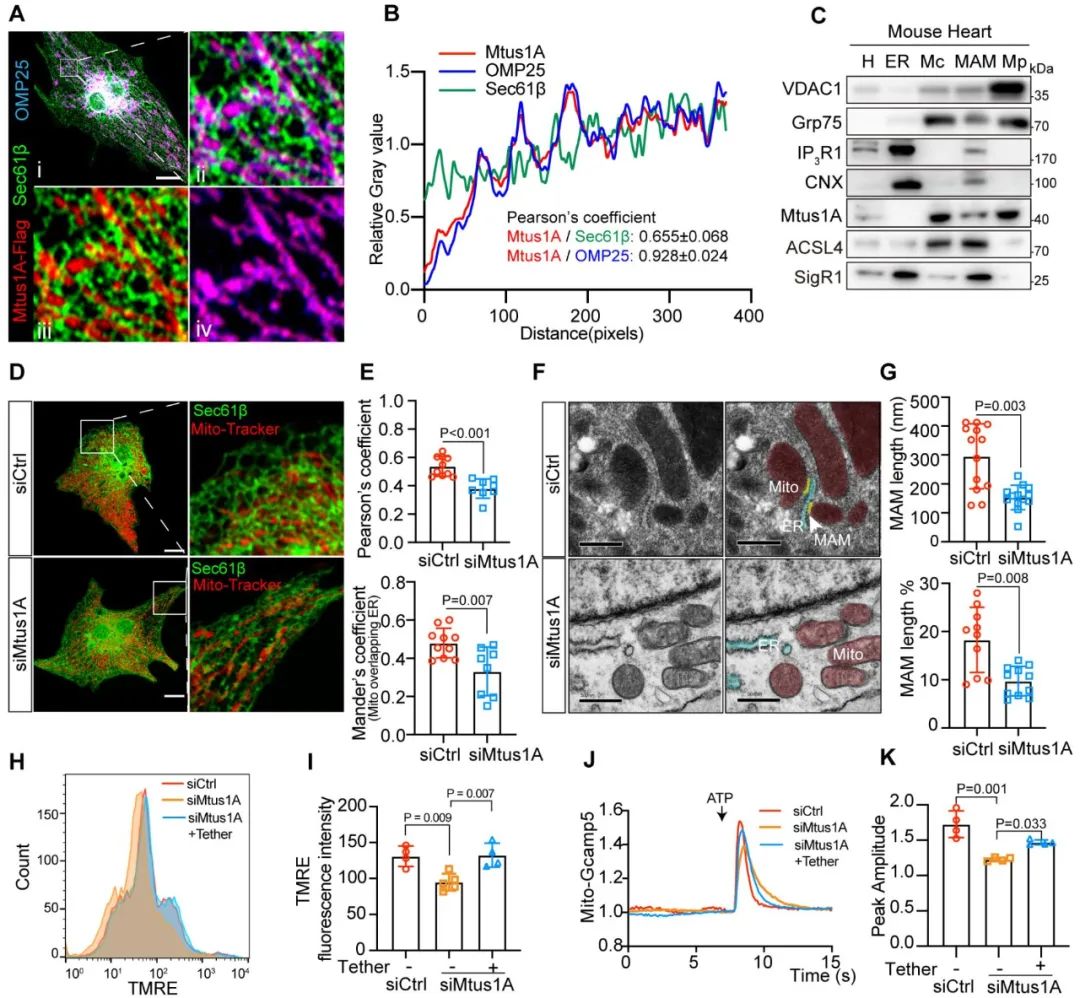
图4. Mtus1A的亚细胞定位及其对内质网-线粒体互作的影响
为阐明Mtus1A调控MAMs的分子机制,团队利用质谱分析筛选其互作蛋白,与已知MAMs相关蛋白比对后,发现Mtus1A与MAMs钙离子通道关键组分IP3R1、Grp75存在互作。随后,邻位连接实验(PLA)和免疫共沉淀(Co-IP)实验证实Mtus1A与IP3R1-Grp75-VDAC1复合体存在互作。进一步分子实验显示,Mtus1A主要通过结合IP3R1维持该复合体的稳定性,而Mtus1A的189-219位氨基酸区域是其结合的关键结构域。
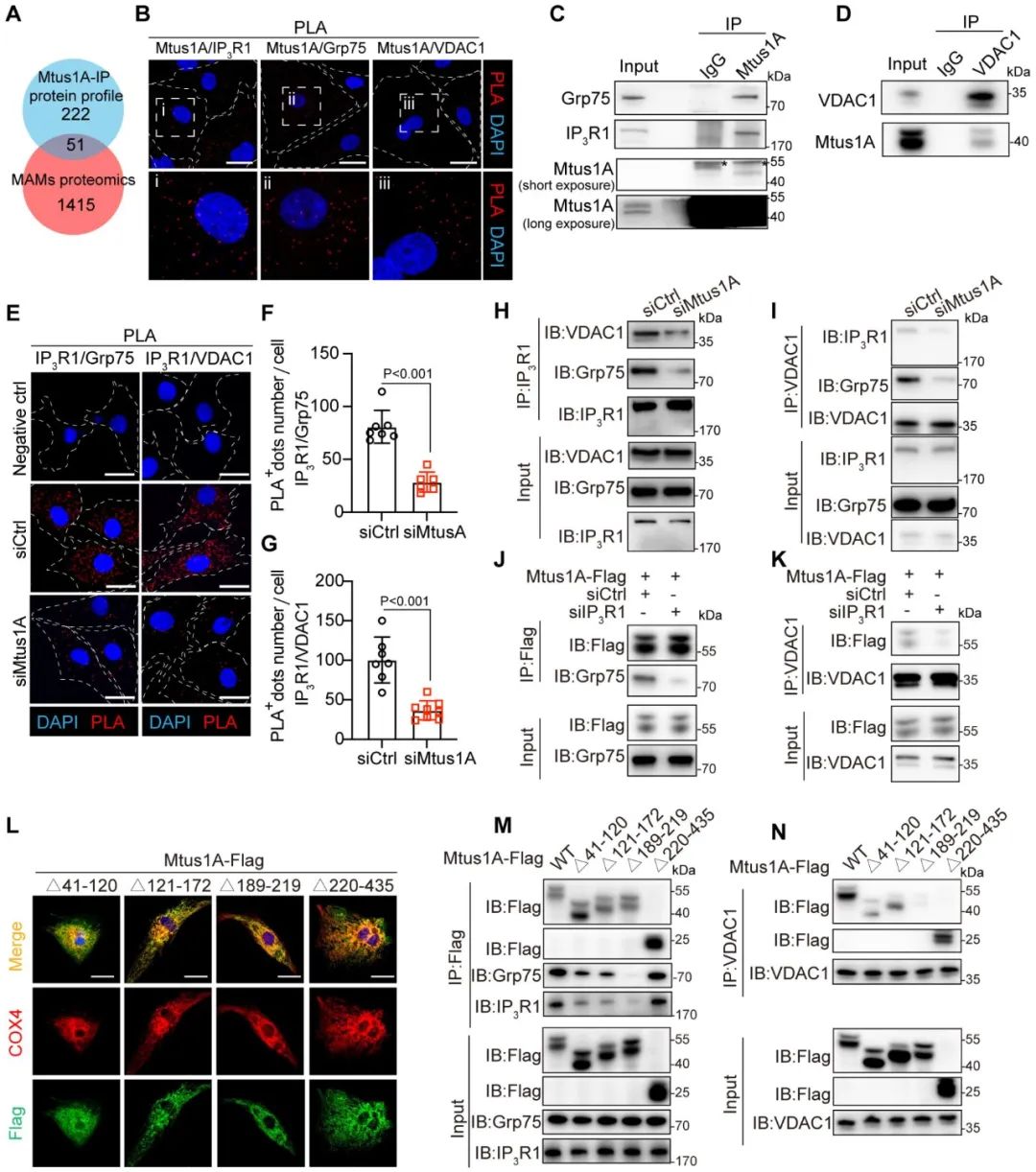
图5. Mtus1A维持IP3R1-Grp75-VDAC1复合体的稳定性
为了从在体水平验证Mtus1A对心梗后心衰的改善作用,研究团队在C57BL/6小鼠急性心梗模型中进行尾静脉注射心肌细胞特异性过表达Mtus1A的腺相关病毒9 (AAV9-cTnT-Mtus1A)。结果显示,AAV9-Mtus1A治疗的野生型心梗小鼠较对照组的心脏功能和生存情况显著改善,心梗面积和心肌凋亡明显降低。电镜结果发现,过表达野生型Mtus1A显著改善心梗小鼠MAMs偶联异常和线粒体嵴丢失,并阻止了心梗导致的MAMs组份中IP3R1和VDAC1下调。而过表达Mtus1A截短突变体(△189-219)的AAV9在心梗小鼠中并未产生上述保护效应,表明该氨基酸区域对Mtus1A发挥功能至关重要。
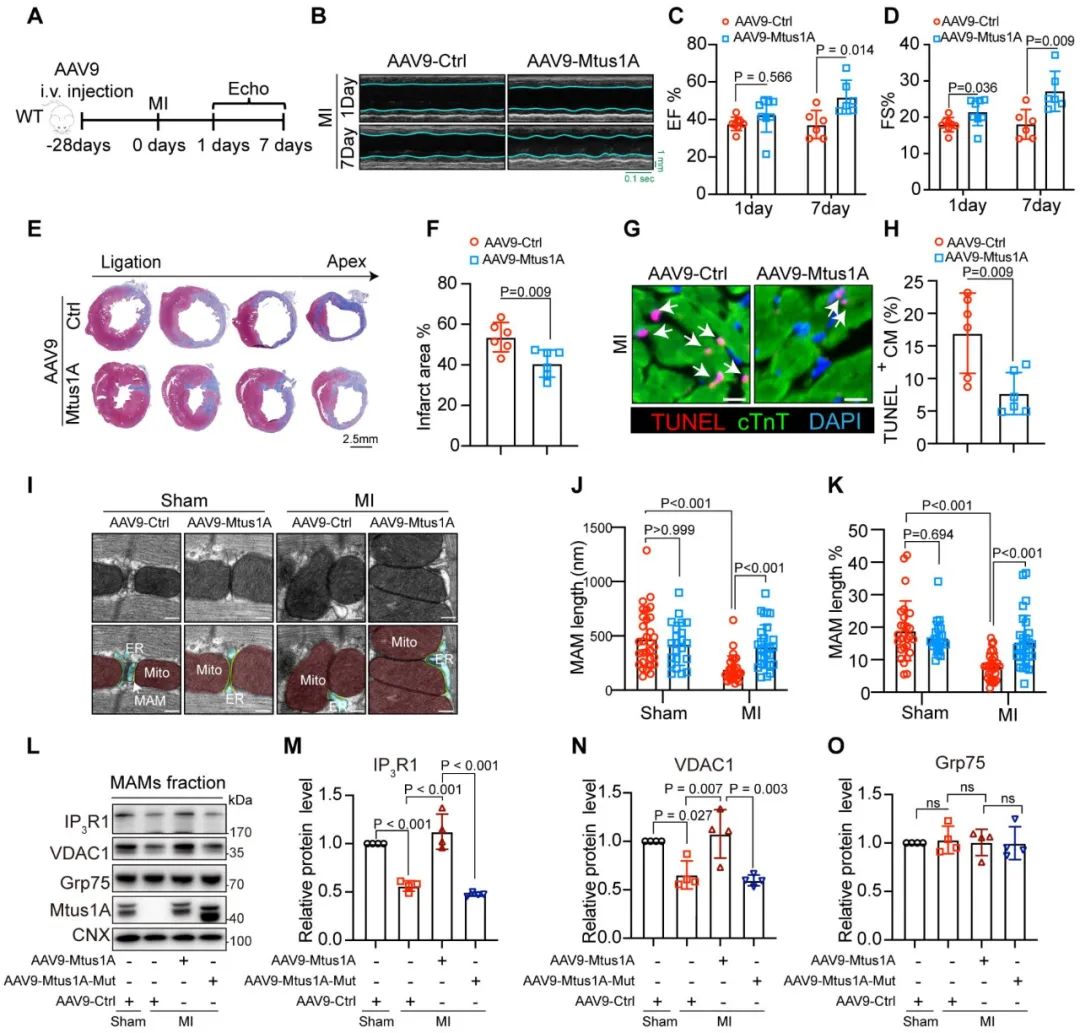
图6. Mtus1A通过加强内质网-线粒体偶联改善心梗后心衰
前期细胞实验提示,Mtus1A存在翻译后修饰机制。研究团队结合质谱分析、免疫共沉淀等实验结果,发现SCF型E3泛素连接酶复合体成员Fbxo7与Mtus1A存在互作和空间共定位,该互作依赖于Fbxo7的C端脯氨酸富集区(PRR)和Mtus1A的1-219氨基酸区域。进一步研究发现,Fbxo7通过促进Mtus1A的K6位点连接的多聚泛素化修饰(而非传统的K48降解型泛素化)进而增加Mtus1A的蛋白稳定性。
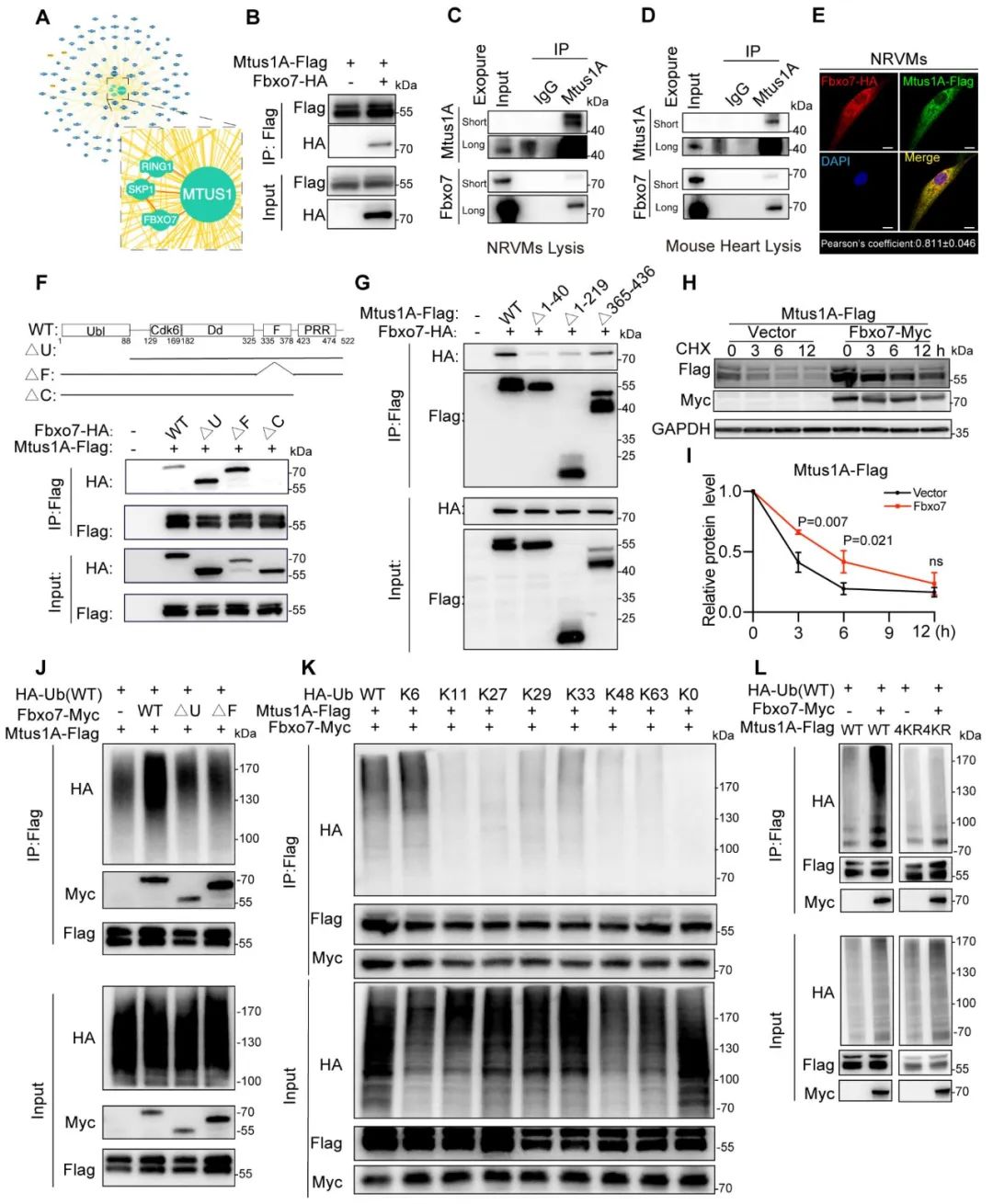
图7. Fbxo7通过K6链泛素化增加Mtus1A的蛋白稳定性
在体实验显示,心肌梗死小鼠心脏组织中Fbxo7蛋白水平显著降低。为明确Fbxo7是否通过Mtus1A影响心肌缺血损伤,课题组在C57BL/6心梗小鼠中,通过尾静脉注射AAV9-shFbxo7沉默心脏Fbxo7,并同时给予AAV9-cTnT-Mtus1A以过表达Mtus1A。结果显示,Fbxo7的缺失加剧了心肌梗死后的心功能恶化和梗死面积扩大,而这些病理改变可被心肌过表达Mtus1A所逆转。这验证了泛素化修饰机制参与了Mtus1A对心肌缺血损伤的调控作用。
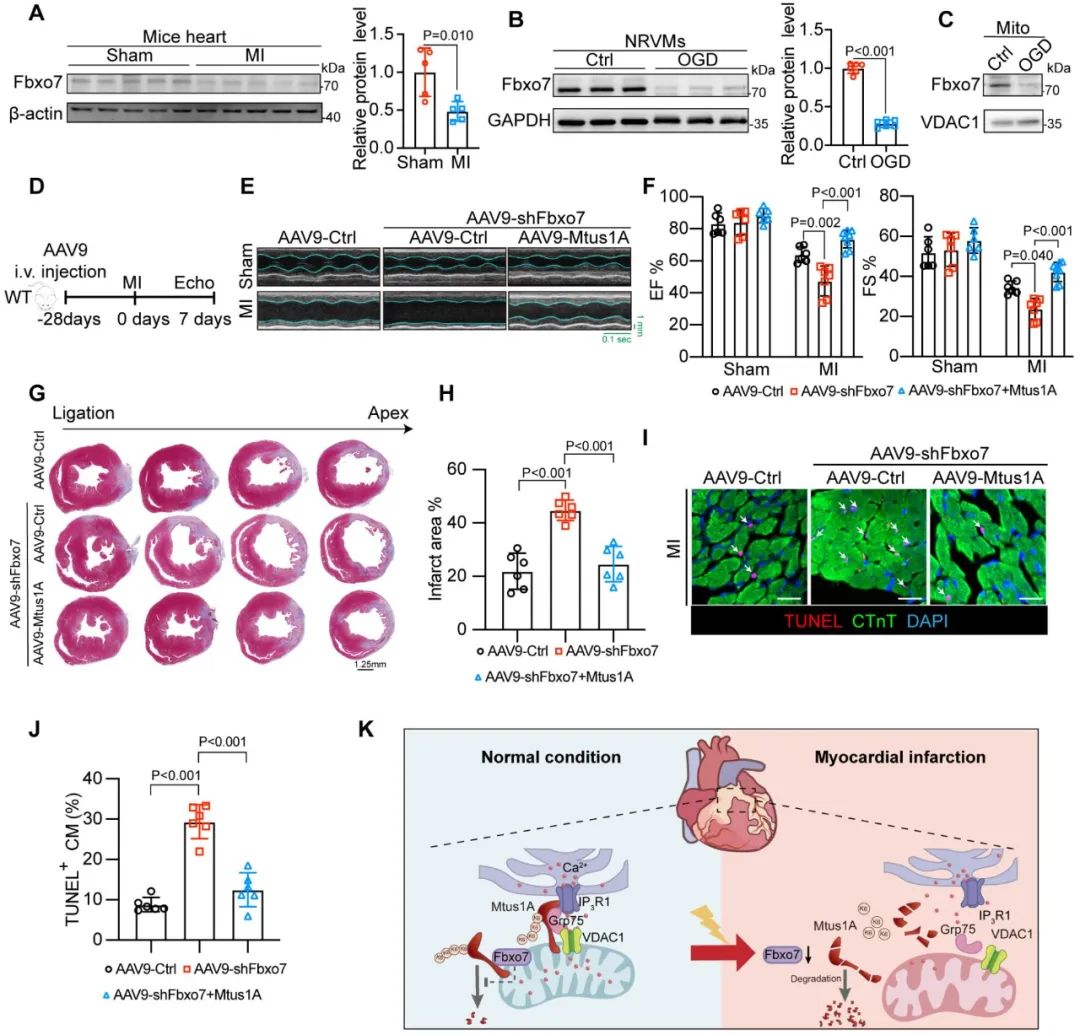
图8. Fbxo7通过增加Mtus1A的蛋白稳定性减轻心梗缺血损伤
综上所述,本研究率先揭示了线粒体肿瘤抑制因子(Mtus1)的线粒体亚型Mtus1A作为MAMs的关键调节分子对心梗后心衰起重要调控作用,并深入阐明了Mtus1A通过维持MAMs钙通道复合体(IP3R1/Grp75/VDAC1)的完整性,调节内质网-线粒体间钙信号传递和线粒体能量代谢的分子机制;同时,E3泛素连接酶Fbxo7介导的K6泛素化修饰对维持Mtus1A的蛋白稳定性起调节作用。该研究从细胞器互作机制的独特视角,深化了对心梗后心脏重构分子机制的理解,并为心梗后心衰的治疗策略提供了新思路和潜在靶点。
浙江大学医学院附属邵逸夫医院心内科赖东武主任医师、傅国胜教授和上海普陀医院张鹏研究员为该文的通讯作者。浙江大学医学院附属邵逸夫医院心内科的龚颖超医师、吕雪副主任医师、博士生王星辰,上海普陀医院汪引芳博士为该文共同第一作者。该工作还得到了浙江大学程洪强教授、庄乐南研究员和余路阳教授的指导和帮助。该项研究获得国家自然科学基金和浙江省自然科学基金等经费资助。
论文链接:
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.124.069737