肺癌是全球范围内最常见的恶性肿瘤之一,其中非小细胞肺癌(NSCLC)约占85%的病例。在NSCLC患者中,超过15%的患者在确诊时处于III期,这些患者大多数被认为是不可切除的。EGFR是NSCLC中最常见的驱动基因之一,尤其在亚洲人群中,EGFR突变的发生率高达50%。尽管第三代EGFR酪氨酸激酶抑制剂(EGFR-TKI)已被推荐为晚期EGFR突变NSCLC的一线治疗,但对于不可切除的III期EGFR突变NSCLC患者,目前的治疗策略仍存在局限性。传统的不可切除III期NSCLC患者通常接受放化疗(cCRT),尽管PACIFIC试验显示度伐利尤单抗在放化疗后使用可以改善患者的无进展生存期(PFS)和总生存期(OS),但仍有超过80%的患者在5年内复发,主要原因是远处转移。因此,迫切需要更新不可切除III期NSCLC患者的治疗方案。第三代EGFR-TKI阿美替尼(Aumolertinib)已被批准用于中国NSCLC的一线治疗。然而,新辅助EGFR-TKI治疗在不可切除III期NSCLC中的应用仍需进一步的前瞻性临床试验数据支持。之前的研究表明,新辅助第二代EGFR-TKI阿法替尼(Afatinib)可以将不可切除的III期NSCLC患者转化为可切除状态,显示出相对良好的预后。这些发现支持新辅助靶向治疗联合根治性手术在最初不可切除的III期NSCLC中的应用。

方法
本研究是一项单臂、开放标签、II期临床试验(LungMate 007,NCT04685070),旨在评估新辅助阿美替尼治疗不可切除的III期EGFR突变NSCLC的疗效和安全性。研究在中国上海肺科医院进行,共招募了56例不可切除的III期EGFR突变NSCLC患者。所有患者均接受阿美替尼(110 mg/天,口服)治疗,为期16周(4个周期)。主要终点是客观缓解率(ORR),次要终点包括主要病理缓解率(MPR)、病理完全缓解率(pCR)、无事件生存期(EFS)、总生存期(OS)和治疗相关不良事件(TRAEs)。
研究结果
在56例患者中,有51例接受了新辅助阿美替尼治疗,形成了意向治疗人群。结果显示,ORR为70.6%(95%置信区间:58%-84%),达到了预设的主要终点。此外,23例患者(45.1%)转化为可切除疾病并接受了手术治疗。在这些患者中,RO切除率为100%,MPR率为21.7%,pCR率为13.0%。中位EFS和OS尚未达到,但1年和2年的EFS率分别为88.2%和58.8%。RNA测序分析显示,治疗后肿瘤中CD8+T细胞的浸润增加,尤其是在响应者和Ex19-Del突变肿瘤中。此外,Ex19-Del突变患者的MPR率显著高于Ex21-L858R突变患者(44.4% vs 7.1%,p=0.034),且残留肿瘤细胞的比例显著较低(19.8% vs 63.5%,p=0.015)。
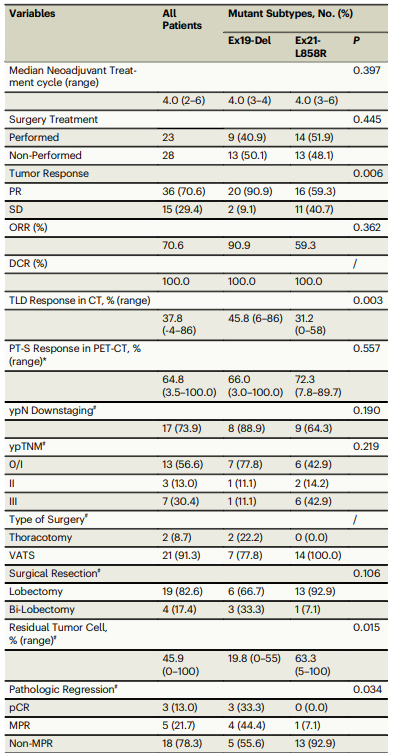
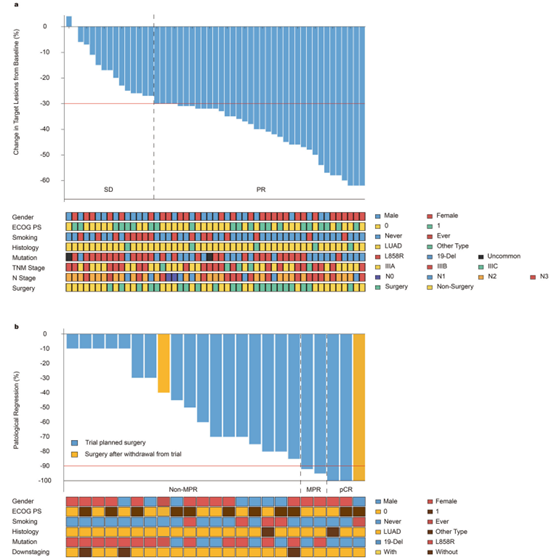
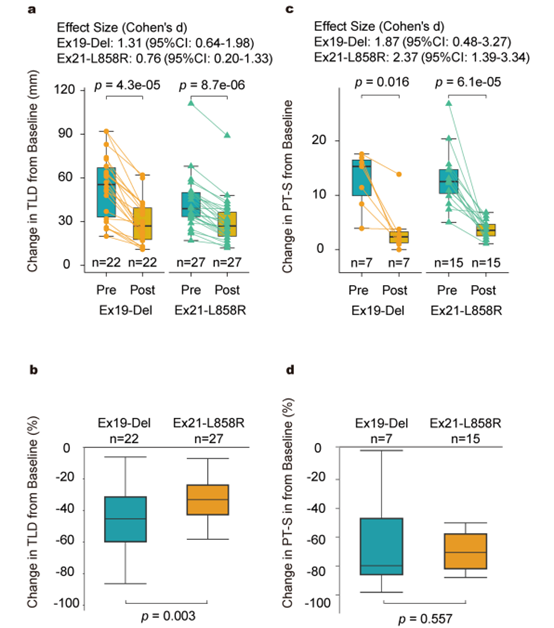
安全性分析
治疗相关的不良事件(TRAEs)在49例患者(96.1%)中出现,但没有观察到5级TRAEs。最常见的TRAE为疲劳(49.0%)、丙氨酸转氨酶升高(39.2%)和皮疹(35.3%)。3/4级TRAEs发生在5例患者(9.8%)中,包括丙氨酸转氨酶升高、天冬氨酸转氨酶升高、肺炎、血栓栓塞事件和缺血性脑血管疾病。两名患者因丙氨酸转氨酶升高和皮疹分别停药。手术相关的并发症较少,仅有一名患者在术后出现支气管胸膜瘘(4.3%),没有发生术后90天内死亡。
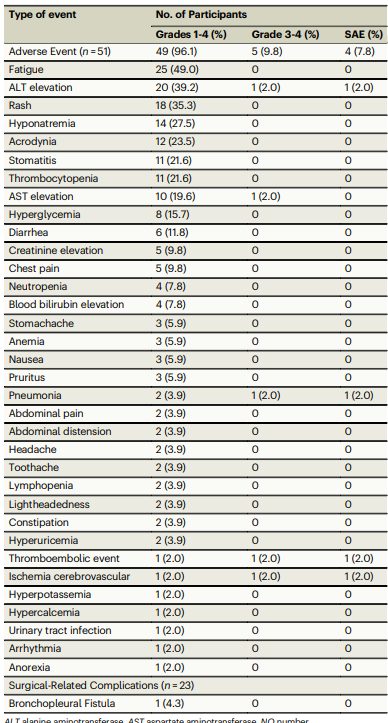
结论
新辅助阿美替尼治疗在不可切除的III期EGFR突变NSCLC中显示出良好的疗效和可接受的安全性。研究达到了预设的主要终点,ORR为70.6%,且有超过40%的患者转化为可切除状态。Ex19-Del突变患者的缓解率和病理缓解率显著高于Ex21-L858R突变患者。RNA测序分析揭示了治疗后肿瘤微环境的免疫激活,尤其是在响应者和Ex19-Del突变患者中。这些发现为未来在不可切除III期NSCLC患者中使用新辅助EGFR-TKI治疗提供了重要的参考。
原始出处
Bian, D., Ji, S., Liu, Y., Huang, Z., Jiang, L., Liu, M., Bao, X., Yang, J., Zhou, Y., Hu, J., Sun, L., Zheng, Y., Huang, J., Liu, J., Zhu, X., Zhang, J., Zhang, L., Liu, X., He, W., Zhao, D., Wu, C., & Zhang, P. (2025). Neoadjuvant Aumolertinib for unresectable stage III EGFR-mutant non-small cell lung cancer: a single-arm phase II trial. Nature Communications, 16(1), 1-15. doi:10.1038/s41467-025-58435-9.