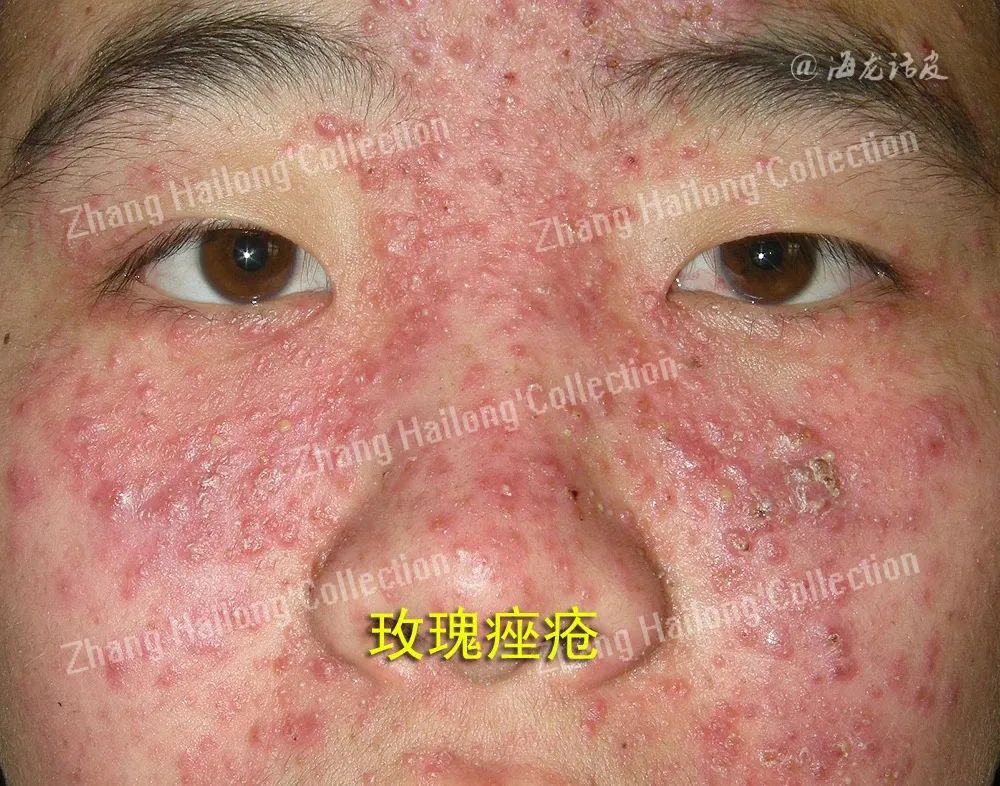
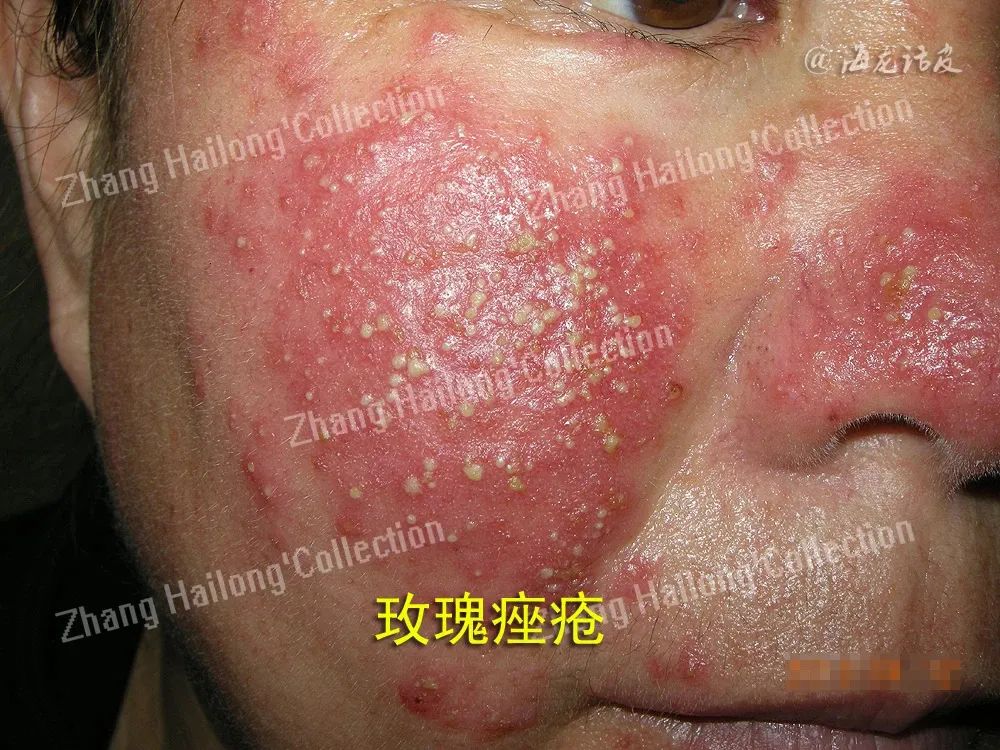
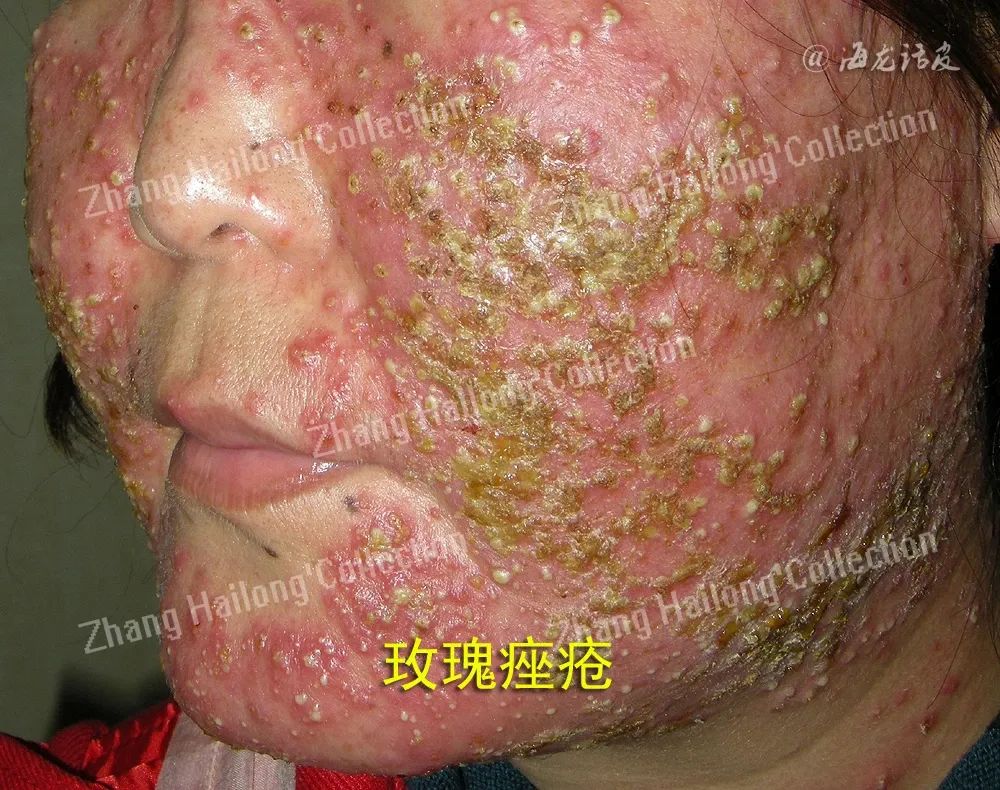
玫瑰痤疮(Rosacea)是一种慢性炎症性皮肤疾病,影响全球约5.46%的成年人,其特征是红斑、面部潮红反复发作、毛细血管扩张、丘疹、脓疱和脸部中央区域皮肤变化。女性发病率高于男性,国外好发年龄为45~60岁,国内好发于20~50岁的女性。玫瑰痤疮分为4种亚型:红斑毛细血管扩张型(erythematotelangiectatic rosacea,ETR)、丘疹脓疱型(papulopustular rosacea,PPR)、赘疣型(phymatous)和眼型(Ocular)。
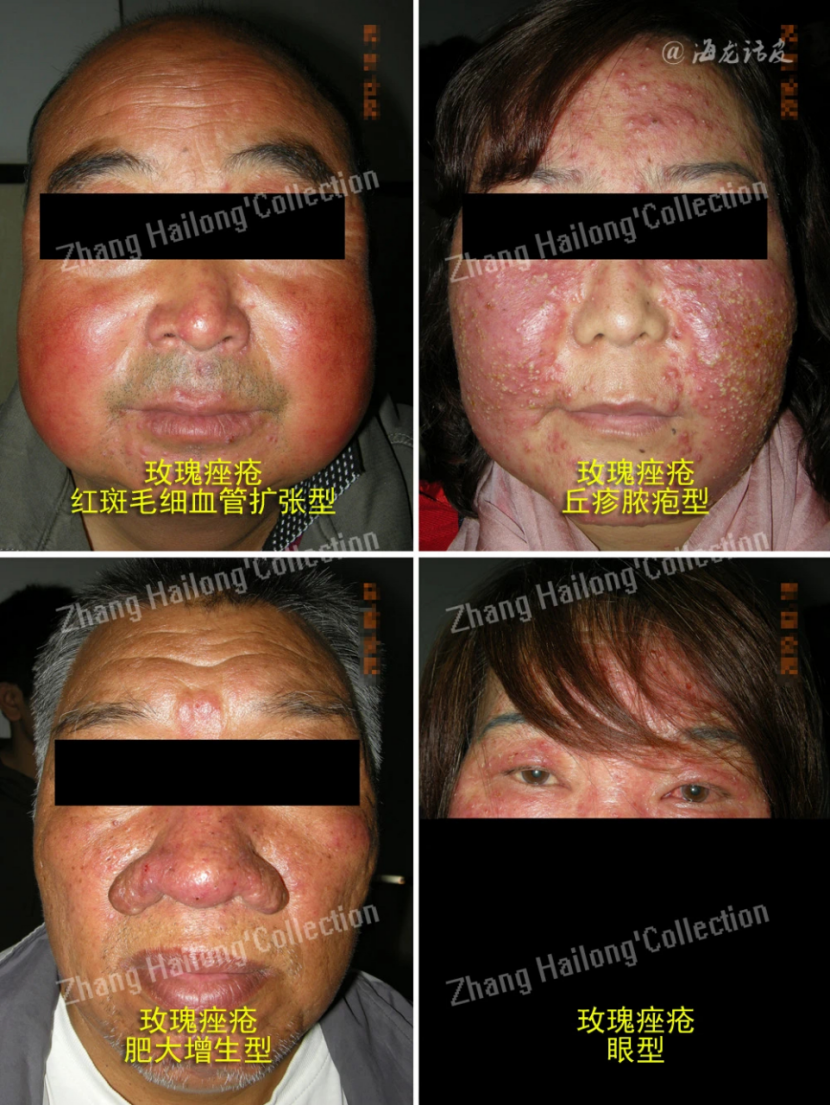
近年来,由于生活和护肤方式的改变,玫瑰痤疮的患病率增加,严重影响患者生活质量,然而玫瑰痤疮的发病机制尚不完全清楚,亟需进一步阐明其发病机制,从而探索更合理的临床治疗方案。目前认为玫瑰痤疮的发病机制复杂,多种因素参与,包括遗传因素、皮肤局部免疫失衡、神经免疫功能和神经血管环路紊乱、皮肤屏障功能异常、微生物菌群失调等均参与了玫瑰痤疮的发生发展。
神经免疫机制
1、固有免疫系统:
皮肤是人体最大的器官,构成了第一层物理屏障抵御病原体的入侵,包括表皮、角质层和皮肤附属器官,它们共同构成了皮肤固有免疫系统,对身体防御外部侵害具有重要的意义。正常皮肤的pH值偏酸性,玫瑰痤疮患者的pH值升高、经皮失水增加、表皮水合作用减少,影响皮肤屏障功能、脂质的合成和聚集,从而出现表皮分化和脱屑。皮肤表面脂质膜是由角质形成细胞和皮脂腺来源的脂质组成,是皮肤屏障的重要组成部分。研究发现,在患有玫瑰痤疮的个体中,皮脂中的脂肪酸脂质组成发生了变化,具体表现为肉豆蔻酸(C14:0)水平明显增高,同时饱和长链和超长链脂肪酸(超过20个碳)水平显著降低,从而对皮肤屏障的功能造成影响,其具体机制需进一步研究。
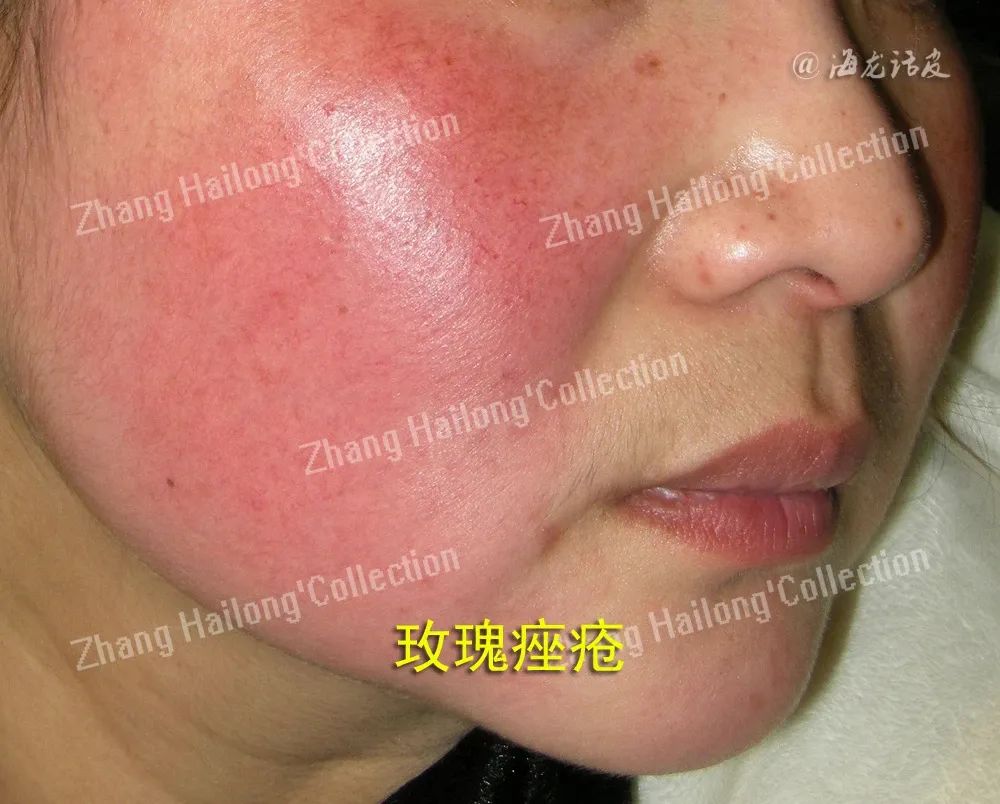
研究表明,玫瑰痤疮患者血管病变和炎症性疾病的发病机制与固有免疫反应的改变有关。在固有免疫系统中,模式识别系统包括Toll样受体(Toll‑like receptor,TLR)和核苷酸结合结构域和富含亮氨酸的重复序列[nucleotide‑binding oligomerization domain (NOD)‑like receptors,NLRs]家族,它们对环境刺激如紫外线、微生物、物理和化学创伤作出反应。固有免疫系统被触发后,皮肤中细胞因子和抗菌分子即增加,抗菌肽就是其中一种抗菌分子。某些形式的抗菌肽具有独特的血管活性和促炎能力,研究发现在玫瑰痤疮患者的皮肤中,抗菌肽的形式不仅丰富,且与正常皮肤不同, 固有免疫反应的加剧导致了抗菌肽的异常。
抗菌肽LL‑37源自激肽释放酶5介导的抗菌肽人阳离子抗菌蛋白裂解,其在玫瑰痤疮患者皮肤中的含量高于正常人皮肤。有研究认为LL‑37通过激活NOD样受体热蛋白结构域相关蛋白3[nucleotide‑binding oligomerization domain(NOD)‑like receptor protein 3,NLRP3]炎症小体引发皮肤炎症。国外研究显示肥大细胞介导抗菌肽诱发玫瑰痤疮炎症。国内最近也有一项研究显示,抗菌肽LL‑37通过肥大细胞诱导炎症反应机制,肥大细胞参与了血管重构和纤维化的过程,参与神经源性炎症,从而参与了玫瑰痤疮的发病机制。
2、适应性免疫:
有研究显示,固有免疫细胞和适应性免疫细胞均参与玫瑰痤疮的发病机制,固有免疫系统的细胞,包括巨噬细胞、肥大细胞和中性粒细胞,都是玫瑰痤疮的炎症浸润细胞。研究表明,玫瑰痤疮中存在白细胞介素‑1(interleukin‑1,Th1)和白细胞介素‑17(interleukin‑17,Th17)免疫极化现象,其中Th1免疫反应表现为IFN‑γ和TNF‑α等高表达,Th17免疫反应表现为白细胞介素-17A(interleukin‑17A,IL‑17A)、 白细胞介素‑22(interleukin‑22,IL‑22)等显著上调,这些发现通过基因表达及免疫组化验证,尤其在PPR患者中表现更为显著。
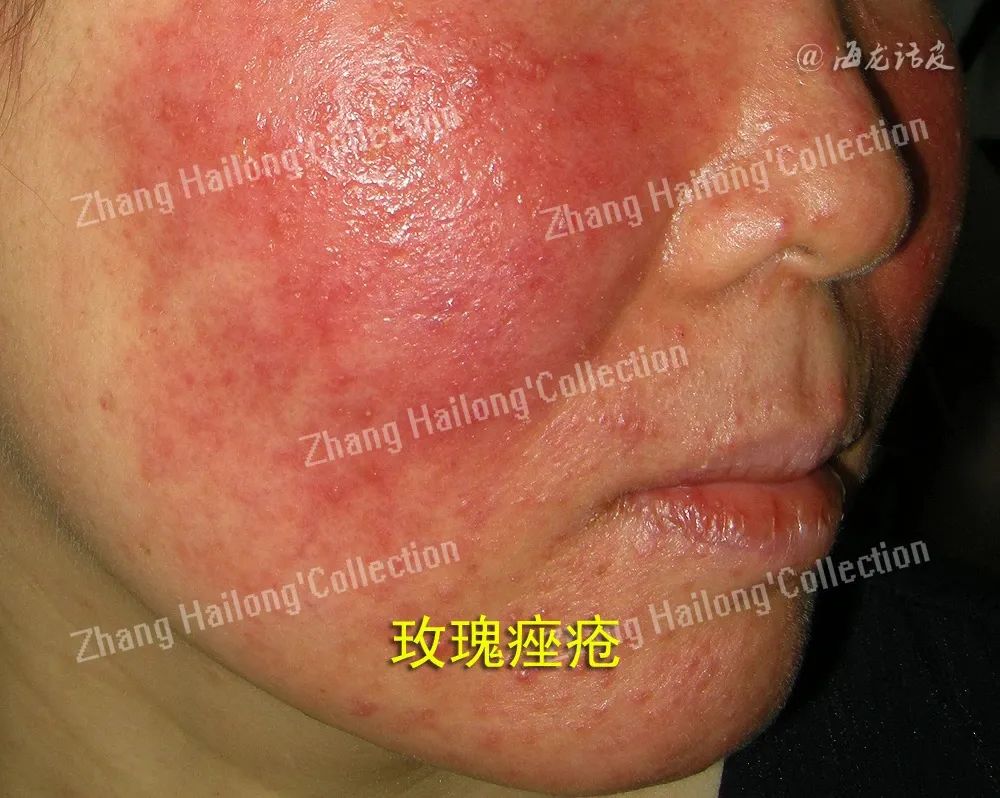
3、神经免疫调控:
玫瑰痤疮发病机制涉及复杂的神经免疫相互作用。皮肤免疫系统通过细胞间的信号传递与响应来维持其功能,并应对外界威胁。免疫调控参与了面部血管扩张、毛细血管渗漏等过程,涉及血管内皮生长因子和免疫相关的细胞因子。炎症性细胞因子如白细胞介素‑18 (interleukin‑18,IL‑18)和白细胞介素‑17(interleukin‑17,IL‑17)在玫瑰痤疮中显著上调,与疾病的严重性直接相关。IL‑17是一种重要的促炎因子,其在患者血清中的水平升高是玫瑰痤疮特征性炎症反应的标志之一。
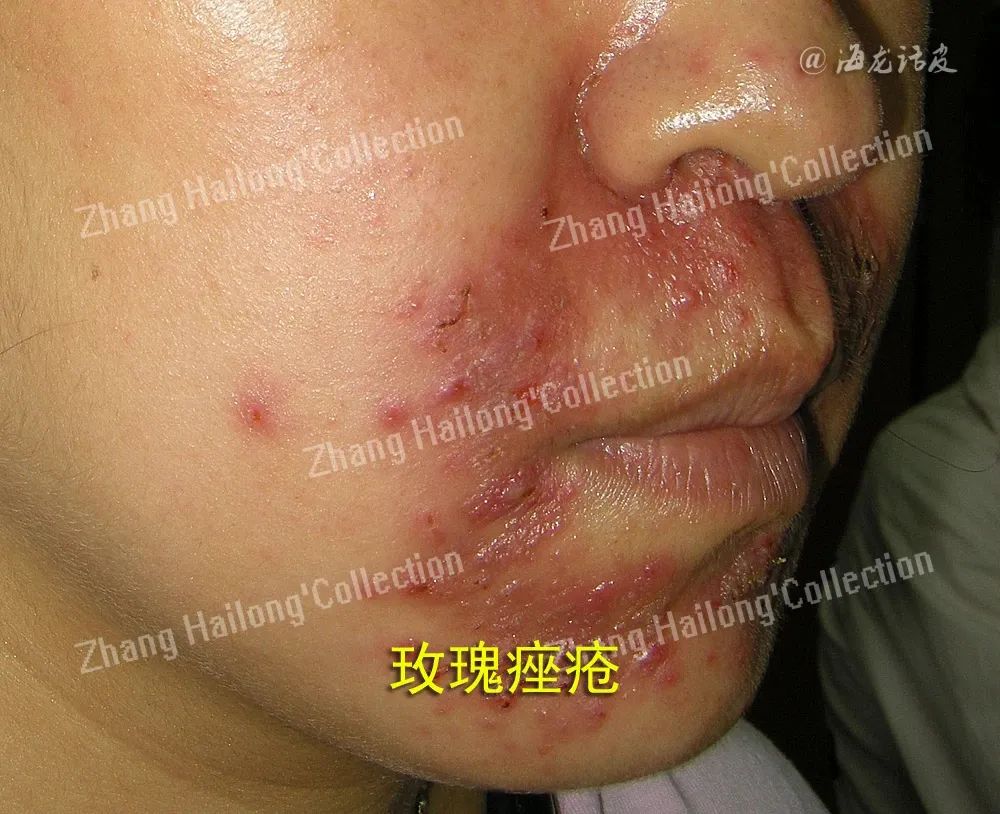
抗菌肽LL‑37(human cathelicidin antimicrobial peptide,LL‑37)也在病理过程中起着关键作用,其在玫瑰痤疮模型中通过激活TLR‑2(Toll‑like receptor2,TLR‑2)、KLK‑5(Kallikrein‑5,KLK‑5)、环腺苷酸单磷酸(cyclic adenosine monophosphate,cAMP)等基因,促进了免疫细胞的浸润和炎症因子的释放。疾病机制涉及激肽酶(Kallikreins,KLKs)和MMPs的增加,加剧了细胞外基质的降解和炎症损伤。
活性氧(reactive oxygen species,ROS)在角质形成细胞中的激活促炎信号在玫瑰 痤疮的免疫调节中扮演重要角色。Nav1.8是一种抗河豚毒素(tetrodotoxin‑resistant,TTX‑R)电压门控钠离子通道,由SCN10A基因编码,主要表达于感 觉神经元,与炎性和神经性疼痛密切相关。其过度表达可能通过调节促炎介质IL‑1β和IL‑6的表达,促进免疫浸润、增加ROS和炎症介质的产生,从而影响炎症性皮肤疾病的发展。
神经系统的异常活化在玫瑰痤疮发病中同样起着决定性作用。感觉神经元通过释放神经肽,如血管活性肠肽(vasoactive intestinal peptide,VIP)和垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase activating polypeptide,PACAP),以及降钙素基因相关肽(calcitonin gene related peptide,CGRP)和P物质(substance P,SP),促进了炎症反应和血管扩张。这些神经传递物质通过与免疫细胞的相互作用,如肥大细胞和内皮细胞,推动玫瑰痤疮的病程。基因研究揭示LRRC4、SH3PXD2A和SLC26A8基因变异与玫瑰痤疮遗传相关,导致神经细胞产生血管活性神经肽,揭示了疾病潜在的家族遗传性和神经源性炎症机制。
综上所述,玫瑰痤疮的发病涉及免疫调控和神经调控的紊乱,其中细胞因子、抗菌肽、神经肽和基因表达的改变共同影响了疾病的进展。这种免疫与神经系统的复杂相互作用是治疗玫瑰痤疮时需要关注的关键点。
4、主要信号通路:
有研究表明MAS相关G蛋白耦联受体‑X2(MRGPRX2)/B2(小鼠对应编码)参与了玫瑰痤疮的发生,MrgprB2通过β‑抑制蛋白2(一种介导受体脱敏的重要可溶性蛋白质)的调节在小鼠玫瑰痤疮样炎症中发挥作用,β‑抑制蛋白2通过促进丝切蛋白(cofilin)去磷酸化、细胞外信号调节激酶1/2(extracellular signal‑regulated kinase1/2,ERK1/2)和核因子κB(nuclear factor kappa‑light‑chain‑enhancer of activated B cells, NF‑κB)磷酸化、肥大细胞趋化和趋化因子的产生参与了玫瑰痤疮的发病。神经肽激动剂与MRGPRX2的结合能够激活肥大细胞,并促使其释放炎症介质,从而导致炎症反应和病变。但目前尚无确凿证据证明MRGPRX2在玫瑰痤疮的发病机制中扮演着关键的角色,因此尚需进一步研究来深入了解MRGPRX2在玫瑰痤疮中的具体作用机制。
瞬时受体电位(transient receptor potential,TRP)阳离子通道在炎症性皮肤病中起重要作用,非神经元细胞表达的 TRPV 通道的失调可能在玫瑰痤疮的发生发展中发挥关键作用。人类角质细胞中瞬时受体电位香草酸受体3(transient receptor potential vanilloid 3,TRPV3)的激活可以调节炎症反应,研究显示,缺乏TRPV3的角质形成细胞会损害蛋白酶激活受体2(protease‑activated receptor 2,PAR2)的功能,导致神经元激活减少,并在PAR2激动剂的作用下产生搔抓行为,这与玫瑰痤疮患者面部痒痛和发红有关。同时,瞬时受体电位香草酸受体1/2/3/4(transient receptor potential vanilloid1/2/3/4,TRPV1、TRPV2、TRPV3、TRPV4)在各型玫瑰痤疮的基因表达也有不同程度的增强,温度敏感受体TRPV4和TRPM8也参与玫瑰痤疮瘙痒的机制。
当TRP通道被外界刺激(如热)激活时,导致血管活性神经肽的释放,如SP、降钙素基因(calcitonin gene‑related peptide,CGRP)相关肽、垂体腺苷酸环化酶(pituitary adenylate cyclase‑activating polypeptide,PACAP)激活肽、血管活性肠肽(vasoactive intestinal peptide,VIP),甚至与面中央血管舒张相关的缓激肽。
5、微生物菌群失调:
玫瑰痤疮的发病机制中,皮肤微生物群也被广泛讨论研究,其对于调节炎症和免疫反应至关重要。研究显示,患者皮肤和肠道微生物群中常见的细菌包括毛囊蠕形螨、表皮葡萄球菌和痤疮角质杆菌。在蠕形螨阳性的个体中,CD4+T细胞、巨噬细胞和朗格汉斯细胞的数量增多,显示螨虫寄生可能引发炎症,并可作为细菌传播媒介。玫瑰痤疮患者皮肤上最丰富的菌种是痤疮角质杆菌和表皮葡萄球菌。肠道微生物群具体的机制尚不清楚,但其失调可能增加宿主的易感性,破坏黏膜免疫耐受性,并进而影响皮肤健康,同时,幽门螺杆菌在是否是玫瑰痤疮的成因之一方面,以及抗菌药物对其他微生物的影响仍需进一步研究。
结语
玫瑰痤疮是一种常见的慢性皮肤炎症性疾病,其发病机制涉及多种复杂的生物学过程。研究发现,玫瑰痤疮的发展与皮肤固有免疫系统的异常有关。皮肤是人体最大的器官,其屏障功能的紊乱可能导致外界致病因子侵入皮肤,激活炎症反应。此外,抗菌肽的改变也可能在玫瑰痤疮的发病中扮演重要角色。免疫细胞的异常活化也是玫瑰痤疮病情恶化的重要因素之一。炎症反应中,巨噬细胞、T细胞(如Th1和Th17细胞)的过度活化可导致组织破坏和病变。血清中细胞因子水平的升高与炎症的持续存在密切相关,形成恶性循环。神经免疫系统的异常激活也在玫瑰痤疮的发病机制中起着重要的作用,神经肽和神经递质的释放可以影响炎症反应和血管活性,加剧皮肤炎症。
此外,一些信号通路的异常激活,如MRGPRX2和TRP阳离子通道的参与,可能加剧病情。微生物菌群的失衡可能是玫瑰痤疮发病机制的潜在因素之一,肠道和皮肤菌群的失调可能影响免疫系统的平衡,加重病情。深入了解这些复杂的相互作用有助于揭示玫瑰痤疮的病理机制,为治疗和干预提供新的思路。未来通过调控皮肤固有免疫系统、调节免疫细胞活化、恢复神经免疫平衡以及调整微生物菌群,可能会为玫瑰痤疮的治疗带来新的突破。
参考文献:
1.彭承悦,宋晓婷,赵作涛.玫瑰痤疮的神经免疫机制[J].中华预防医学杂志, 2024,11(58):1777-1782.
2.中华医学会皮肤性病学分会玫瑰痤疮研究中心, 中国医师协会皮肤科医师分会玫瑰痤疮专业委员会. 中国玫瑰痤疮诊疗指南(2021版)[J].中华皮肤科杂志 , 2021, 54(4):279‑288.
3.赵作涛,宋晓婷,刘擘,等.玫瑰痤疮的病理生理发病机制研究进展[J].中华皮肤科杂志, 2022, 55(5): 446‑449.
4.其他文献略。