近年来,体内细胞编程因《科学》杂志报道的in vivo CAR-T技术掀起热潮,但焦点始终局限于肿瘤免疫治疗。中国科学技术大学王育才/李敏团队独辟蹊径,首次将目光投向抗原提呈细胞(APCs),通过皮下注射搭载PDL1 mRNA的脂质纳米颗粒(LNPs),直接在体内“重编程”出耐受型APCs(tol-APCs)!这些改造后的APCs能精准识别过度活化的致病T细胞,通过PDL1/PD1信号通路诱导其失活或转化为调节性T细胞(Treg),同时保护正常免疫细胞,攻克了传统疗法“杀敌一千自损八百”的困境,为自身免疫疾病治疗开辟全新维度!
mRNA技术此前已广泛应用于预防疫苗(如新冠)、肿瘤疫苗、蛋白替代疗法三大领域,而中科大团队将其成功拓展至免疫细胞的重编程和自身免疫性疾病的治疗!近日,中国科学技术大学王育才/李敏团队在《Nature biomedical engineering》杂志在线发表题为“Generation of tolerogenic antigen-presenting cells in vivo via the delivery of mRNA encoding PDL1 within lipid nanoparticles”的研究论文。通过优化LNPs的N/P比与组分配比,大幅降低纳米颗粒本身的免疫刺激性,确保mRNA在APCs中高效表达PDL1,将其转变为tol-APCs的同时却不引发炎症反应(图1)。动物实验显示,该疗法在类风湿性关节炎和溃疡性结肠炎模型中显著抑制异常T细胞活性、促进Treg扩增,为自身免疫病提供潜在治疗方案,进一步拓展mRNA技术的应用边界。

此项研究,不仅突破了体内细胞编程的传统范式,以“无需体外操作、精准靶向、平台化适配”三大优势,直击自身免疫性疾病治疗的临床痛点,具有极高的临床转化价值,或成为现有疗法之外的全新选择策略。
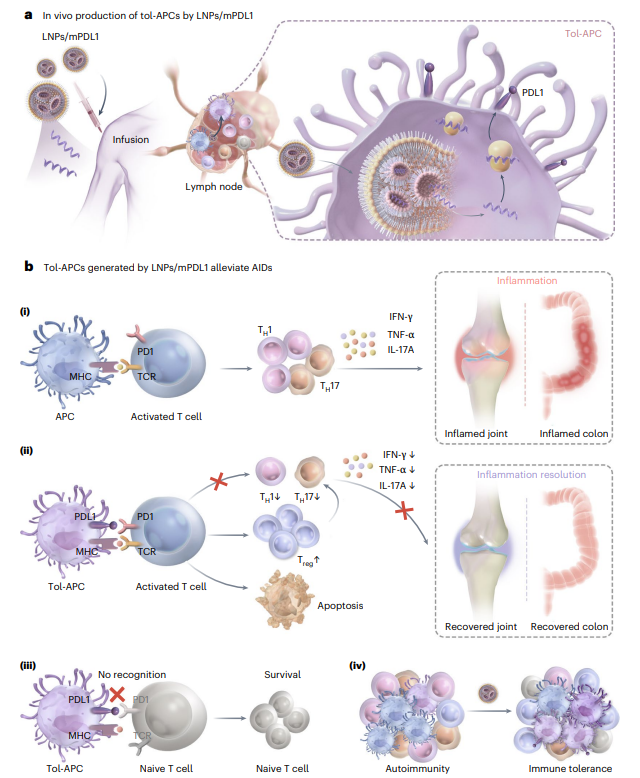
图1. 低免疫原性递送mRNA生成tol-APCs用于自身免疫性疾病治疗
低免疫原性LNPs的定向设计与优化
本研究针对传统mRNA递送系统在自身免疫病治疗中的局限性展开技术攻关。经典LNPs如COVID-19疫苗载体通过激活APCs表面共刺激分子(CD80/CD86/CD40)引发强效免疫应答,与自身免疫疾病治疗所需的免疫耐受诱导目标存在根本性矛盾。为解决这一治疗悖论,研究团队创新性地采用实验设计(DOE)策略,系统筛选由SM-102、DSPC、DMG-PEG2000和胆固醇构成的四组分体系中各脂质的摩尔比及N/P比,建立LNP库。通过Taguchi正交实验设计结合两阶段筛选方案,成功获得具有低免疫激活特性且维持高效转染能力的优化配方(图2)。该突破性LNP配方展现出双重优势:在保持与传统载体相当的转染效率的同时,使APCs表面共刺激分子CD80、CD86、CD40的表达水平分别降低。动物实验证实,负载PDL1编码mRNA的优化LNPs(LNPs/mPDL1)经皮下给药后,可在淋巴结CD11c+和CD11b+细胞等APCs中实现特异性PDL1表达,说明了tol-APCs的成功生成,而骨髓中未检测到tol-APCs生成。值得注意的是,LNPs/mPDL1对非APC免疫细胞亚群的影响极低,仅使脾脏总APCs的共刺激分子表达轻微上调,充分验证了优选的LNP系统在实现低免疫原性mRNA递送方面的技术突破。该研究为mRNA技术在自身免疫疾病治疗中的应用提供了具有转化潜力的递送解决方案。
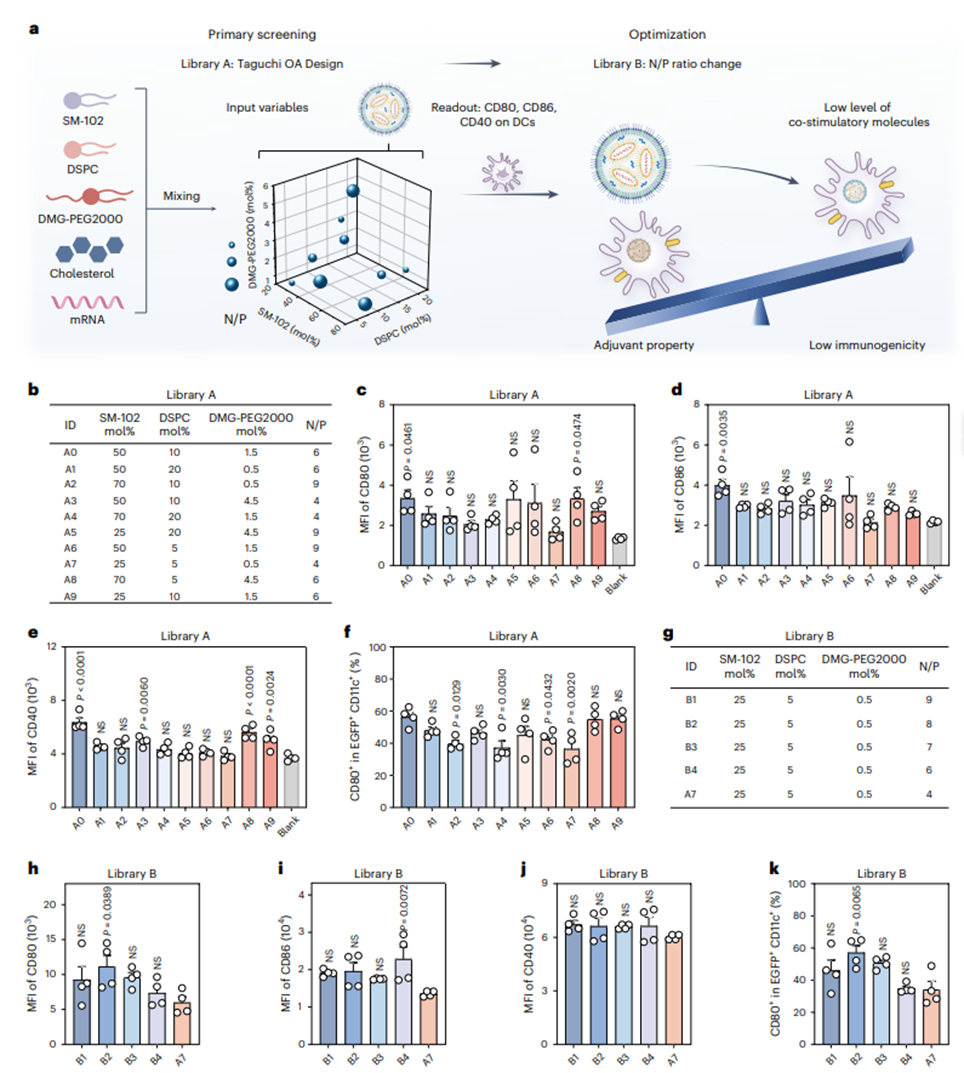
图2. LNP优化策略以实现低免疫原性递送mRNA
从体外到体内的tol-APC生成与功能验证体外模型中,DC2.4(树突状细胞系)和RAW264.7(巨噬细胞系)经LNPs/mPDL1处理后,表面PDL1蛋白表达量显著提升2-3倍,证实其向tol-APCs转化能力。而在体内模型中,LNPs优先靶向淋巴结和脾脏中的CD11c+/CD11b+ APC细胞,表面PDL1阳性率显著提高,而非APC细胞几乎无表达。此外,研究团队发现,LNPs/mPDL1处理后,tol-APCs的在体生成可维持4天左右,保证了其生成的有效性与可调控性(图3)。
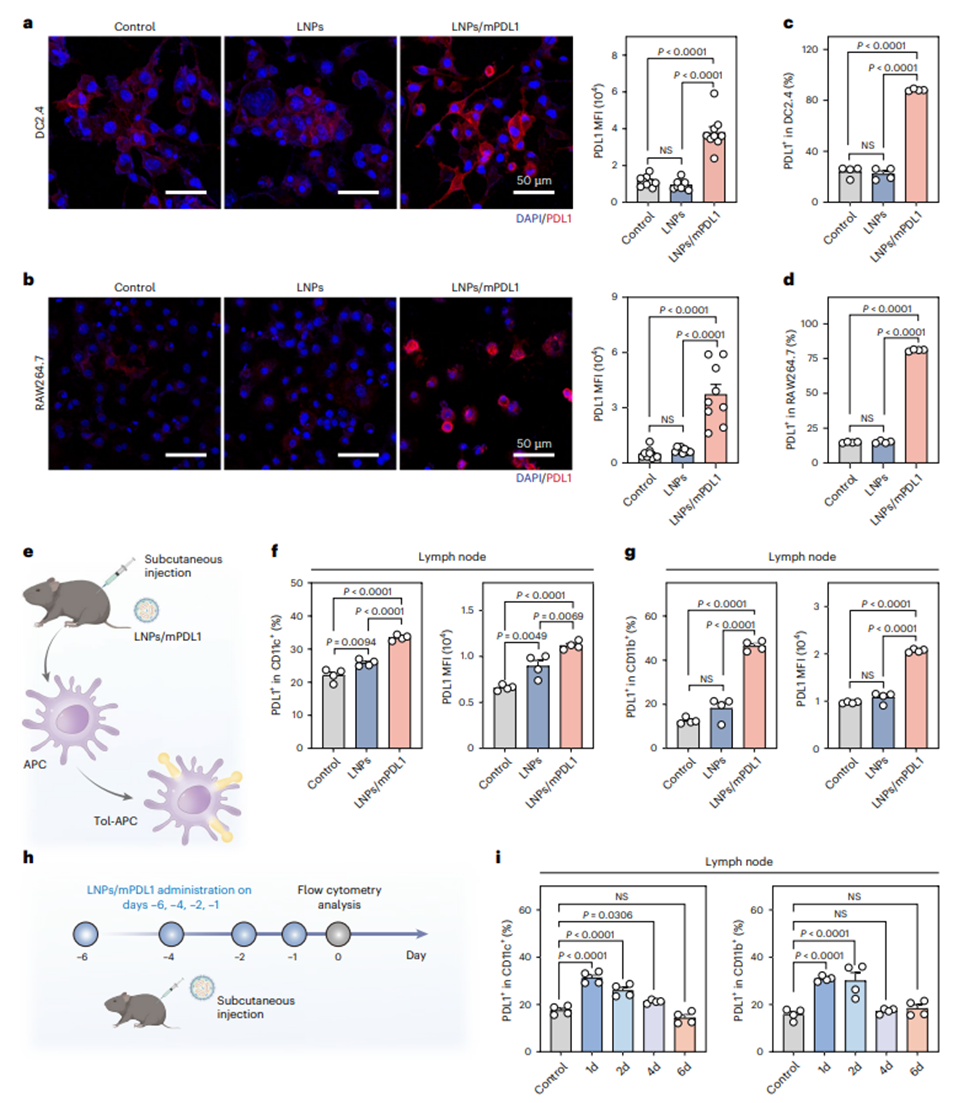
图3. LNP/mPDL1诱导生成tol-APCs
研究团队随后对生成的tol-APCs功能进行验证。PD1在活化的T细胞中通常呈现高表达,而在初始T细胞中表达水平较低,其在防止T细胞过度活化和促进免疫耐受中发挥关键作用。研究团队使用CD3/CD28激动性抗体(αCD3/CD28)刺激T细胞高表达PD1,来模拟活化的T细胞状态,并与LNPs/mPDL1体外诱导生成的tol-APCs共培养;流式细胞术结果显示tol-APCs显著促进活化T细胞的凋亡,而对未活化T细胞无影响,提示其通过PDL1/PD1通路选择性抑制活化T细胞。类似地,tol-APCs与T细胞共培养48小时后,流式细胞检测到活化CD4+和CD8+ T细胞的增殖均显著降低(图4)。
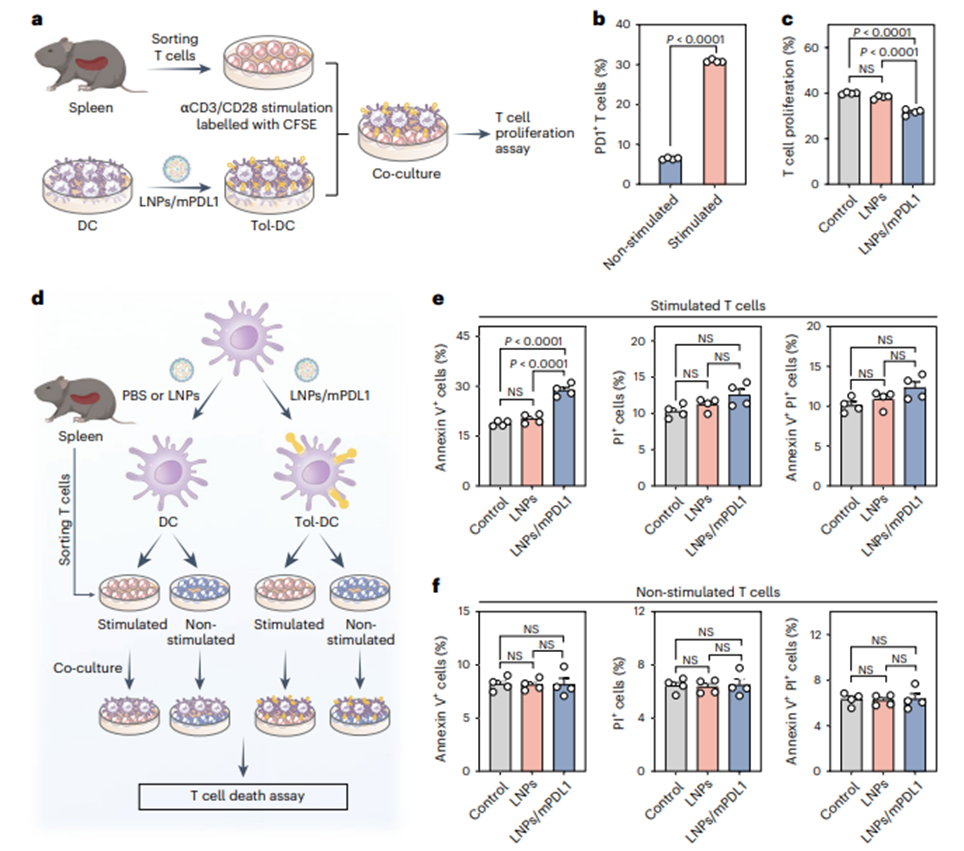
图4. LNPs/mPDL1生成的tol-APCs在体外减少活化T细胞增殖并诱导其凋亡
此外,该研究通过过继细胞转输实验探究了LNPs/mPDL1诱导的体内tol-APCs对活化T细胞抑制作用的选择性。分离Balb/c小鼠脾脏T细胞并对部分T细胞刺激活化,将活化/未活化T细胞按1:1比例混合后过继转移到LNPs/mPDL1处理后BALB/c裸鼠体内(最小化宿主免疫系统的影响)。流式细胞术结果证实了受体小鼠体内成功生成耐受性DCs,同时与对照组相比,LNPs/mPDL1处理组活化T细胞比例显著减少,T细胞中活化T细胞/非活化T细胞的比值也显著降低。LNPs/mPDL1在体内选择性减少CD4+和CD8+活化T细胞比例的同时,也增加了非活化T细胞的比例。这些结果表明,皮下注射的LNPs/mPDL1能够选择性地清除过度活化的T细胞,同时对静息T细胞影响极小,凸显了该方法的特异性与治疗的安全性(图5)。
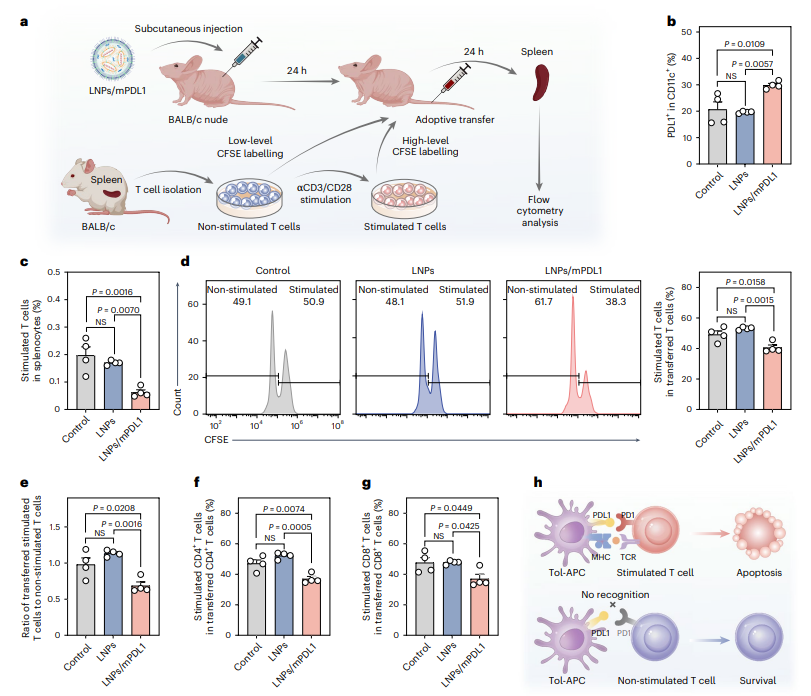
图5. tol-APCs选择性减少体内活化T细胞
媲美临床药物的诱导免疫抑制效果随后,研究团队构建了疾病模型来验证LNPs/mPDL1对自身免疫病模型的治疗效果。在Ⅱ型胶原免疫诱导的类风湿性关节炎(RA)模型中,DBA/1小鼠经LNPs/mPDL1治疗后,关节肿胀评分显著降低,且软骨损伤程度接近正常水平(通过番红固绿染色评估)。滑膜组织免疫组化分析显示,IFN-γ和TNF-α的表达量水平降低,CD8+和CD4+ T细胞浸润减少,而Tregs比例增加。值得注意的是,治疗组的关节炎症评分与TNF-α抑制剂依那西普相当,证实LNPs/mPDL1有效缓解RA症状(图6)。
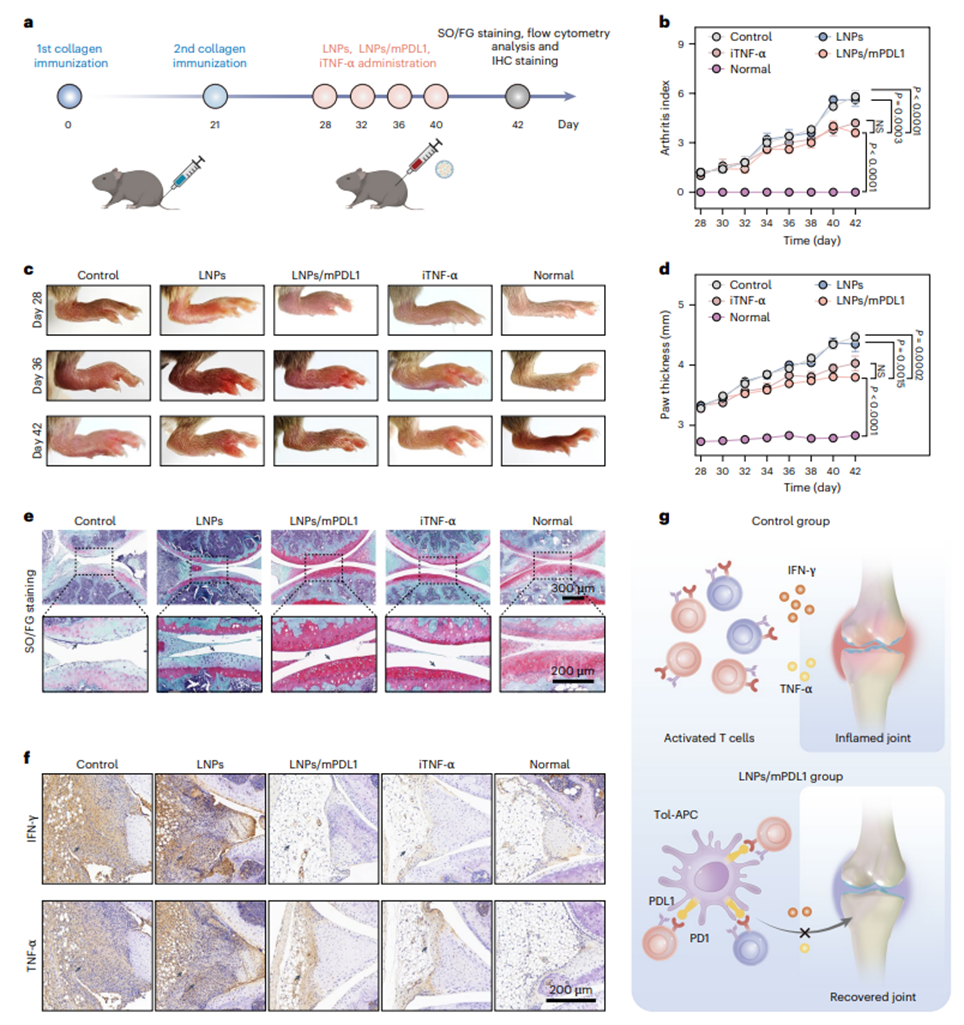
图6. LNP/mPDL1体内生成的tol-APCs抑制类风湿性关节炎(RA)进展
研究团队随后对LNPs/mPDL1在另一自身免疫疾病——溃疡性结肠炎(UC)模型的治疗效果进行了评估。C57BL/6小鼠经DSS诱导后出现严重结肠缩短(平均长度5.6 cm)和黏膜损伤。LNPs/mPDL1治疗组结肠长度恢复至正常水平(6.6 cm),且黏膜结构完整,隐窝破坏显著缓解,且其治疗效果与环孢素相当。同时LNPs/mPDL1治疗显著减少肠道炎症部位的CD4+和CD8+ T细胞浸润,增加了Treg数量,并降低TNF-α水平;此外,研究团队还发现,LNPs/mPDL1显著降低了肠系膜、腹股沟淋巴结、脾脏和血液中的效应T细胞(图7)。因此LNPs/mPDL1可有效缓解DSS诱导的结肠炎。
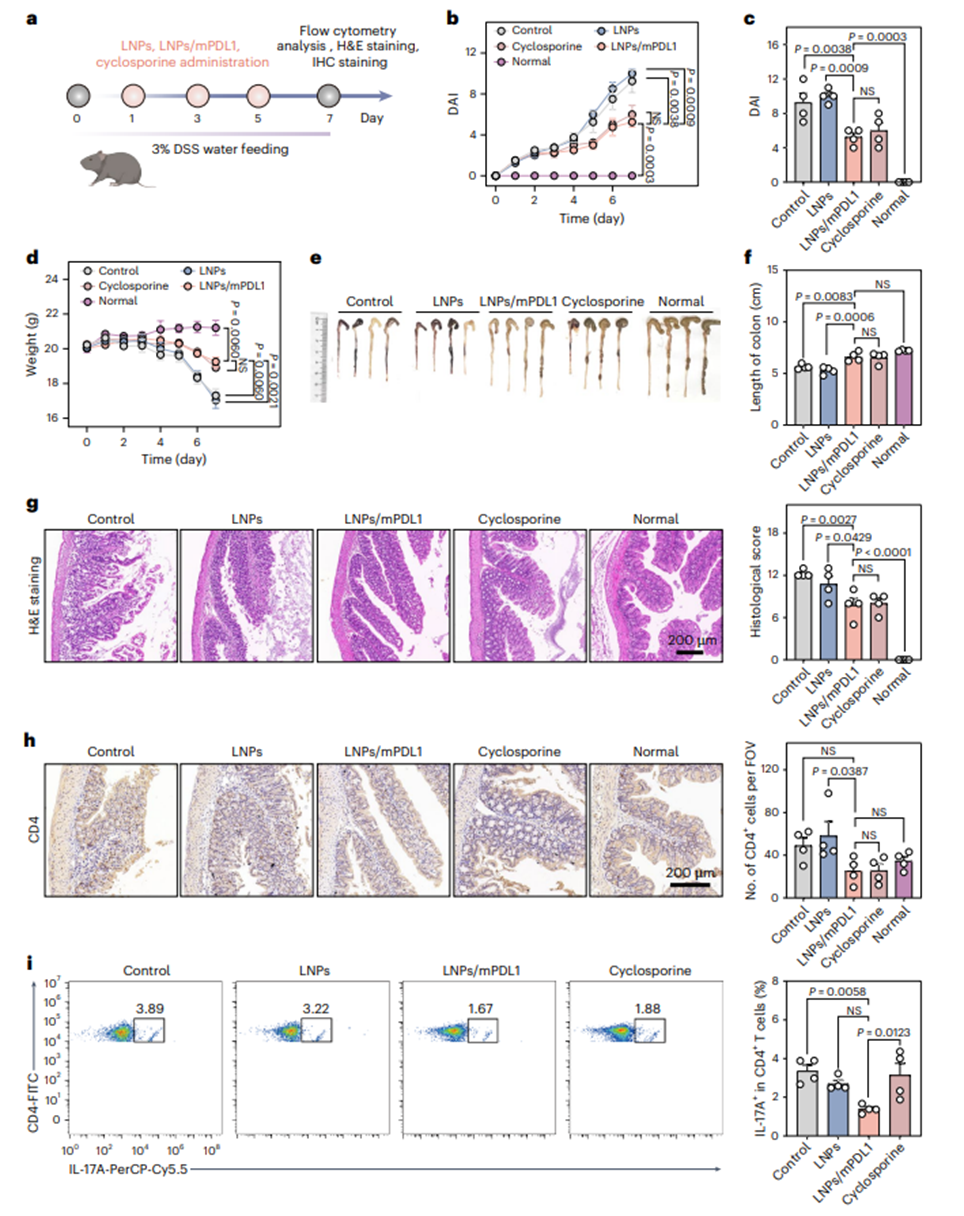
图7. 体内生成的tol-APCs在溃疡性结肠炎(UC)小鼠模型中发挥治疗作用
小结该团队通过优化LNPs的N/P比与脂质组成,显著降低载体免疫原性,使APCs特异性高表达PDL1而不引发炎症反应,从而精准抑制致病性T细胞活性并扩增Treg。在RA和UC模型中,其疗效优于临床标准药物依那西普与环孢素,且单次治疗成本不足传统体外细胞疗法的1%,兼具高效性与经济性。研究突破传统疗法的三大局限:无需体外操作,皮下注射直接靶向APCs;广谱适应,非抗原特异性模式适用于病因不明的自身免疫病(如UC),而加载特定抗原可拓展至多发性硬化症等疾病;平台化扩展,未来可整合CTLA-4等共抑制分子或趋化受体增强疗效,或通过肝靶向递送诱导移植免疫耐受。此项成果以“体内细胞编程”理念,为自身免疫病、器官移植及蛋白替代疗法提供全新范式,推动个体化医疗向精准免疫重塑迈进。
中国科学技术大学刘洋博士、刘潜博士、博士生张宝文为该论文共同第一作者,中国科学技术大学王育才教授、李敏副教授为本文共同通讯作者;团队其他成员及合作者也为本研究做出了重要贡献。
原文链接:
https://www.nature.com/articles/s41551-025-01373-0