在过去的十年中,免疫检查点抑制剂(ICI)已被确立为当代抗癌武器库中不可或缺的组成部分。在皮肤病学中,ICI 在晚期黑色素瘤治疗中的应用最成熟。然而,新出现的证据表明,ICI 在皮肤肿瘤学中的疗效扩展到各种其他非黑色素瘤恶性肿瘤。本综述提供了过去三年中黑色素瘤以外的皮肤恶性肿瘤的临床试验、真实世界分析和转化研究的证据更新。特别关注需要进一步评估的领域——包括临床试验中代表性不足或被排除在外的人群;转移性疾病患者以外的新出现的治疗场景;新型联合疗法;以及迫切需要可靠的疗效预测性生物标志物。肿瘤学家、皮肤科医生和皮肤外科医生之间的合作对于促进我们对晚期皮肤恶性肿瘤患者的了解和治疗至关重要。
背 景
在过去十年中,免疫检查点抑制剂(ICI)的出现无疑改变了肿瘤学领域。最初在晚期黑色素瘤中进行研究,由于前所未有的持久肿瘤缓解,ICI 迅速成为这些患者的一线(1 L)标准治疗选择。后续研究也探索并巩固了 ICI 在其他实体瘤和血液系统肿瘤中的应用。
ICI 阻断负调节性 T 细胞检查点,增强抗肿瘤免疫原性。ICI 包括细胞毒性T淋巴细胞抗原-4(CTLA-4)抑制剂伊匹木单抗或曲美木单抗,程序性细胞死亡-1(PD-1)抑制剂帕博利珠单抗、纳武利尤单抗或塞米普利单抗,以及程序性细胞死亡配体-1(PD-L1)抑制剂阿维鲁单抗、阿替利珠单抗或度伐利尤单抗。淋巴细胞活化基因-3(LAG-3)抑制剂 relatlimab 最近也被美国食品药品监督管理局和欧洲药品协会批准与纳武利尤单抗联合治疗晚期黑色素瘤,此前 RELATIVITY-047 试验观察到,与单独使用纳武利尤单抗相比,无进展生存期(PFS,中位 10.1 个月 vs 4.6 个月)较优。
鉴于过去五年中临床和转化研究的显著进展,有必要重新评估皮肤肿瘤学中 ICI 现状,确保临床推荐保持最新。鉴于大量已发表文献回顾了 ICI 针对该适应症的进展,本综述侧重于黑色素瘤以外的皮肤癌。此外,我们将主要关注疗效,因为 ICI 的毒性特征也已被广泛描述。
皮肤鳞状细胞癌
塞米普利单抗(cemiplimab)和帕博利珠单抗目前均已获得美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准,用于治疗不适合根治性手术或放疗的晚期皮肤鳞状细胞癌(cSCC),并推荐作为此类患者的 1 L 全身性治疗。
塞米普利单抗和帕博利珠单抗治疗皮肤鳞状细胞癌(cSCC)的试验的长期随访显示,客观缓解率(ORR)高达 35.2-46.1%(完全缓解(CR)率为 10.5-16.1%)(表 1),大多数在 12 个月时仍持续缓解(77.8-87.8%)。塞米普利单抗的中位总生存期(OS)未达到,提示生存期超过 18.5 个月,而帕博利珠单抗的中位 OS 为 26.4 个月。重要的是,Rischin 等人还报道,与基线相比,使用塞米普利单抗 3 周期后,生活质量(QoL)评分提高。

表1
最近还报道了 PD-1 抑制剂 1 L 治疗的两项 2 期试验结果,一项涉及纳武利尤单抗,另一项涉及帕博利珠单抗(表 1)。在跨试验比较中,活性与早期研究相似——ORR 42.0-58.3%,中位 OS 20.7-25.3 个月。图 1 展示了一例不可切除 cSCC 使用塞米普利单抗后达到 CR 的实例。
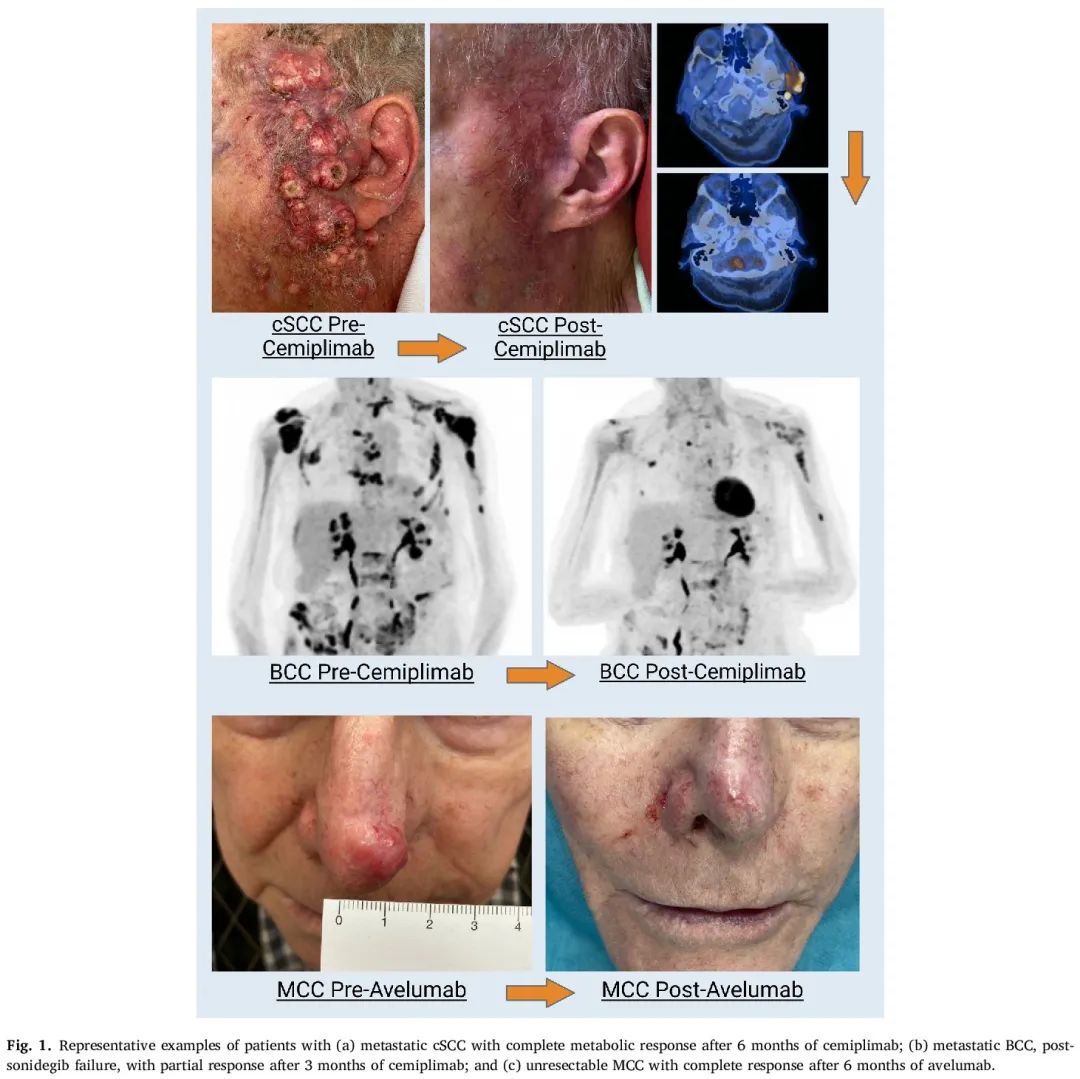
图1
有试验正在探索在晚期 cSCC 中增强抗 PD-1 活性的联合方法,例如纳武利尤单抗联合或不联合 relatlimab(瑞拉利单抗)用于 1 L 治疗(NCT04204837)。表皮生长因子受体抑制剂和 ICI 联合疗法也正在研究中,例如在一项试验中,帕博利珠单抗难治性 cSCC 患者接受帕博利珠单抗和西妥昔单抗联合治疗。中期分析(n = 23)报告联合治疗的 ORR 为 44%,1 年 PFS 为 42%。
病灶内药物也正在研究中,作为在晚期/转移性情况下增加晚期 cSCC 活性的策略。这包括 CERPASS 研究比较纳武利尤单抗单药或与溶瘤病毒 RP1 联合用于晚期 cSCC 的 1 L 治疗(NCT05858229)。该联合疗法已在抗 PD-1 难治性黑色素瘤中进行了试验,随访 24 个月后,报告的 ORR 为 31.4%(12.2% 完全缓解),中位缓解持续时间未达到。放疗也常与抗 PD1 药物一起用于局部晚期 cSCC,特别是对于全身治疗后仍残留或寡进展的肿瘤,在真实世界研究中没有增加毒性。有研究正在探索放疗联合阿替利珠单抗用于这种情况(NCT05085496)。
晚期 cSCC 通常发生于虚弱或免疫功能低下的患者,这些患者通常不符合临床试验条件。因此,真实世界证据(RWE)对于支持其使用至关重要,例如正在进行的塞米普利单抗在真实世界环境中的研究。抗 PD-1 用于 cSCC 的 RWE 研究(表 2)观察到不同的 ORR,范围为 31.5-80.0%(CR 7.9-35.7%),中位 PFS 为 5.4-19.6 个月,OS 为 8.0-30.9 个月,表明真实世界临床队列中存在很大异质性。此外,RWE 能够提供临床试验通常未报告的有意义的数据,例如停止 ICI 治疗后反应的持久性。例如,一项多中心研究报告了 5 例获得缓解的患者(60% 达到完全缓解)在中位治疗 24 个月后停止抗 PD-1 治疗。在中位停药 8 个月后,一例部分缓解患者(20%)复发。需要关于 cSCC 停用 ICIs 后缓解的持久性和复发预测因子以及再次使用 ICI 的缓解率的进一步数据,来指导治疗合理化策略。
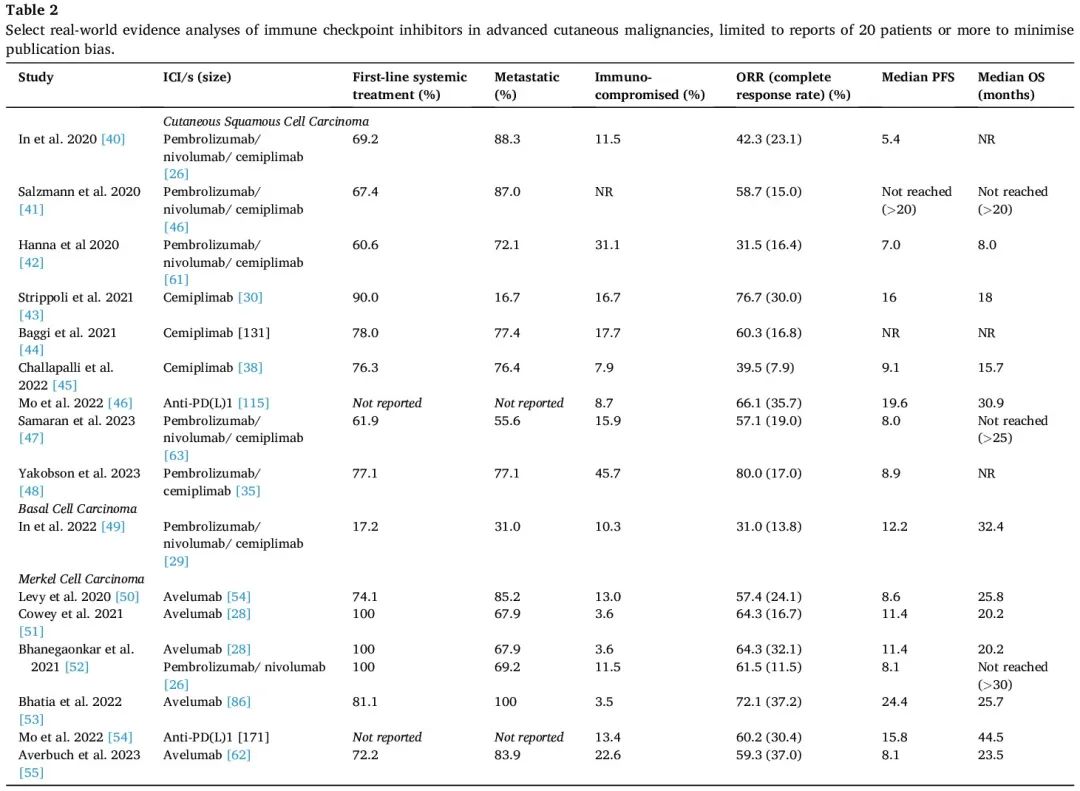
表2
令人鼓舞的是,临床试验纳入了更具代表性的队列,例如一项纳武利尤单抗治疗 cSCC 的试验允许血液系统恶性肿瘤患者入组(占队列的 34.5%),显示了类似的疗效和安全性结局。这与一项真实世界分析形成对比,该分析表明,与无血液系统恶性肿瘤的患者相比,存在血液系统恶性肿瘤的晚期 cSCC 患者 PFS 较短(中位 4 个月 vs 超过 24 个月)。据报道,在接受抗 PD-1 药物治疗的晚期黑色素瘤中,血液系统恶性肿瘤患者(尤其是既往接受过淋巴细胞清除化疗的患者)的 PFS 和 OS 差于无血液系统恶性肿瘤的患者。这提示在考虑 ICI 治疗晚期 cSCC 时,血液系统恶性肿瘤不应成为障碍,尽管疗效可能低于其他人群。
被排除在关键 ICI 试验之外的一部分关键人群是实体器官移植受者(SOTR)。鉴于 SOTR 中 cSCC 的发生率显著较高,与一般人群相比,高出 65-250 倍,因此必须解决这个问题。最近一篇对已发表的 ICIs 治疗 SOTRs 癌症病例的综述(n = 119)报告,同种异体移植物排斥反应率为 41.2%,导致 57.1% 移植物失败。对于 cSCC 患者(n = 22),ORR 高达 68.2%(CR 31.8 %),尽管中位缓解持续时间似乎较短,为 9.0 个月。
在 SOTR 中减少排斥反应同时保持 ICI 抗癌活性的研究方法包括探索纳武利尤单抗±伊匹木单抗+他克莫司/泼尼松用于肾移植受者(67% cSCC)。纳武利尤单抗组的同种异体移植物丢失率为 8.3%,伊匹木单抗-纳武利尤单抗组为 33.3%,而 ORR 分别为 0% 和 67%。相比之下,一项纳入晚期 cSCC 肾移植受者(n = 10)接受塞米普利单抗加脉冲泼尼松龙和 mTOR 抑制剂的试验报告无排斥反应,ORR 为 50%,中位随访 6.3 个月。因此,对于不可切除 cSCC SOTR 患者,最佳管理尚不清楚,需要仔细的 MDT 讨论和以患者为中心的决策,尤其是在包括 mTOR 抑制剂和逐渐减量的钙调磷酸酶抑制剂的免疫抑制方案的管理方面。潜在风险包括有 ICI 介导的排斥反应风险的器官同种异体移植物类型,心脏或肺移植排斥反应与较高的死亡率相关,应与 cSCC 疾病负荷和其他治疗选择相平衡。
在围手术期,与仅辅助治疗相比,新辅助 ICI 可能诱导更大的抗肿瘤 T 细胞扩增和多样性,如在黑色素瘤中观察到的那样。两项 2 期试验分别涉及 20 例和 70 例可切除高危 cSCC 患者,2-4 剂新辅助塞米普利单抗分别在 75% 和 64% 的患者中产生完全至主要病理缓解(MPR;0-10% 的残留肿瘤)。中位随访 42.3 个月后,来自 20 例患者队列的更新数据显示,MPR 患者无人复发,而未获得缓解的患者复发率为 60%。
多项试验正在评估可切除 cSCC 的围手术期方法,包括正在进行的比较术后塞米普利单抗与安慰剂辅助治疗的 RCT。值得注意的是,最近,一项比较帕博利珠单抗与安慰剂辅助治疗的 RCT(KEYNOTE-630)在中期无效分析显示干预组没有无复发生存期(RFS)获益后已终止。正在进行的新辅助 MATISSE RCT(n = 50)评估了纳武利尤单抗联合或不联合伊匹木单抗新辅助治疗用于打算进行广泛手术的 cSCC 患者,初步结果显示,MPR 分别为 50% 和 61%。至关重要的是,18% 的患者获得临床完全缓解,可以避免潜在的致残手术。
目前在可切除和晚期 cSCC 患者中也正在探索多种病灶内方法。包括一项正在进行的可切除 cSCC 病灶内注射塞米普利单抗新辅助治疗的 1 期研究——剂量递增队列(n = 17)报告的 MPR 为 76.5%。类似地,Daromun 是两种抗体-细胞因子融合(L19IL2/L19TNF)的组合,一项 Daromun 新辅助治疗试验也在招募高危可切除 cSCC 患者——在黑色素瘤中开展的一项类似的 RCT报告,病理完全缓解率为 21%,RFS 优于安慰剂(风险比 0.61)。最后,病灶内 RP1 目前正在一项纳入可切除 cSCC(NCT04050436)患者的单臂新辅助试验中进行研究。
基底细胞癌
晚期或转移性基底细胞癌(BCC)通常接受 hedgehog 抑制剂(HHI)作为 1 L 治疗,因为 ORR 高于 50%,中位 PFS 超过 20 个月。在一项 2 期试验评估了塞米普利单抗用于既往接受过 HHI 治疗的局部晚期 BCC,纳入了 84 例患者,ORR 为 32%(CR 6%),85% 的缓解者在 12 个月时持续缓解。中位 PFS 为 19 个月,2 年 OS 为 80%(表 1)。报道了显著的疼痛和功能评分改善,尤其是缓解者。转移性队列(n = 54)的数据显示了数值上较低的 ORR,为 24%(CR 2%),和 PFS,中位 8.3 个月。在 HHI 后环境中,纳武利尤单抗也观察到类似的结果(表 1)。
目前,只有塞米普利单抗获得 EMA 批准用于 1 L HHI 进展或不能耐受的晚期 BCC。ICI 治疗晚期 BCC 的真实世界数据有限。In 等人的一项分析(n = 29;83% HHI后)报告,抗 PD-1 的 ORR 为 31%,所有这些 ORR 都在 12 个月时持续。中位PFS和OS分别为12.2个月和32.4个月(表2)。晚期 BCC 使用抗 PD-1 的缓解率低于 cSCC,这可能是由于癌症相关成纤维细胞更活跃和 HLA-g 表达更高等差异——两者都促进了免疫允许的肿瘤微环境。图 1b 展示了索立德吉失败后使用塞米普利单抗获得部分缓解的转移性 BCC 病例。
几项探索新型策略用于晚期 BCC 的试验正在进行中。在一项试验中,患者接受纳武利尤单抗单药治疗,未缓解者接受额外的伊匹木单抗或 relatlimab。中期结果(n = 24)报告了在 1L/HHI 后情况下,纳武利尤单抗的 ORR 分别为 50 %/20 %。然而,纳武利尤单抗治疗后 ICI 双药的活性较低——纳武利尤单抗/relatlimab(n = 6)和纳武利尤单抗/伊匹木单抗(n = 1)的 ORR 分别为 17% 和 0%。
HHI 联合抗 PD-1 疗法是治疗晚期 BCC 的一种新方法。例如,一项 2 期试验正在研究 1 L塞米普利单抗联合脉冲索立德吉治疗晚期 BCC。中期结果(n=10)报告ORR为70%(CR 10%),无严重毒性。既往非随机 1 L 研究表明,连续 HHI 对抗 PD1 没有附加益处,例如一项帕博利珠单抗联合或不联合维莫德吉的研究显示 ORR 分别为 29% 和 44%。
少数试验也在研究可切除高危 BCC 的新辅助方法。包括一项 RCT比较术前四个周期的纳武利尤单抗单抗单药vs联合 relatlimab(NCT06624475)和一项单臂试验评估切除术前 (最多六个周期)塞米普利单抗新辅助治疗(NCT05929664)。此外,上述病灶内 Daromun(L19IL2/L19TNF)单臂试验也在新辅助环境中招募无淋巴结转移的高危 BCC 患者(NCT043622722)。
Merkel细胞癌
在单臂试验中,三种 ICI 在晚期Merkel细胞癌(MCC)中显示出较高疗效——帕博利珠单抗、阿维鲁单抗和retifanlimab(表 1)。尽管跨试验比较存在局限性,在1 L治疗中,PD-1抑制剂(帕博利珠单抗和retifanlimab,分别为58.0%和52.3%)的ORR高于PD-L1抑制剂阿维鲁单抗(36.8%)。这三种 ICI 均已获得 FDA 和 EMA 的批准,推荐用于不适合根治性手术或放疗的晚期 MCC 患者。
抗 PD(L)1 治疗晚期 MCC 的 RWE 报告了与临床试验相似的疗效——ORR 范围为 29.1% 至 72.9%(CR 16.7-37.2%),中位 PFS 为 8.1-24.4 个月,中位 PFS 为 20.2-25.8 个月(表 2)。图 1c 展示了一例阿维鲁单抗治疗后达到 CR 的不可切除 MCC 的实例。两项回顾性研究报道了伊匹木单抗/纳武利尤单抗治疗抗 PD(L)1 难治性 MCC(n = 13-14)的结局,数据差异较大,ORR 0-50.0%,PFS 1.3-5.1 个月,OS 4.7-未达到(>36 个月)。
此外,最近还发表了一项评估伊匹木单抗联合或不联合立体定向放疗(SBRT)治疗晚期 MCC(48% 未接受过全身治疗)的 RCT。SBRT 与疗效或不良事件的差异无关。在未接受过抗 PD(L)1 治疗的患者中,ORR 为 100 %(CR 41 %),中位 PFS 和 OS 未达到(分别为 >30 个月和 > 36 个月)。接受过抗 PD(L)1 治疗的患者的活性较低——ORR 为 31%(CR 15 %),中位 PFS 为 4.2 个月,中位 OS 为 14.9 个月(表 1)。
一项非随机 2 期试验正在比较纳武利尤单抗联合或不联合伊匹木单抗治疗初治晚期 MCC。初步分析(n = 68)报告了相似的 ORR,约为 60%,而有趣的是,纳武利尤单抗单药治疗的 PFS 和 OS 更长。
MCC 停用 ICI 后缓解的持久性尚不清楚。两项 RWE 研究分析了停止抗 PD(L)1 治疗的 MCC 患者,大多在持续缓解后,报告了 12 个月的复发率为 35-60%。在这两项研究中,初始 ICI 缓解的深度(完全vs部分)和初始 ICI 治疗的持续时间与复发无关。然而,PET-CT 完全代谢缓解可能能够预测阿维鲁单抗停药后的持久反应,一项研究表明,88% 的患者在停药后 12 个月仍无病。
由于 MCC 手术切除后复发率高,正在探索多种围手术期 ICI 方法。一项 2 期试验报告了可切除 MCC(n = 36)接受两个周期新辅助纳武利尤单抗后的结局,MPR 率为 61.6%,有或无 MPR 患者的 2 年无复发生存率分别为 89% 和 53%(P = 0.04)。有必要进一步研究 MCC 新辅助 ICI。一项已发表的 RCT 比较了 MCC 切除术后辅助纳武利尤单抗 vs 安慰剂治疗,结果未显示 2 年 RFS 显著降低(2 年时分别为 84% 和 73%)。因此,在临床试验之外,MCC 切除术后不应常规推荐辅助 ICI。
皮肤肉瘤
晚期或转移性卡波西肉瘤(KS)的治疗通常包括细胞毒性化疗。已经发表了两项 ICI 治疗经典 KS(cKS)的 2 期试验(表 1)。伊匹木单抗联合纳武利尤单抗(n = 18,1 L 0 %)和帕博利珠单抗(n = 17,1 L 29 %)的 ORR 分别为 72.2% 和 70.6%,中位 PFS 超过 12 个月。对于帕博利珠单抗,中位随访 24.4 个月后未报告死亡。这些研究支持 cKS 1 L 治疗失败后使用 ICI,但缺乏 RWE 支持其使用。
最近一项小型研究报道了帕博利珠单抗治疗 HIV 相关 KS 的结局(n = 32),ORR 和 PFS 结果令人印象深刻,分别为 62.1% 和 28.2 个月。报道了一例多克隆 B 细胞淋巴增生导致的治疗产生的死亡。其他几项试验正在探索 ICI 用于 HIV 相关 KS,包括多塔利单抗(抗 PD-1)加抗逆转录病毒疗法(NCT05646082)和纳武利尤单抗加多激酶抑制剂卡博替尼(NCT04514484)。重要的是,最近一项多中心分析显示,感染和未感染 HIV 的癌症患者的 ICI 活性和安全性相似。
三项开放标签试验报道了 ICI 在化疗难治性晚期皮肤血管肉瘤(cAS)中的活性(表 1)。帕博利珠单抗联合病灶内 talimogene laherparepvec(T-VEC,一种溶瘤单纯疱疹病毒1型)用于紫杉烷经治 cAS(n = 8),观察到高 ORR(71.7%)和长 PFS(中位 12.4 个月)。类似地,在另一项针对血管肉瘤的研究(n = 16)中观察到伊匹木单抗/纳武利尤单抗的中等活性,cAS 亚组(n = 9)的 ORR 为 44.4%(CR 11.1%)。最后,纳武利尤单抗和卡博替尼联合治疗 cAS(n = 12)的 ORR 为 58%,PFS 和 OS 数据尚未报道。尽管支持其使用的 RWE 有限,但可考虑将 ICI 用于化疗失败后的 cAS 患者。
皮肤淋巴瘤
小型单臂试验显示,ICI 在复发/难治性(R/R)皮肤 T 细胞淋巴瘤(CTCL)中的活性中等(表 1)。ORR 范围从阿替利珠单抗的 17.6% 到帕博利珠单抗的 37.5%。帕博利珠单抗联合干扰素-γ-1b 治疗 R/R CTCL(n = 16)的 2 期试验在同行评审发表之前报告了结局(NCT03063632)。ORR 为 37.5 %,中位缓解持续时间为 16.1 个月,中位 PFS 为 13.0 个月。然而,关于 ICI 对皮肤淋巴瘤患者的疗效和安全性的 RWE 很少,需要进一步评估。
多项试验正在探索 PD-1 抑制剂与已确立的淋巴瘤疗法联合使用。包括 PD-1 抑制剂信迪利单抗加组蛋白脱乙酰酶抑制剂西达本胺(NCT04296786);或帕博利珠单抗加 CC 趋化因子受体-4 抑制剂莫格利珠单抗(NCT05956041)。一项 2 期 RCT 正在比较度伐利尤单抗联合或不联合来那度胺治疗 R/R CTCL(NCT03011814)。度伐利尤单抗联合来那度胺的 1 期研究(n = 9)报告 ORR为 67%,令人印象深刻,中位缓解持续时间为 4 个月。
未来方向
表 3 提供了 ICI 治疗晚期皮肤恶性肿瘤的循证总结,包括特定 ICI 推荐及其证据强度。

表3
ICI 用于罕见皮肤恶性肿瘤的支持性证据主要来自病例报告和小型系列研究。有篮子试验(对多种肿瘤类型进行相同干预的治疗试验)正在探索 ICI 用于多种皮肤癌组织学亚型。包括一项 2 期篮子试验正在评估 T-VEC 联合纳武利尤单抗治疗晚期 cSCC、CTCL、MCC、BCC 以及更罕见的皮肤癌,如乳房外Paget病、腺样囊性癌和皮脂腺癌等(NCT02978625)。将罕见皮肤癌患者纳入此类包括多种肿瘤类型的试验可能产生监管部门批准所需的更有力的证据,应首先考虑。
预测皮肤癌 ICI 疗效的生物标志物相关研究规模较小,未得到充分验证,不足以用于常规临床实践(表 4)。值得注意的是,在其他癌症中与 ICI 更大临床获益相关的肿瘤突变负荷(TMB)和 PD-L1 表达,在皮肤肿瘤中不能预测(表 2)。可靠的生物标志物有助于为治疗选择提供信息,包括强化或降级。例如,原发性肿瘤组织的基因表达谱可以预测 cSCC 的转移复发风险,将其纳入辅助 ICI 试验可能提示哪些患者将从术后治疗中获益最大,如在 II 期黑色素瘤中评估的那样。
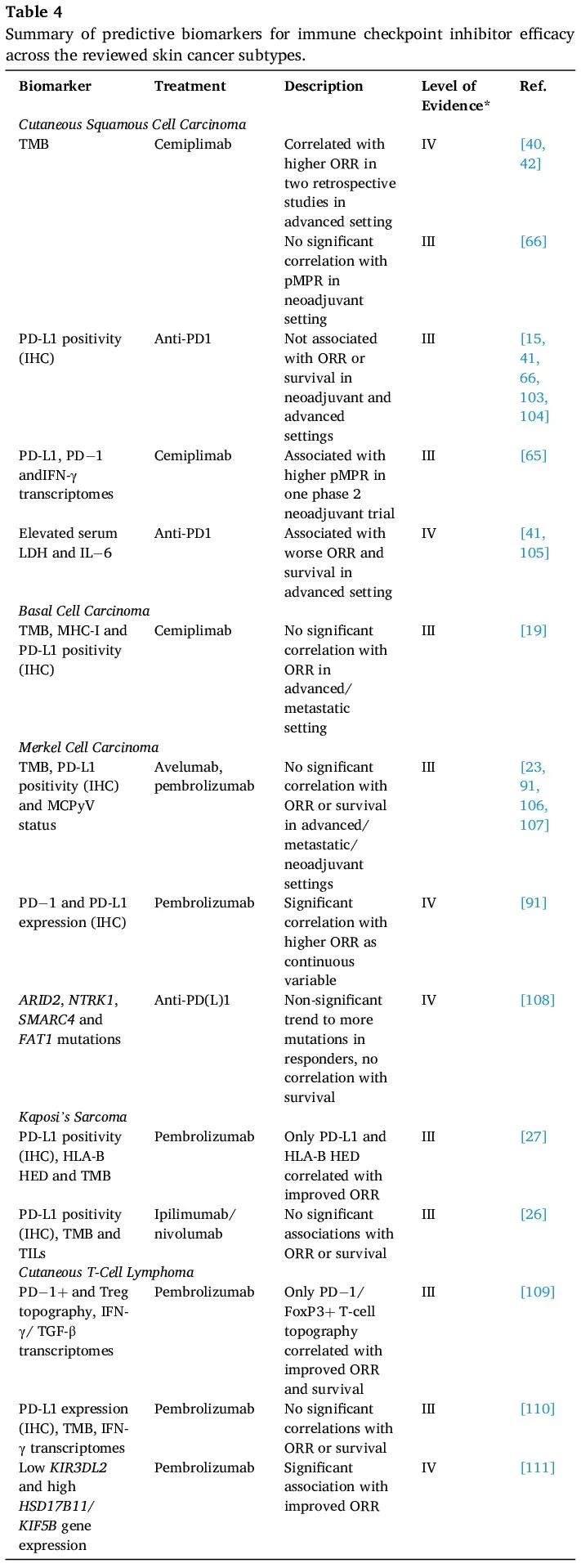
表4
类似地,提示对 ICI 无反应的生物标志物可能鼓励联合方法,如在肺癌中的研究。最后,血清生物标志物,包括循环肿瘤 DNA,可能支持临床和影像学因素评估治疗反应,使辅助和晚期治疗合理化,如在黑色素瘤中探索的那样。
其他值得进一步研究的领域包括缓解患者的治疗合理化策略(包括 ICI 停止后缓解的持久性);纳入罕见皮肤恶性肿瘤和被临床试验排除的合并症(包括血液系统恶性肿瘤、器官移植或 HIV 等)患者的改进 RWE;以及联合方法,包括病灶内药物、化疗或放疗。
图 2 概括了 ICI 治疗晚期皮肤恶性肿瘤的临床试验。
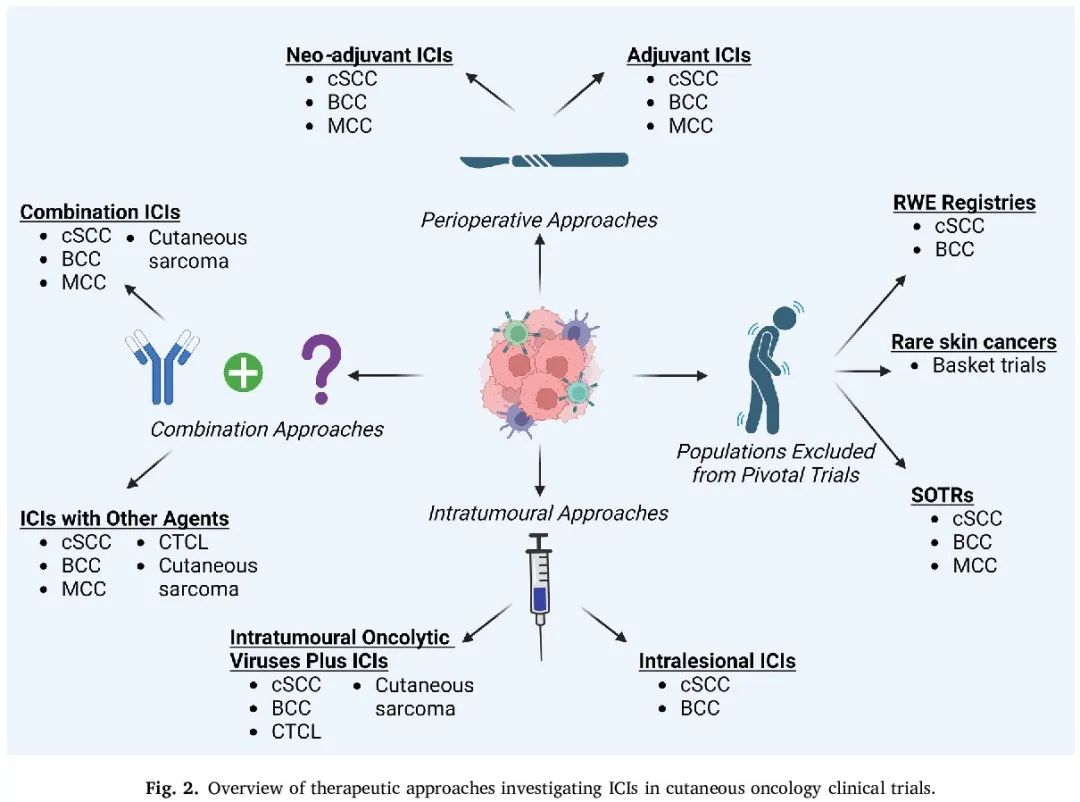
图2
总 结
总之,ICI 已被确立为晚期 cSCC 和 MCC 的推荐一线治疗,并且证据可能支持其用于 1 L 治疗失败的 BCC、皮肤肉瘤和 CTCL 患者的后续治疗。正在进行的用于更早期疾病的试验可能会扩大其获批的适应症,因此管理皮肤恶性肿瘤的临床医生的熟悉程度对于促进适当的治疗和/或患者转诊至关重要。为此,肿瘤学家、皮肤科医生和转化科学家之间的合作至关重要。
参考文献:
Pham JP, Staeger R, Joshua AM, Liu J, da Silva IP, Dummer R, Goldinger SM. An updated review of immune checkpoint inhibitors in cutaneous oncology: Beyond melanoma. Eur J Cancer. 2024 Nov 16;214:115121. doi: 10.1016/j.ejca.2024.115121. Epub ahead of print. PMID: 39580882.
