导读
酒精相关性肝病(Alcohol-associated Liver Disease, ALD)是由酒精摄入引发的一系列肝脏疾病的总称,涵盖从单纯性肝脂肪变性到酒精性肝炎、酒精相关性肝硬化,甚至肝细胞癌。近年来,ALD的发病率和严重性持续上升,不仅威胁患者健康,也加重了全球医疗负担。因此,深入研究其复杂发病机制及潜在治疗策略具有重要意义。
近期,美国印第安纳大学的Suthat Liangpunsakul和Jing Ma教授团队在eGastroenterology期刊发表题为“Cell-to-cell and organ-to-organ crosstalk in the pathogenesis of alcohol-associated liver disease”的综述文章,该文章聚焦ALD的发病机制,从细胞间和器官间的相互作用入手,阐释了疾病发展的复杂性,为进一步研究和治疗提供了新思路。
传统观点认为酒精对肝细胞的直接毒性是ALD的主要原因。然而,研究表明,酒精代谢引发的肝损伤涉及多种细胞类型及其相互作用(见图1)。
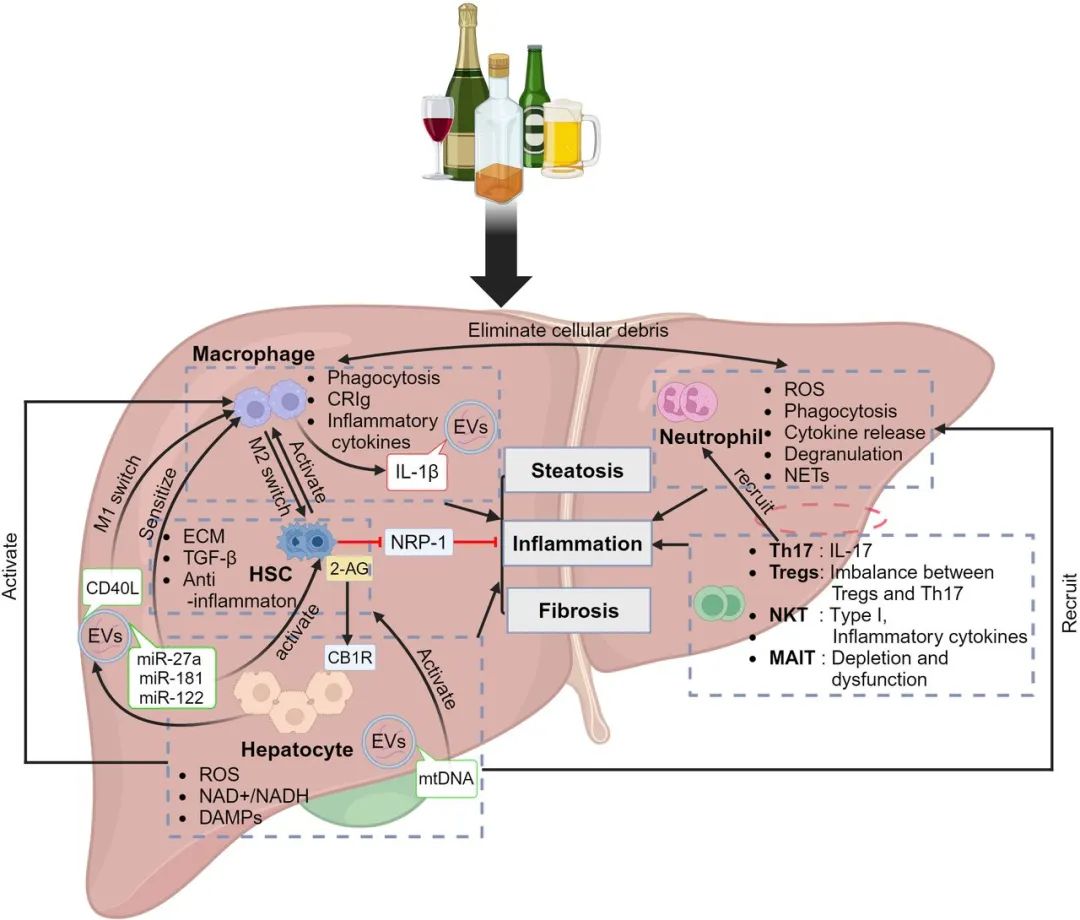
图1. ALD中的细胞间相互作用
来源:原文图1
肝内细胞间的相互作用
1.肝细胞的酒精代谢作用
酒精主要在肝细胞中代谢,关键酶如乙醇脱氢酶(ADH1)、细胞色素P450 2E1(CYP2E1)、过氧化氢酶和乙醛脱氢酶(ALDH2)将酒精转化为乙醛,再进一步转化为乙酸。这一过程中不仅会产生活性氧(ROS)和乙醛,引发氧化应激、细胞损伤、炎症反应和纤维化,还会通过降低NAD+/NADH比值、损害线粒体的脂肪酸氧化功能等途径诱发肝脂肪变性。酒精代谢过程中释放的ROS还会促进肝细胞分泌高动力组蛋白(HMGB1)和线粒体DNA等损伤相关分子模式(DAMPs),从而启动肝脏炎症并募集免疫细胞至病变部位。此外,酒精摄入会抑制肝细胞miR-148a表达,而恢复miR-148a水平可逆转酒精诱导的肝脏脂肪变性及炎症。在严重酒精性肝炎(AH)病例中,肝细胞会去分化,呈现胆管细胞表型,与更差的临床预后相关。
2.肝窦内皮细胞(LSECs)
肝窦内皮细胞通过维持血流与肝细胞间的物质交换以及调节免疫与代谢来维持肝稳态。在ALD中,LSECs功能失调导致窦状毛细血管化,破坏细胞间交流,从而加重纤维化。通过干预CYP2E1活性或调节HSP90乙酰化,可能改善LSECs功能,进而减轻酒精相关肝损伤。LSECs中的硫氧还蛋白相互作用蛋白(TXNIP)在酒精性肝损伤中发挥着重要作用。LSECs还通过与肝细胞、肝星状细胞、巨噬细胞乃至骨髓前体细胞等相互作用,影响ALD的发生发展。
3.巨噬细胞的双重作用
肝内巨噬细胞包括库普弗细胞(KCs)和单核细胞来源的巨噬细胞。肝内巨噬细胞可向M1型(促炎型)和M2型(抑炎型)转化。M1型巨噬细胞主要通过分泌促炎细胞因子及趋化因子等促进肝脏炎症,而M2型巨噬细胞主要通过分泌抑炎介质、募集调节性T细胞等抑制炎症并促进组织再生和修复。如何平衡这些巨噬细胞的 “炎性”与“修复性”角色,是未来治疗ALD的重要方向。免疫球蛋白超家族补体受体(CRIg)主要在巨噬细胞中表达,其通过帮助清除易位的病原体来维持肝脏健康。然而,在ALD患者和小鼠ALD模型中,CRIg的表达均下降,导致病原体清除功能受损及持续性肝脏炎症。因此,CRIg也是治疗ALD的一个极具潜力的靶点。
4.中性粒细胞的炎症作用
中性粒细胞通过生成ROS、分泌细胞因子、脱颗粒及形成NETs等方式发挥防御作用,清除病原体。在ALD中,肝内实质细胞和非实质细胞以及DAMPs、病原相关分子模式(PAMPs)相互作用,促进中性粒细胞的激活并在肝脏聚集,加重炎症。此外,中性粒细胞通过促进巨噬细胞向M2型转化来调节炎症、促进组织修复,还可以通过产生肝细胞生长因子促进肝再生与修复。miR-223在中性粒细胞中高表达,其缺失会加重ALD小鼠的肝损伤和炎症;而AH患者中IL-8阳性中性粒细胞显著升高,提示调节miR-223或IL-8通路可能有助于减轻炎症反应。
5.肝星状细胞(HSCs)
在正常情况下,HSCs保持静息状态,通过储存视黄醇并平衡细胞外基质的生成和降解,从而防止肝纤维化的发生。然而,酒精暴露会激活HSCs,使其转化为肌成纤维细胞并分泌细胞外基质,进而引发纤维化。近期研究表明,酒精通过促使肝细胞释放谷氨酸,进一步刺激HSCs产生2-花生四烯酰甘油。该分子与肝细胞上的大麻素受体1结合,促进脂肪生成和甘油三酯合成,加重脂肪变性。此外,HSCs还通过神经源性蛋白-1信号通路调控酒精引起的肝脏炎症及脂肪变性。
6. T细胞的免疫调控
T细胞在ALD中通过清除受损肝细胞、释放细胞因子来协调肝脏炎症和修复。Th17细胞及IL-17促进炎症扩散,而调节性T细胞(Tregs)则通过抑制免疫激活并促进组织修复发挥作用。1型NKT细胞发挥促炎作用,而2型NKT细胞抑制炎症。黏膜相关不变T细胞(MAIT细胞)在肝细胞中高表达,在调控肠道菌群、应对细胞感染和调节炎症方面发挥重要作用。在ALD中,MAIT细胞的耗竭和功能障碍会加重疾病的进展。这表明,免疫细胞群体间的平衡在ALD发病机制中存在复杂的相互作用。恢复免疫细胞的正常功能及水平,或调控免疫细胞间的平衡,可能成为治疗ALD的潜在策略。
关键介质作用
在这些细胞之间,细胞因子、细胞外囊泡(EVs)和炎症小体(inflammasomes)等分子发挥了重要的通讯作用。
1. 细胞因子的作用
细胞因子是ALD发病机制中的核心因素,尤其在推动炎症反应和加剧肝损伤方面发挥重要作用。慢性饮酒会引起肝脏应激和炎症,进而释放出多种细胞因子,如肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)和转化生长因子β(TGF-β)。这些因子在酒精性肝病的不同病理过程中起着不同的作用。
-
TNF-α是一个重要的促炎细胞因子,通过促进炎症、氧化应激和细胞坏死加重肝脏损伤。尽管TNF-α阻断曾在临床研究中显示出初步的治疗潜力,但由于其与感染风险增加和死亡率升高相关,因此未能成为有效的治疗方法。
-
TGF-β在ALD中的作用尤为复杂。它不仅促进肝纤维化,还通过抑制降解细胞外基质的酶,进一步加重纤维化进程。另外,TGF-β在减轻炎症和促进组织修复方面也具有保护作用,因此在治疗酒精性肝病时,如何平衡TGF-β的双重作用仍是一个挑战。
-
IL-6具有双重角色。在某些情况下,IL-6的缺失会加剧肝损伤,提示它在某种程度上具有保护作用,但它也能通过激活STAT3通路来促进酒精引起的肝损伤和炎症。
-
IL-17在ALD中的作用也不容忽视,它通过募集中性粒细胞到肝脏而加重炎症,并与其他促炎因子协同作用,促进肝细胞癌(HCC)的发生。
-
IL-22主要发挥保护作用,促进肝细胞的存活和肝脏再生,是防止酒精性肝损伤的潜在治疗靶点。
-
IL-10是一种抗炎细胞因子,有助于调节肝脏内的炎症反应,它的缺乏通常会导致酒精摄入后炎症反应的加剧。
-
此外,趋化因子如CCL20,特别是在急性AH患者中显著上升,能够募集免疫细胞(如中性粒细胞)到炎症部位,进一步加剧肝脏损伤。
综上所述,细胞因子的作用往往是复杂的,单纯补充或阻断某些因子可能无法达到预期效果,甚至可能引发严重副作用。因此,未来的研究需要深入探讨如何平衡这些因子的作用以优化治疗效果。
2. 细胞外囊泡(EVs)的跨细胞作用
EVs是一类小型、非复制性的、由膜包裹的颗粒,几乎所有的细胞类型都会释放EVs。EVs内囊括蛋白质、RNA(如miRNA和长非编码RNA)、脂质甚至DNA片段等生物活性物质,被认为是细胞间通讯的复杂介质。研究表明,酒精暴露会导致血液中EVs的水平升高,并改变其内容物,并通过多种机制加剧肝脏炎症和损伤。例如,酒精暴露小鼠的EVs可增加未暴露肝细胞中MCP-1的表达,促进肝脏炎症。酒精暴露的小鼠释放的EVs富含线粒体DNA(mtDNA),通过募集中性粒细胞加重肝损伤。除了mtDNA外,酒精暴露肝细胞释放的EVs富含CD40L,可诱导巨噬细胞M1极化,增加TNF-α、IL-1β和IL-6等促炎因子的表达。此外,酒精暴露的肝细胞分泌的富含miR-122的EVs会使巨噬细胞对LPS更加敏感,进一步增强促炎反应。
3. 炎症小体的作用
炎症小体是细胞内的多蛋白复合物,可识别PAMPs和DAMPs,触发促炎性细胞因子(如IL-1β和IL-18)的活化和释放,同时引发炎性程序性细胞死亡(焦亡)。在ALD中,NLRP3炎症小体是研究最深入的类型,由NLRP3感受器、凋亡小体斑点蛋白 (ASC)和前体胱天蛋白酶-1(pro-caspase-1)组成。研究表明,急性酒精性肝炎(AH)患者的IL-1β水平升高,而缺乏NLRP3的小鼠在长期酒精暴露下肝损伤减轻。此外,IL-1β通过促进免疫细胞募集和阻碍肝脏再生加剧损伤,而IL-18通过增加肠道上皮粘膜通透性加重肝脏的炎症。
肝脏之外:肠道与脂肪组织的协同影响
文章进一步指出,肝脏之外的器官也在ALD的发病中扮演了重要角色。尤其是肝-肠轴和肝-脂肪轴(见图2),其功能紊乱显著促进了疾病进展。
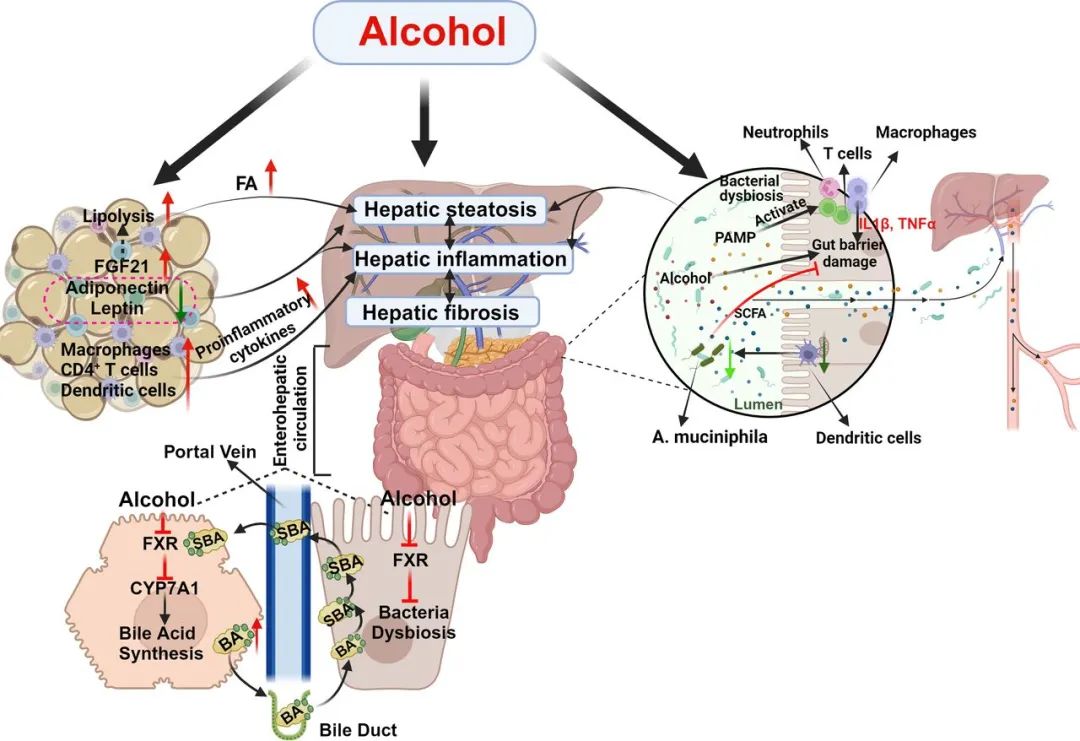
图2:ALD中的器官间相互作用
来源:原文图2
1. 肝-肠轴:肠道健康对肝脏的双刃剑
肝-肠轴是维持健康的重要互动机制,酒精摄入会破坏肠道屏障功能,增加肠道通透性,使微生物产物如脂多糖(LPS)进入门静脉,从而激发肝脏炎症并损伤肝脏。ALD患者短链脂肪酸(SCFAs)水平下降,与肠道屏障功能受损密切相关;同时,肠道菌群失调,益生菌(如阿克曼菌)显著减少,进一步加剧ALD的进展。此外,酒精还改变了肠道免疫细胞(如树突状细胞、固有淋巴细胞、MAIT细胞和γδ T细胞)的分布和功能,增加全身性炎症风险。因此,修复肠道屏障、恢复菌群平衡和增强肠道免疫功能,对于控制ALD进程至关重要,也为ALD的治疗提供了潜在的新方向。
2. 肝-脂肪轴:脂肪组织的“幕后推动力”
脂肪组织,尤其是白色脂肪组织(WAT),在能量平衡和脂质代谢中扮演重要角色。酒精暴露会破坏脂解与产热的平衡,导致脂解增强,大量游离脂肪酸释放进入血液,引发肝脂肪变性,并通过促炎因子加重肝脏炎症反应,推动ALD进展。脂肪组织分泌脂联素和瘦素等脂肪因子对免疫、炎症和代谢具有调控作用。脂联素通过激活SIRT1和AMPK信号减轻肝损伤,但酒精暴露会降低其水平,导致脂肪堆积、氧化应激和炎症恶化;同时,瘦素水平下降引发能量代谢失衡,进一步加重ALD。此外,酒精暴露引起细胞因子水平显著变化,导致免疫细胞向脂肪组织浸润,进一步加重肝脏炎症。这些现象表明,脂肪组织与肝脏的相互作用在ALD的发病机制中发挥着重要作用。肝脏和脂肪组织之间的相互作用对ALD的进展具有深远影响。因此,调节脂肪代谢失衡被视为潜在的治疗方向。
总结与展望
ALD是一个多维度、复杂的疾病,其发病机制涉及细胞间及器官间的广泛相互作用。深入研究肝内细胞及肝-肝外器官轴的相互作用,不仅有助于揭示疾病的病理过程,也为开发更精准的治疗策略提供依据。未来,整合分子机制与临床研究将有助于更好地应对这一全球健康挑战。
引证本文
Hui Gao, Yanchao Jiang, Ge Zeng, Nazmul Huda, Themis Thoudam, Zhihong Yang, Suthat Liangpunsakul, Jing Ma - Cell-to-cell and organ-to-organ crosstalk in the pathogenesis of alcohol-associated liver disease: eGastroenterology 2024;2:e100104.
https://doi.org/10.1136/egastro-2024-100104