肿瘤细胞异常的能量和物质代谢途径通过劫持非恶性细胞的营养成分,支持肿瘤细胞增殖,从而建立有利于肿瘤进展的代谢路径。肿瘤细胞的这种适应性代谢进一步调节免疫景观,最终形成以耐药性和免疫抑制为特征的肿瘤微环境。协同调控能量和物质代谢的途径可能是一种很好的抗肿瘤治疗范式。然而,由于代谢的相似性,选择性调节肿瘤细胞的异常代谢而不影响其他细胞的功能至关重要。小分子药物能够靶向多种生物分子进行抗肿瘤治疗,但会产生毒副作用。纳米药物递送系统可以改善其特性并负载多种药物,从而发挥协同抗肿瘤作用。
2024年12月12日,复旦大学/福建医科大学蒋晨唯一通讯在 ACS Nano 在线发表题为 “Metabolic Nanoregulators Induce Ferroptosis and Change Metabolite Flow to Reverse Immunosuppressive Tumor Microenvironment” 的研究论文。该研究开发了一种药物偶联多分支聚合物的双药物共递送系统,通过开发安全有效的抗肿瘤治疗途径来调节肿瘤细胞代谢。
纳米颗粒同时递送阿达帕林(adapalene)和艾拉斯汀(erastin),调节肿瘤细胞的物质和能量代谢,实现了肿瘤组织靶向和反应性药物释放,改变了肿瘤细胞内的代谢物流动,并有效杀死肿瘤细胞。此外,纳米颗粒可以逆转肿瘤免疫抑制微环境,从单细胞调节到全病灶控制。

恶性细胞具备代谢适应性,促进能量和物质的利用以支持不受控生长,同时也调节肿瘤微环境(TME)的免疫景观。由于与肿瘤细胞的营养竞争或免疫抑制代谢物的作用,对肿瘤细胞表现出代谢拮抗作用的抗肿瘤免疫群体(如CTLs和Teff)失活,与肿瘤细胞表现出代谢共生关系的免疫抑制细胞(如Tregs)通过代谢互补支持肿瘤细胞增殖,最终形成耐药性和免疫抑制性TME。调节TME的代谢流是一种有效的抗肿瘤疗法。然而,许多代谢调节药物缺乏细胞靶向能力,可能会诱导不良治疗效果。因此,提高药物特异性对于实现安全有效的抗肿瘤治疗至关重要。
肿瘤细胞的代谢重编程导致肿瘤微环境产生偏好性物质代谢流动。代谢重编程有两个关键特征:一是生物能量转移,称为“Warburg效应”,指能量供应从氧化磷酸化转变为糖酵解,使线粒体能够更快地为肿瘤细胞提供能量。二是谷氨酰胺分解代谢增加,产生α-KG、氨基酸和NADPH等物质,以满足肿瘤细胞不受控生长的需求。抗肿瘤治疗需要同时调节肿瘤细胞中异常的能量和物质代谢。铁死亡是一种可控的细胞死亡模式,直接破坏线粒体功能和能量代谢,对其他形式细胞死亡具有抗性的肿瘤细胞仍对铁死亡敏感。然而,大多数的铁死亡诱导剂虽在体外显示出对肿瘤细胞的显著细胞毒作用,但仅对免疫缺陷小鼠模型显示出抗肿瘤效果,可能归因于铁死亡对免疫细胞的不良影响。最近的一项研究表明,胱氨酸的耗竭在胰腺荷瘤小鼠模型中诱导铁死亡,表明胱氨酸耗竭诱导的铁死亡避免了对免疫细胞的毒性。仅调节线粒体能量代谢不足以控制TME中的代谢物流动,迫切需要结合其他代谢调节剂。谷氨酸草酰乙酸转氨酶1(GOT1)在调节多种氨基酸代谢途径中起关键作用,尤其是与肿瘤免疫密切相关的谷氨酰胺代谢。GOT1在非恶性细胞中可有可无,但对于维持肿瘤细胞中的物质供应至关重要。然而,有研究观察到线粒体电子传递链和GOT1抑制之间的合成致死关系,表明GOT1抑制可以激活线粒体相关的代谢途径以维持细胞活性。在特异性敲除GOT1的细胞中筛选靶向代谢抑制剂文库后发现,铁死亡相关通路的激活对于杀死肿瘤细胞至关重要。因此,将胱氨酸耗竭诱导铁死亡和GOT1活性抑制相结合是合成致死代谢调节的有效方法。
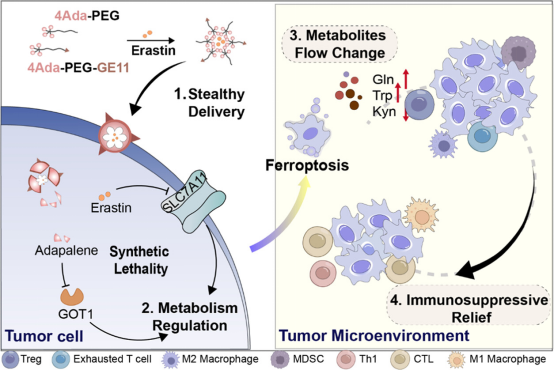
图1 G-PA4/E纳米颗粒调节肿瘤代谢示意图(摘自ACS Nano)
小分子抑制剂的物理化学性质会影响药物的生物利用度、溶解度和药代动力学,限制了其临床应用。药物递送不仅改善了小分子抑制剂的体内动力学,还能够同时递送多种药物。该研究选择了抑制肿瘤细胞中胱氨酸摄取的erastin和抑制GOT1酶活性的adapalene作为肿瘤细胞代谢重编程的调节剂。两种药物的组合可以干扰肿瘤细胞中的氧化还原代谢、氨基酸代谢和线粒体代谢等多种代谢途径。同时,两种药物的协同递送对于将化疗效果最大化至关重要。该研究利用adapalene的化学结构特征,通过刺激响应性化学键将其掺入递送系统,从而实现两种药物共递送系统的按需、按比例制备,避免了药物的竞争性负载。通过肿瘤靶向肽修饰,进一步提高系统对肿瘤细胞的合成致死性,最终精确调控TME内的代谢物流动,从而逆转免疫抑制,实现安全有效的抗肿瘤治疗。
参考消息:
https://pubs.acs.org/doi/10.1021/acsnano.4c13425