近日,在临床和转化医学领域开放获取期刊Clinical and Translational Medicine(当前影响因子10.6)发表了题为《Elucidating epigenetic landscape of gastric premalignant lesions through genome-wide mapping of 5-hydroxymethylcytosines: A 12-year median follow-up study》的论文。研究首次探索了胃癌前病变中的5hmC分子机制,提示了其向胃腺癌转变的相关途径,以及利用全基因组5hmC图谱评估未来癌症进展风险的可行性。同时,研究团队开发了一种基于5hmC的表观遗传模型,以预测癌症进展。该研究由复旦大学华山医院刘杰主任、骆菲菲研究员团队,美国西北大学张玮教授团队,美国芝加哥大学何川院士团队和柏锘(上海)医疗科技有限公司等合作完成。

胃癌是全球面临的一项重大公共卫生挑战。在东亚,尤其是中国,胃癌发病率最高,其中主要是腺癌类型(90%-95%),占全球病例的40%以上。胃腺癌的前体病变,包括胃萎缩、肠上皮化生和异生,都有进展为胃腺癌的较大风险。目前临床上通常使用胃镜结合活检组织学来评估癌前病变的严重程度,但对早期胃腺癌的预测准确率仍有待进一步提高。
胃癌的演变发展是一个复杂的过程,受到多种遗传和非遗传因素之间错综复杂的相互作用影响,其中表观遗传因素,包括胞嘧啶修饰、组蛋白修饰和非编码RNA等。了解胃癌前病变的表观遗传状况,可以提高对其转变为胃癌机制的理解,并有助于确定新的治疗/干预靶点以及诊断/预测生物标志物。先前的研究表明,启动子区域CpG岛的甲基化状态在胃腺癌的发展中起着至关重要的作用。肿瘤抑制基因启动子区域的高甲基化通常与基因表达下调有关,进而导致肿瘤的发生和发展。但此前的大多数研究受到表观遗传分析技术的限制,难以区分5-甲基胞嘧啶(5mC)和5-羟甲基胞嘧啶(5hmC),前者含量更丰富,后者是5mC去甲基化之后的产物,具有稳定的生物化学性质,而且起着重要的基因调控作用。作为活性基因表达的标志物,5hmC可以影响转录因子结合和染色质的可及性,是表观遗传学领域的关键参与者,具备作为治疗靶点的潜力,但其在胃癌前病变转变为胃腺癌过程中具体如何发挥作用尚未确定。
此次发表的研究是目前为止开展的规模最大、持续时间最长的中国胃癌前病变人群纵向研究,纳入了2001年至2015年期间在复旦大学华山医院接受胃镜检查和活检的29,176名胃病患者,并随访至2022年8月1日。根据病理学划分,其中17948名患者有炎症,10391名患者有萎缩和/或肠化,837名患者有低度发育不良。胃癌病例由上海疾病控制中心(CDC)确定,随访期间总共报告了240例。随访时间中位数为12.2 年,总体胃癌发病率为0.82%。研究设计如图1所示。
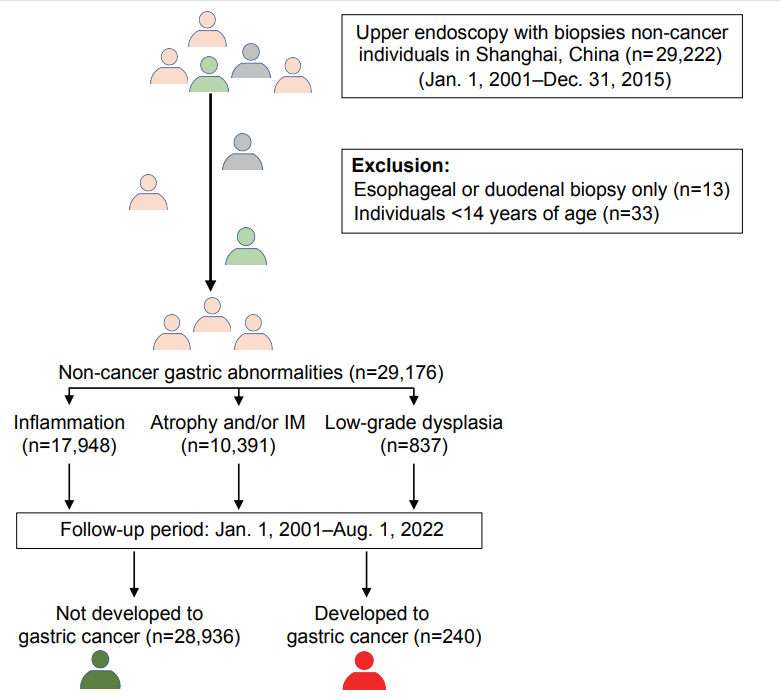
图1 研究设计图
单变量检验显示,癌症进展风险在癌前部位没有统计学上的显著差异,但性别、年龄和组织学变化的严重程度与癌症进展显著相关。总体而言,与男性患者相比,无论病变类型如何,女性患者的风险都有所降低(风险比[HR]=0.395,95%CI=0.304-0.513,p<0.001)。70岁以上(HR=6.088,95%CI=4.055-9.141,p<0.001)、60-69岁(HR=4.136,95%CI=2.772-6.171,p<0.001)和50-59岁(HR=1.886,95%CI=1.239-2.870,p=0.003)的人比50岁以下的人风险更高。此外,与单纯炎症相比,低度发育不良进展为胃癌的风险要高得多(HR=7.049,95%CI=4.705-10.563,p<0.001),而萎缩和/或肠化的风险平均比单纯炎症高1.99倍(95%CI=1.519-2.616,p<0.001)。综合考虑性别、年龄和癌前病变类型的多变量回归分析进一步证实了上述趋势(图2A)。
研究团队根据性别和年龄对研究人群进行分组,以调查不同性别和年龄组中与不同病理亚型相关的癌症风险。当按性别分组时,患有低度发育不良和萎缩和/或肠化的男性和女性患胃癌的风险明显高于仅患有炎症的人。按年龄段分组时,癌前胃病变的存在对50岁以下人群进展为胃癌的风险没有显著影响。然而,老年组患胃癌的风险显著升高,值得注意的是,患低度发育不良的个体在60-69岁年龄段表现出特别高的胃癌风险(图2B)。
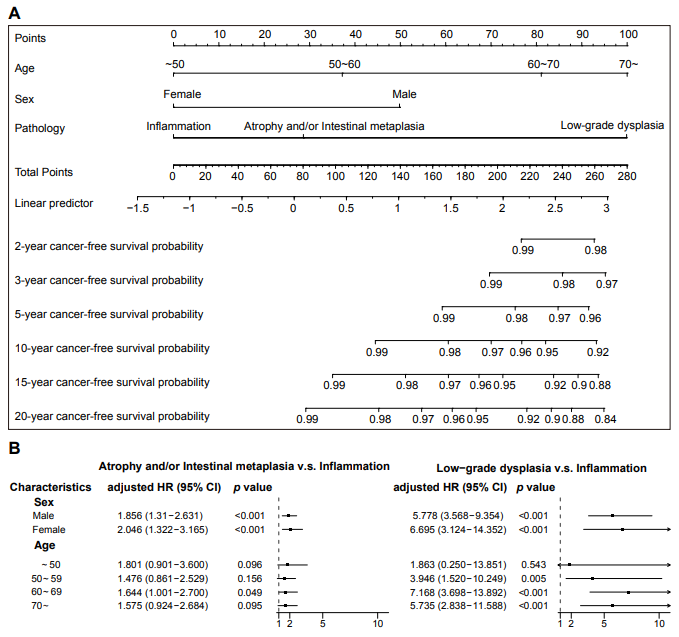
图2 不同年龄、性别及病变类型胃癌演变的风险比
在240例发展成了胃癌的活检样本中,25例为福尔马林固定石蜡包埋(FFPE) 生物样本。根据约1:2的病例对照比,研究团队随机匹配未进展为癌症且年龄、性别和活检时间与进展样本相似的样本作为对照。对DNA质量符合要求的69个样本进行了全基因组5hmC分析,包括21个“进展组”患者样本,48个经过至少18年随访后没有进展的“对照组”样本。69个样本中炎症患者32名,萎缩和/或肠化26名,低度发育不良11名。研究团队进一步分析了两组之间的差异性5hmC修饰,并构建了癌症进展的预测性多变量模型(图3)。
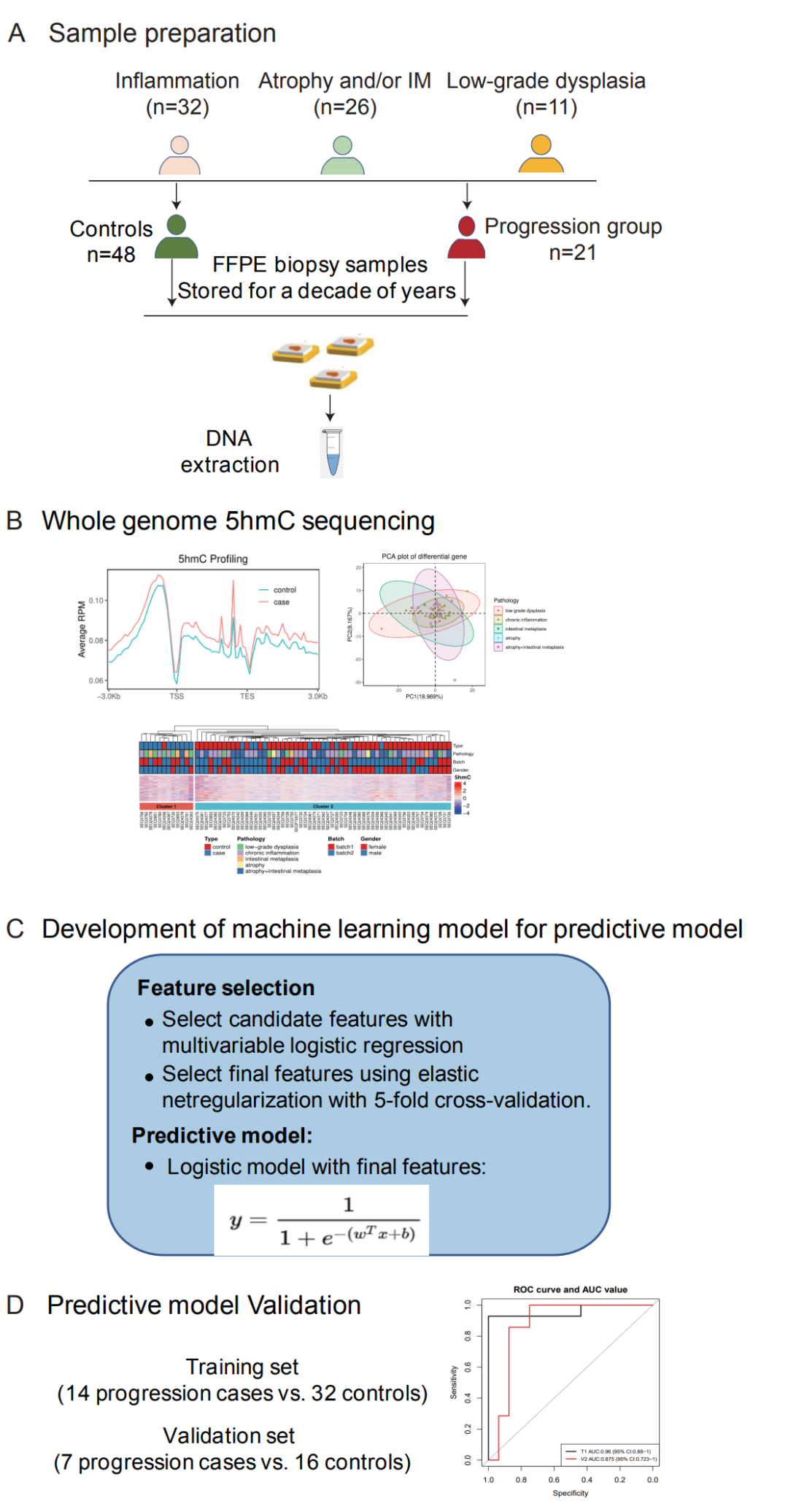
图3 5hmC检测实验及数据分析流程图
在进展组和对照组之间共鉴定出213个显著差异5hmC修饰的基因,这些差异基因与细胞分裂、细胞周期、能量代谢、炎症和肿瘤发生等途径和生物过程有关,包括G2M检查点、E2F靶点、炎症反应、p53途径、脂肪酸代谢和错配修复等。一些已知的癌基因在进展组中显示出更高的修饰水平,例如E2F5、GCNT3和B3GNT3,高度修饰的趋化因子CXCL6在文献报道中被认为与免疫微环境中的局部免疫抑制和促进肿瘤进展有关。这些差异5hmC修饰基因富集的KEGG通路包括粘蛋白型O-聚糖生物合成、TNF信号通路和PI3K−Akt信号通路等(图4)。
通过使用逻辑回归模型对候选基因应用弹性网络正则化,研究鉴定出9个基因(即GATA6、SLC4A3、CBARP、KCNS3、MUC5AC、CRACR2A、ZDHHC11B、ANKAR和SHANK3),其它五个重要因素,即性别、年龄、胃病变类型,以及性别、年龄和胃病变类型之间的风险比,也被添加到最终模型中。在训练集中(14例进展病例与32例对照组),该模型AUC为0.96,在验证集中(7例进展病例与16例对照组)AUC为0.88,在所有检查样本中,预测算法的灵敏度为90.5%(95%CI:68.1-98.3%),特异性为93.8%(95%CI:81.8-98.4%)。(图4)
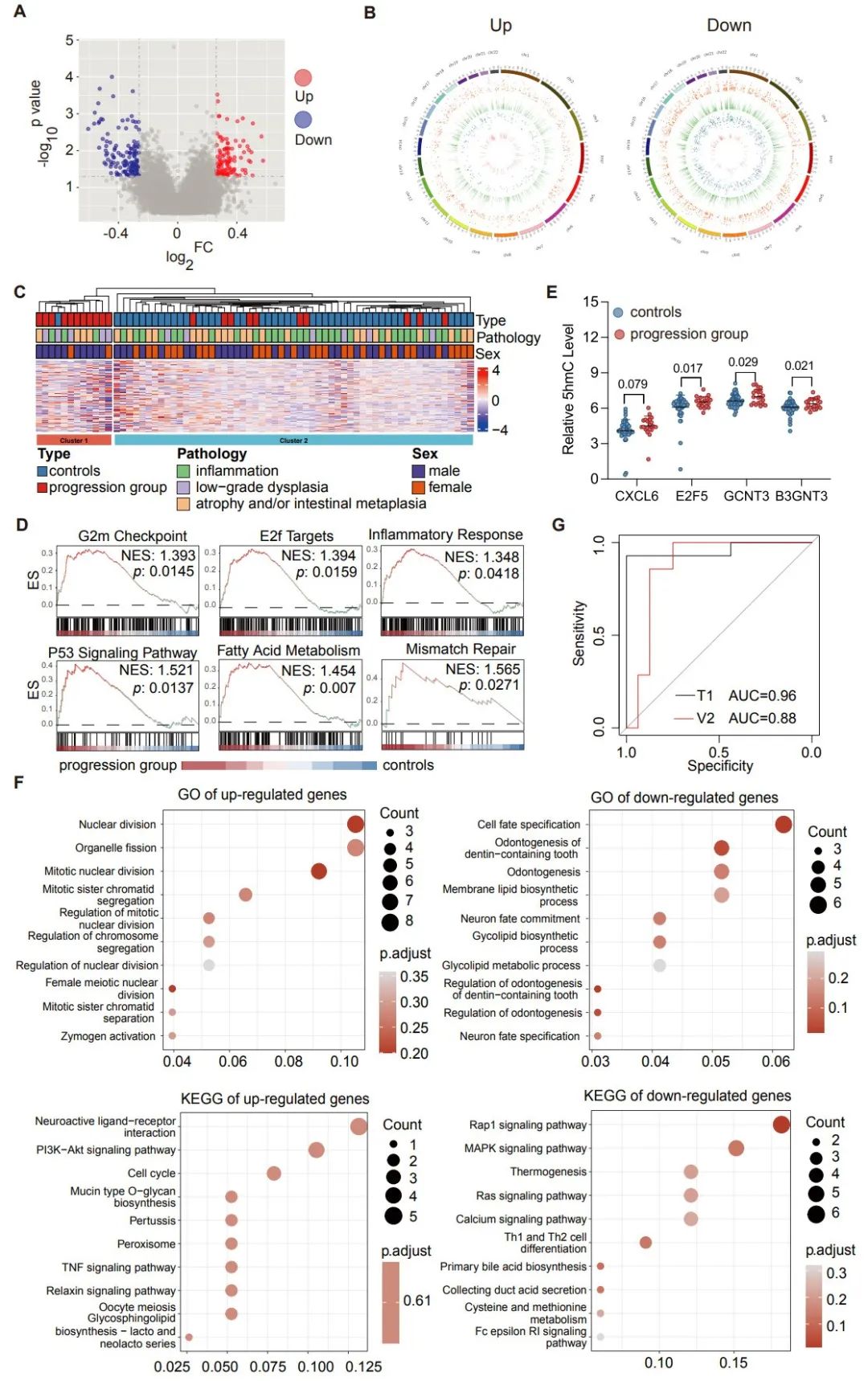
图4 差异基因的功能分析
考虑到不同胃病理类型的致癌过程存在差异,研究团队进一步研究了它们相关的5hmC特征。上述进行全基因组5hmC分析的69个样本中,32名个体患有炎症,26名患有萎缩和/或肠化,11名患者低度发育不良。全基因组5hmC谱显示,将萎缩和/或肠化和低度发育不良患者与炎性胃病变患者组进行单独比较(即萎缩和/或者肠化与炎症;低度发育不良与炎症),确定了萎缩、肠化和轻度发育不良患者特有的5hmC改变。232个基因在萎缩和/或肠化和炎症之间存在差异性修饰,功能富集于包括氮代谢和胰腺分泌等KEGG途径,这些途径与胃粘膜损伤、修复和癌前病变有关;823个基因在低度发育不良和炎症之间存在差异性修饰,富集的KEGG通路,如Wnt信号通路、调节干细胞多能性的信号通路等,这些代谢通路参与了细胞增殖、维持干细胞特性,和癌症密切相关(图5)。
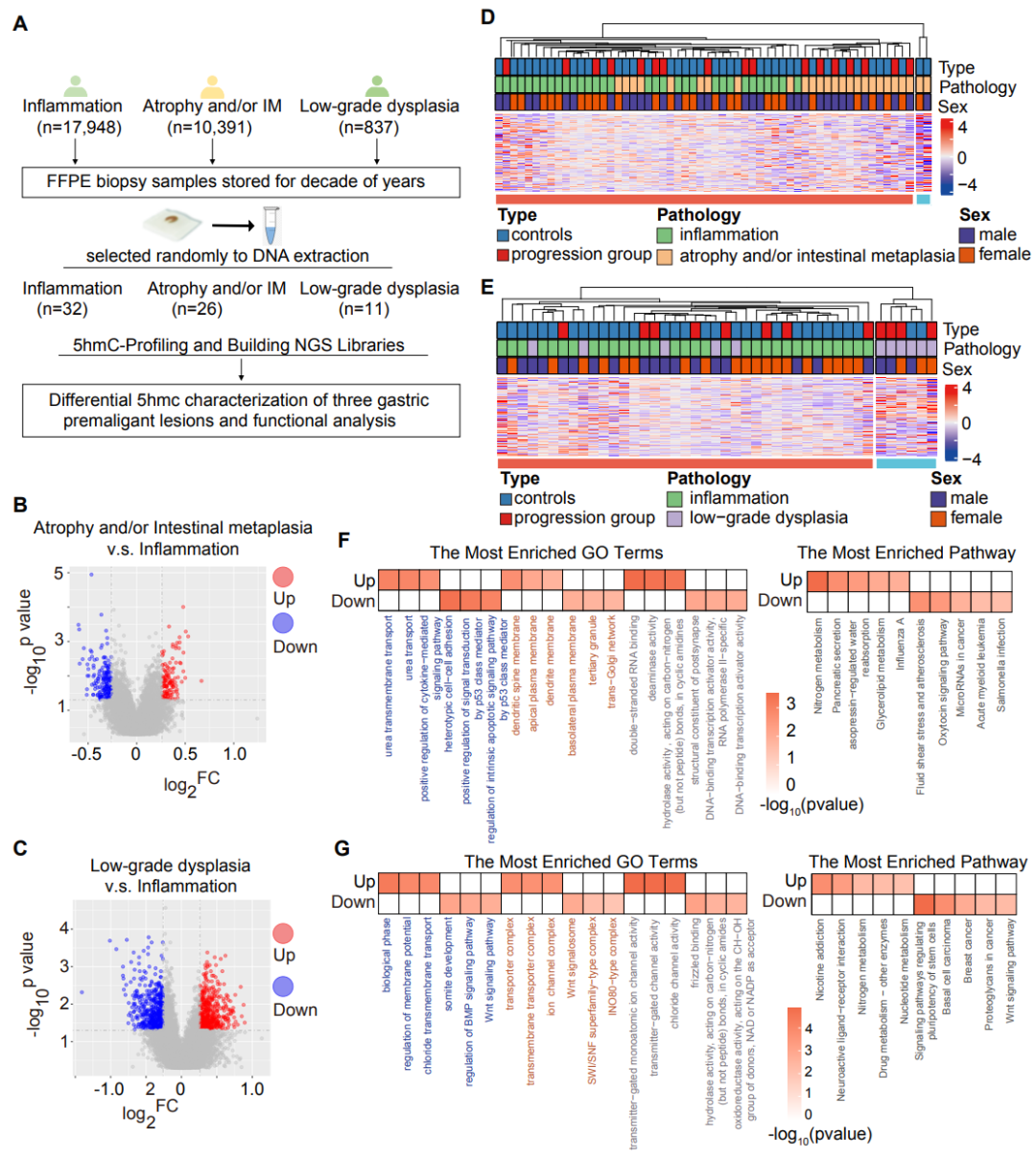
图5 不同胃病变类型的差异5hmC分析
虽然胃粘膜病变导致癌变的倾向已被广泛研究,但目前还没有有效的方法来准确预测胃癌发生的可能性或者识别高风险因素。该研究确定了与胃癌进展相关的差异5hmC特征,发现了213个差异修饰基因,主要集中在与细胞分裂、细胞周期、能量代谢、炎症和肿瘤发生相关的途径中。
此外,研究证明开发一个具有潜在高性能的预测表观遗传模型来区分进展和非进展患者是可行的。其中9基因模型在验证样本中,曲线下面积为87.5%(95%CI:72%-100%)。总体而言,该方法具有以下几个优点:(1)准确性高,对预测胃萎缩、肠上皮化生和发育不良等癌前病变最终进展为胃癌的可能性有较高的灵敏度和特异性。(2)操作简单,方便临床应用。(3)可以做到安全无创。
论文原文:
Zhongguang Luo, Wenshuai Li, Wanwei Zheng, Yixiang Shi, Maolin Ye, Xiangyu Guo, Kaiyi Fu, Changsheng Yan, Bowen Wang, Bin Lv, Shaocong Mo, Hongyang Zhang, Jun Zhang, Chuan H, Feifei Luo, Wei Zhang, Jie Liu. Elucidating epigenetic landscape of gastric premalignant lesions through genome-wide mapping of 5-hydroxymethylcytosines: A 12-year median follow-up study. Clin Transl Med. 2024 Dec;14(12):e70114. doi: 10.1002/ctm2.70114. PMID: 39625179; PMCID: PMC11613102.
原文链接:
https://onlinelibrary.wiley.com/doi/epdf/10.1002/ctm2.70114