近日,西安电子科技大学生命科学技术学院夏玉琼副教授基于天然酶催化级联在癌症治疗中的作用,开发了一种具有良好体内稳定性的酶传递纳米平台(GCI@RPCM),并实现了近红外光(NIR)触发的酶动力治疗(EDT)。该研究为乳腺癌强化治疗提供了一种高度稳定、NIR控制的智能给药系统,实现了酶动力治疗。这一成果发表在医学期刊《Materials Today Bio》(影响因子:8.7)上,题为“Highly stable and near-infrared responsive phase change materials for targeted enzyme delivery toward cancer therapy”,文章的第一通讯单位为西安电子科技大学,第一作者为西安电子科技大学生命科学技术学院副教授夏玉琼,通讯作者为西安电子科技大学生命科学技术学院夏玉琼副教授、张象涵副教授和天津大学生命科学学院祝诚副教授。
该研究开发了超稳定和NIR响应的PCMs(GCI@RPCMs)用于靶向酶递送癌症治疗。GCI@RPCMs由RGD配体修饰的PCMs作为肿瘤靶向和热响应载体,吲哚菁绿(ICG)作为近红外光热剂,葡萄糖氧化酶(GOx)和氯过氧化物酶(CPO)作为级联酶组成。示意图1展示了GCI@RPCMs的合成及静脉注射后在肿瘤部位的工作机制。这种设计允许药物在血液循环过程中37 °C时超稳定地封装级联酶,但在近红外照射下能够在肿瘤组织中快速释放,从而促进肿瘤特异性酶的递送,增强抗肿瘤功效并减少毒性。因此,该工作为EDT以及其他高效蛋白质治疗提供了一种超稳定的近红外光响应酶载体。
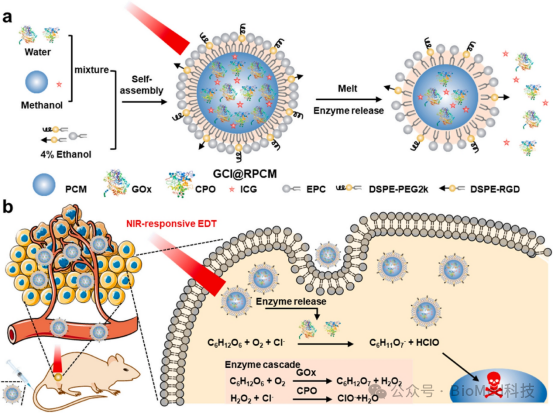
示意图1 高度稳定和近红外响应的相变材料的合成及工作机制示意图。
GCI@RPCMs采用纳米沉淀法制备。在779 nm处最大吸收的近红外吸收曲线证实ICG包封成功。进一步的分子动力学模拟证明GOx和CPO对PCMs均表现出较强的亲和力,酶在PCMs中分散良好(图1e)。进一步计算表明,CPO和GOx与PCM的主要相互作用是范德华能(图1f)。范德华相互作用调节了疏水效应,验证了关于GOx/CPO可以通过疏水相互作用与PCMs结合的假设。PCMs与CPO的总结合能为−166.4 kJ/mol, PCMs与GOx的总结合能为−364.4 kJ/mol(图1g),表明PCMs与酶之间存在较强的相互作用,其中GOx与PCM NPs的结合作用更强。GOx/CPO与PCM的强结合确保了它们在GCI@RPCMs内的稳定封装。
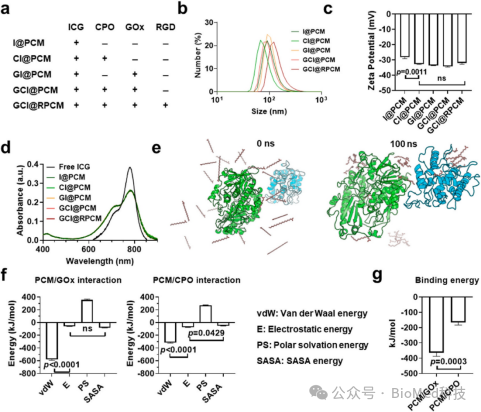
图1. GCI@RPCMs的结构表征
接下来作者评估了NIR触发的酶释放行为。TEM显示,经过NIR处理后,GCI@RPCMs的尺寸缩小了约60%(图2a)。光热曲线显示GCI@RPCMs表现出浓度依赖性和激光功率依赖性的光热行为。10 min时酶释放率达到41%(图2c)。在没有辐照的情况下,FITC-GCI@RPCMs保持超稳定,PCMs的“OFF-ON”释放模式显示了PCMs的高稳定性和NIR响应。在25 °C或37 °C时酶稳定地封装在GC@PCM中(图2f,g)。在45 °C时,GC@PCMs中的酶可以被释放。结果表明,GC@PCMs具有优异的热响应酶活性(图2h,i)。这些结果表明GCI@RPCMs是超稳定和NIR响应的酶递送系统。
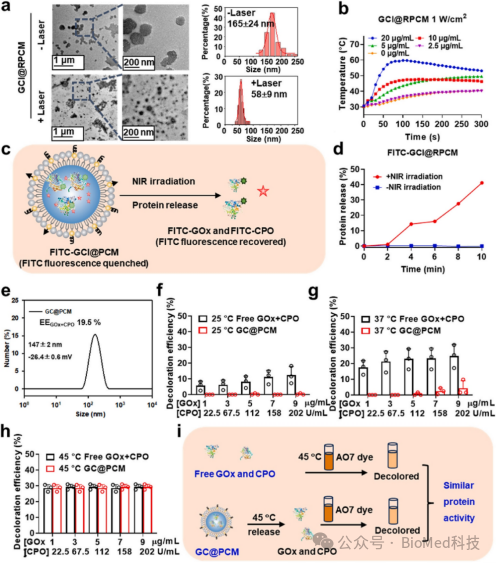
图2. NIR响应特性的GCI@RPCMs
作者进一步验证了RPCMs有效的细胞摄取能力。在这里作者使用TPE-BICOOH@RPCMs代替,它含有聚集荧光增强的荧光分子TPE-BICOOH。与4T1细胞孵育后,TPE-BICOOH@RPCM组比TPE-BICOOH@PCM摄取更高(图3)。此外,两种PCM粒子在MCF-10A细胞中的摄取都很低,表明RGD配体修饰的RPCMs对4T1细胞具有很强的肿瘤细胞选择性。
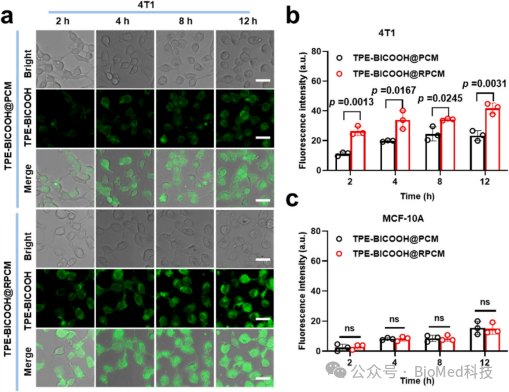
图3. RPCMs的细胞摄取研究
作者首先在体外细胞证实了GCI@RPCMs对4T1细胞具有激光和浓度依赖性的细胞毒性,同时显著高于GCI@PCMs,这归因于RGD配体介导的酶摄取增强。GI@PCM和CI@PCM组的细胞毒性可以忽略不计,这表明级联酶(GOx和CPO)是有效治疗的必要条件。此外,活/死细胞染色也证实了近红外激光照射后GCI@RPCMs对肿瘤细胞的强抑制作用(图4c)。此外,Annexin V-FITC/PI荧光染色的流式细胞术检测也显示,GCI@RPCMs处理的4T1细胞在激光照射下细胞凋亡和坏死率最高(图4d)。
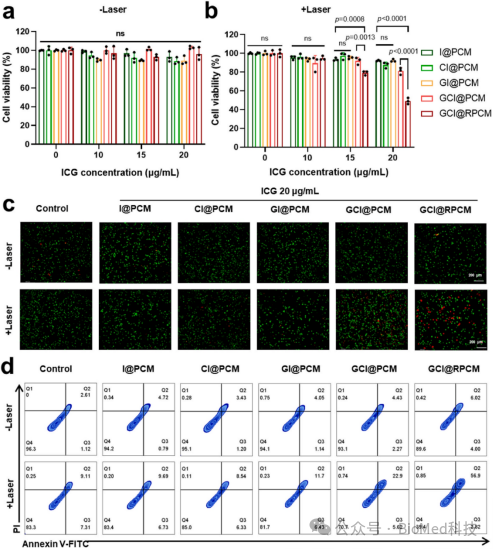
图4. NIR响应性GCI@RPCMs体外肿瘤细胞抑制
作者还研究了GCI@RPCM的细胞水平抗肿瘤机制。在激光照射后,GCI@RPCM和GCI@PCM组的ROS信号较强。随后通过染色,证明GCI@RPCM组DNA损伤明显(图5)。这些结果表明GCI@RPCMs产生具有NIR响应的ROS,导致NIR响应的细胞内DNA损伤和肿瘤细胞死亡。
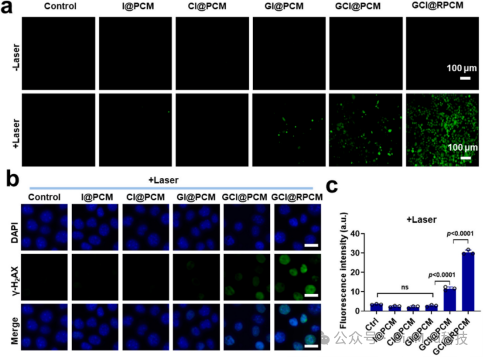
图5. 细胞水平NIR响应性GCI@RPCMs的抗肿瘤机制
最后,作者评估了GCI@RPCMs在近红外激光照射下对4T1荷瘤小鼠的治疗效果。激光照射后,GCI@PCM(第5组)显示出较强的肿瘤抑制(51.5%),GCI@RPCM(第7组)表现出最强的肿瘤抑制(100%)。肿瘤H&E染色显示,GCI@PCM组在辐照下观察到明显的核解离(图6g)。ROS染色显示该组在细胞核和细胞质中均有丰富的ROS分布,同时Ki67表达可忽略且有肿瘤细胞大量凋亡。
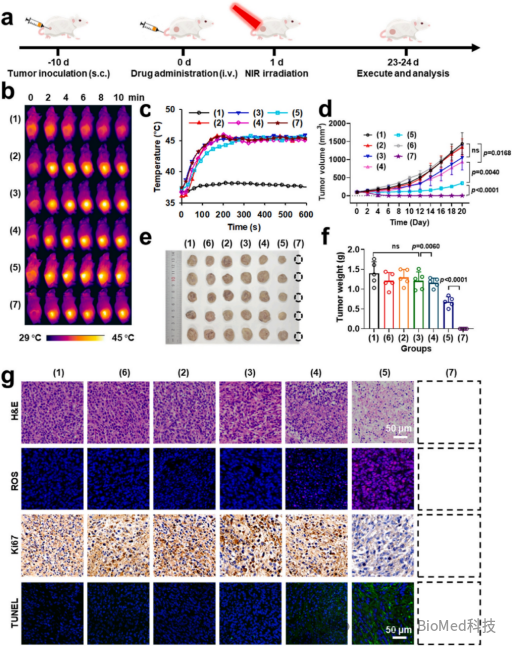
图6. 体内NIR响应性酶动力学治疗效果
【结论与展望】
总的来说,夏玉琼研究团队开发了高度稳定和NIR响应的相变材料,递送级联酶以治疗肿瘤。材料的RGD配体表面修饰增加了纳米粒子的体外细胞摄取和体内肿瘤靶向性。级联酶(GOx和CPO)主要通过范德华相互作用被稳定地包裹在RPCMs中。在近红外激光照射下,相变材料(GCI@RPCMs)中的光热剂(ICG)加热PCMs并释放用于肿瘤治疗的活性酶。体内研究表明GCI@RPCMs具有良好的生物相容性和较强的NIR响应性肿瘤抑制作用。与传统的ROS(H2O2)载体相比,该研究的纳米平台有三个独特的优势和改进:(1)纳米医学中使用GOx/CPO级联而不是单独使用GOx,其中GOx在肿瘤组织中产生H2O2,而GOx/CPO在肿瘤组织中产生HClO;(2) HClO对肿瘤的杀伤作用强于H2O2;(3)激光照射严格控制ROS的产生,使纳米药物具有较好的安全性和肿瘤选择性。我们相信NIR响应性PCMs在未来可以被开发为一个通用平台,提供治疗各种疾病的活性治疗酶。在近红外穿透有限的情况下,超声和X射线的穿透深度不受限制,可以进一步赋予响应性PCMs较高的临床转化潜力。
原文链接:
https://doi.org/10.1016/j.mtbio.2024.101345