组蛋白赖氨酸乳酸化是一种生理和病理相关的表观遗传途径,可以被Warburg效应相关的L-乳酸刺激。然而,细胞利用L-乳酸生成乳酸辅酶A (CoA)的机制以及这一过程是如何被调节的仍不清楚。
2024年12月5日,中国科学院上海药物研究所黄河、美国芝加哥大学Zhao Yingming共同通讯在Cell Metabolism在线发表题为“Nuclear GTPSCS functions as a lactyl-CoA synthetase to promote histone lactylation and gliomagenesis”的研究论文,该研究表明核GTPSCS作为乙酰辅酶A合成酶,促进组蛋白乳酸化和胶质瘤形成。
该研究报道了在细胞核中鉴定出鸟苷三磷酸(GTP)特异性SCS (GTPSCS)为乳酸辅酶A合成酶。通过GTPSCS与L-乳酸盐复合物的晶体结构来阐明其作用机制,并进行诱变实验。GTPSCS易位进入细胞核并与p300相互作用以提高组蛋白乳酸化而不是琥珀酰化。这一过程依赖于GTPSCS G1亚基的核定位信号和G2亚基残基K73的乙酰化,介导与p300的相互作用。GTPSCS/p300协同调节组蛋白H3K18la和GDF15的表达,促进胶质瘤增殖和放射耐药。GTPSCS是首个在胶质瘤中催化乙酰辅酶A合成表观遗传组蛋白乳酸化和调节致癌基因表达的酶。

即使在完全充氧的条件下,糖酵解的增加和L-乳酸(以下简称乳酸)的生成也是癌症的一个标志,这种现象被称为Warburg效应乳酸在缺氧条件下会进一步受到刺激乳酸。长期以来被认为是细胞代谢的一种被动废物副产物。然而,在过去的十年中,乳酸盐的多种代谢功能已经被认识到。最近发现了乳酸的非代谢作用,表明乳酸可以作为L-赖氨酸乳酸化(Kla)的前体,乳酸衍生的乳酸基共价附着在赖氨酸残基的侧链上,可能通过乳酸辅酶A(lactyl-CoA)。组蛋白Kla标记位于特定的基因组区域,与巨噬细胞中抗炎基因的活跃表达有关。Kla调节酶(“书写者”和“擦除者”),如p300和组蛋白去乙酰化酶(HDACs)随后被确定。组蛋白Kla作为一种表观遗传调控途径,近年来与多种疾病和生理过程相关,表明Kla是一种动态的、生理相关的表观遗传途径。
琥珀酰辅酶A合成酶(SCS)最初被认为是线粒体中的一种酶。根据底物特异性,在哺乳动物中鉴定出两种类型的SCS:鸟苷三磷酸(GTP)特异性SCS (GTPSCS)和三磷酸腺苷三磷酸(ATP)特异性SCS (ATPSCS)。由于线粒体中ADP/ATP比值高于GDP/GTP比值,且与GTPSCS (0.5 mM)相比,ATPSCS(5 mM)的琥珀酸长度更高,线粒体ATPSCS在三羧酸(TCA)循环中主要将琥珀酰辅酶A转化为琥珀酸以产生ATP,这一过程称为底物水平磷酸化,而线粒体GTPSCS更倾向于在肝脏中产生酮体和卟啉。以往的研究表明,GTPSCS在肾脏和肝脏中高表达,在正常大脑中几乎不表达。然而,GTPSCS在胶质瘤进展中的表达及其病理相关性尚未得到研究。
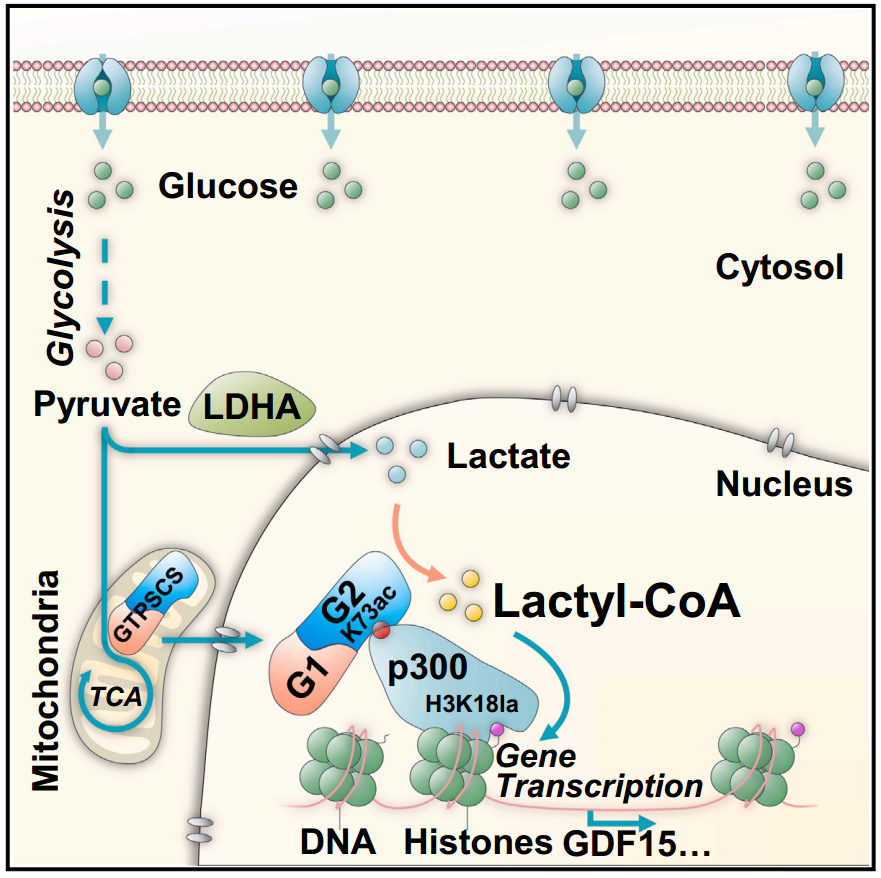
机理模式图(图源自Cell Metabolism)
胶质瘤是中枢神经系统中最常见的肿瘤,在成人中沿两条相互排斥的分子途径之一发展。第一种,异柠檬酸脱氢酶(IDH)突变,需要在代谢基因IDH1或IDH2中获得肿瘤启动热点突变,导致“少突胶质细胞瘤(OG), IDH突变,和1p/19q共缺失”或“星形细胞瘤(AST),IDH突变。第二种涉及经典的致癌突变,但不涉及IDH突变,导致胶质母细胞瘤(GBM)和IDH野生型(WT)。对小鼠和患者胶质瘤体内代谢的分析显示,葡萄糖大量产生乳酸。此外,乳酸脱氢依赖乳酸合成已被证明通过多种机制支持胶质瘤的进展。
该研究结果提出了一个有趣的模型:核GTPSCS/p300使用糖酵解衍生的乳酸,并为原位组蛋白H3K18la生成乳酸辅酶A,从而调节GDF15的表达。该模型表明GTPSCS/p300/H3K18la轴代表了一条介导Warburg效应下游影响的新表观遗传途径。GTPSCS、乳酸和Warburg效应之间的关联强调了胶质瘤中代谢重编程的相互联系。利用肿瘤产生的高乳酸浓度作为GTPSCS的底物,强调了癌细胞操纵其代谢途径以支持肿瘤增殖和放射抵抗的特定机制。这种复杂的相互作用强调了GTPSCS在协调癌症相关代谢改变中的重要性,揭示了旨在破坏维持胶质瘤生长的代谢适应的治疗干预的潜在靶点。
参考消息:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(24)00451-0