心力衰竭是一种全球性疾病,是肥厚型心肌病(HCM)常见的并发症之一。当前针对HCM和心力衰竭的治疗主要依赖于调节肾素-血管紧张素-醛固酮系统(RAAS)的药物,但疗效有限,亟需更有效的治疗策略来缓解肥厚性心力衰竭。近年来,miRNA已成为包括心衰在内多种疾病的极具前景的治疗靶点。然而,现有的miRNA治疗方法(如基因转染或直接注射miRNA分子)因免疫原性高、半衰期短以及病毒载体易受抗体中和等问题,临床转化受到限制。细胞外囊泡(EVs)作为天然纳米颗粒,因其良好的生物相容性、低免疫原性、较长循环能力以及较高的抗中和抗体能力,被认为是下一代药物递送平台。其中,来源于牛乳的EVs(mEVs)因其低成本、安全性、高产率和易于大规模生产的特点,被认为是最具潜力的递送平台。

近日,新加坡国立大学王炯伟教授团队和山东第一医科大学徐涛院士团队在《Biomaterials》杂志在线发表题为“Myocardial delivery of miR30d with peptide-functionalized milk-derived extracellular vesicles for targeted treatment of hypertrophic heart failure”的研究工作。该研究开发了一种负载miR30d的心肌靶向肽功能化乳源性细胞外囊泡—miR30d-mEVsIMTP,用于治疗肥厚型心肌病,并揭示了GRK5是miR30d在心肌肥厚中的新靶点。
【文章要点】
本研究中,作者聚焦心脏靶向的核酸递送平台开发,通过表面功能化缺血性心肌靶向肽(IMTP),对乳源细胞外囊泡(mEVs)进行改造,并将miR30d封装其中,开发了一种miR30d-mEVsIMTP制剂,用于实现miR30d向受损心脏的靶向递送。体外实验显示,miR30d-mEVsIMTP可通过内吞-溶酶体途径有效进入缺氧诱导的H9C2细胞。在异丙肾上腺素(ISO)诱导的心肌肥厚小鼠模型中,静脉注射后,miR30d-mEVsIMTP在心脏组织中的积累量高于未修饰IMTP的miR30d-mEVs。
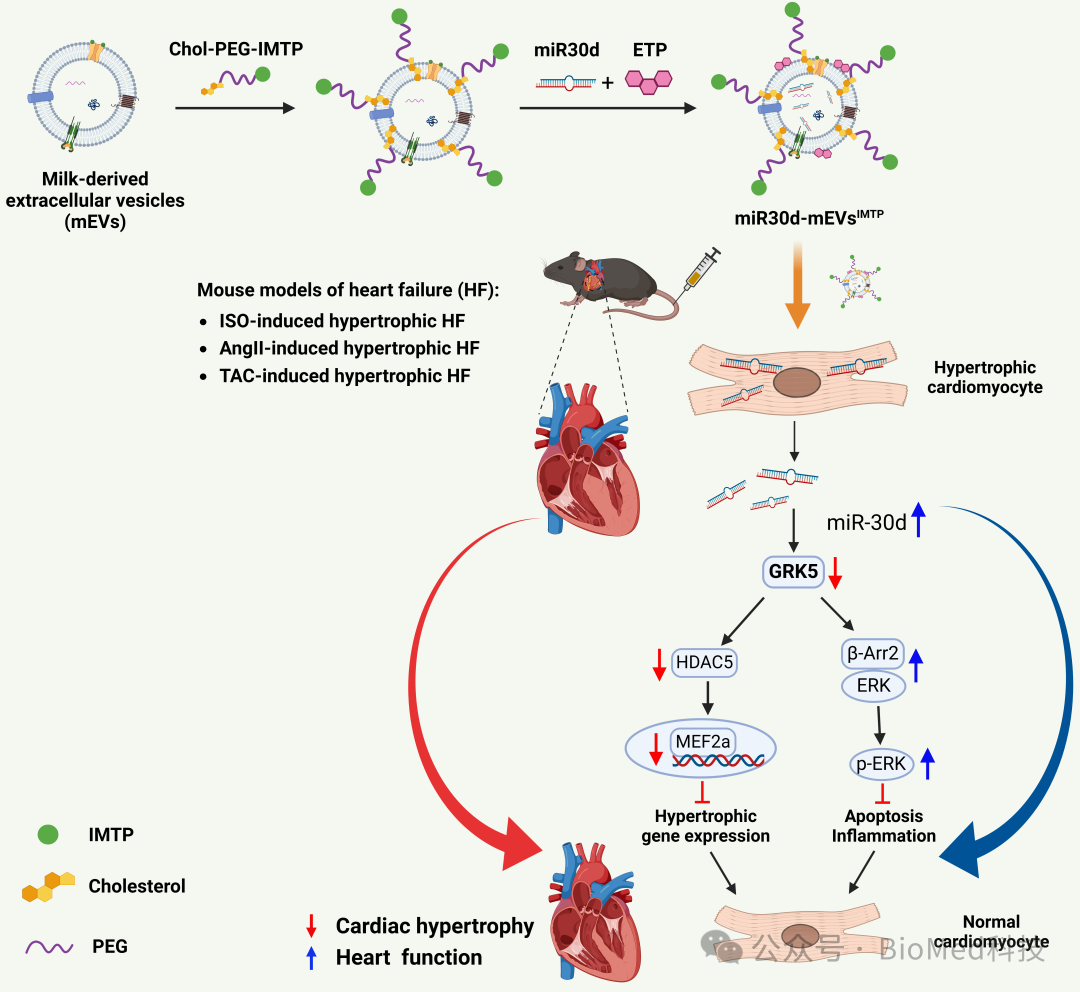
图1. miR30d-mEVsIMTP的构建和改善肥大性心衰的作用机制原理
此外,我们构建了三种肥厚性心力衰竭小鼠模型,评估了miR30d-mEVsIMTP对心功能的改善作用。研究表明:在基线时,小鼠的心脏腔室体积和心功能无显著差异。在注射ISO/AngII以及进行TAC手术后,小鼠模型成功建立了心肌肥厚和心功能障碍。通过心脏增大和心重与胫骨长度比值(HW/TL)增加评估的心肌肥厚,经过静脉注射miR30d-mEVsIMTP显著缓解。miR30d-mEVs对心肌肥厚也有一定抑制作用,但未达到统计学显著水平。此外,Masson染色结果显示,miR30d-mEVsIMTP抑制了心肌纤维化。随后,通过超声心动图测定心室体积变化(LVESV和LVEDV)以及心功能指标(EF和FS)。与miR30d-mEVs相比,miR30d-mEVsIMTP减轻了心室扩张和心功能障碍。这些结果表明,IMTP不仅提高了心脏靶向性,还增强了加载miR30d的mEVs的治疗效果。
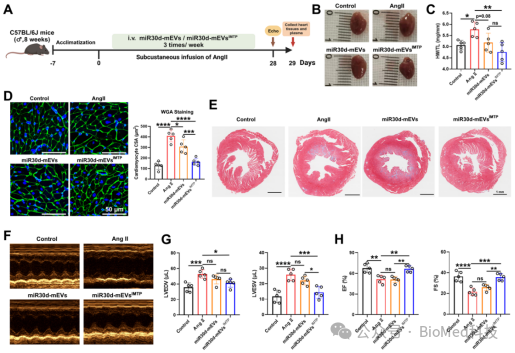
图2. miR30d-mEVsIMTP 对AngII诱导的肥大性心衰改善作用
本研究还揭示了GRK5是miR30d的直接靶点。通过荧光素酶实验预测miR30d在GRK5基因3′-UTR区域的保守结合位点,结果显示,将miR30d与含有GRK5野生型(WT)3′-UTR的荧光素酶报告载体共转染至HEK293细胞后,荧光素酶活性显著下降。相反,与miR30d拮抗剂共转染时,WT GRK5 3′-UTR载体的荧光素酶活性显著升高。此外,将miR30d模拟物转染至H9C2心肌细胞可抑制GRK5表达,而miR30d拮抗剂则增加GRK5的表达。为了进一步验证miR30d与GRK5的关系,研究开发了实时表面等离子共振(SPR)生物传感平台。利用链霉亲和素传感芯片固定了与生物素偶联的单链miR30d探针,并从小鼠心脏组织中分离GRK5基因,通过反转录和非对称PCR生成单链DNA(ssDNA)。通过SPR检测不同浓度GRK5 ssDNA的结合情况,计算得出miR30d与GRK5的结合亲和力(Kd值)为57.12 μmol,表明两者具有较高的结合亲和性。证实了GRK5是miR30d的直接作用靶点。
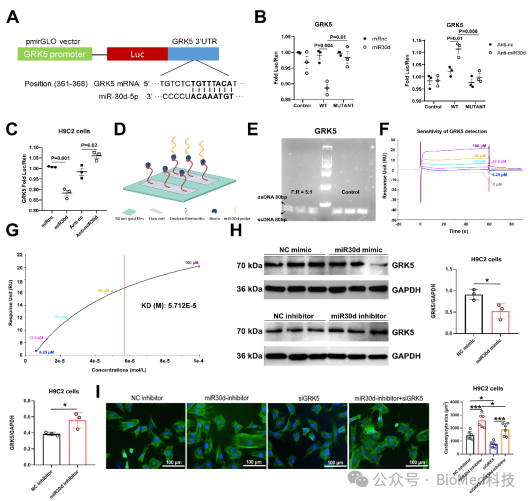
图3. GRK5是负载核酸miR30d的直接作用靶点
【结论与展望】
总之,我们的研究表明,静脉注射miR30d-mEVsIMTP通过将miR30d靶向递送至病理性心脏,能够缓解心力衰竭中的心肌肥厚、炎症和纤维化。此外,我们证明了miR30d通过GRK5介导的趋化因子信号通路发挥心脏保护作用。本研究提供了一种基于IMTP-mEVs的稳健平台,在改进心脏疾病基因治疗方面展现了巨大潜力。
原文链接:
https://doi.org/10.1016/j.biomaterials.2024.122976