缺血性心脏病是导致心衰的重要病因之一,尽管近年来在经皮冠状动脉介入治疗(PCI)和药物治疗方面取得了显著进展,但心肌梗死(MI)后的心力衰竭(HF)患者的预后尤其是生活质量仍不容乐观。心肌缺血损伤导致心肌细胞死亡和纤维化,伴随着心肌水肿和炎症。除大量的心肌细胞死亡外,非心肌细胞死亡的发生率也很高,包括内皮细胞和成纤维细胞等。内皮细胞通过促进血管新生在维持和支持低氧条件下的心脏血液和能量供应中发挥着至关重要的作用。因此,血管系统也一直是治疗缺血性心脏病的重要研究和干预靶点。近年来,研究人员越来越多地关注到淋巴管系统在心脏修复中的作用。在生理条件下,心脏淋巴管将外渗的大分子和液体返回循环系统,同时调节免疫反应。在病理状态下,心脏淋巴管功能障碍会导致心肌水肿、炎症及心脏功能不全。心梗发生后,内源性心脏淋巴管新生尚无法修复缺血性心肌的稳态失调。有研究提示,增强VEGF-C/VEGFR-3信号通路可以显著改善心梗后的淋巴新生及引流功能,减轻心脏炎症,从而改善心梗后心脏重构。
2024年11月18日,复旦大学附属中山医院心脏病全国重点实验室葛均波院士及邹云增主任、王时俊、白英楠教授团队在Signal Transduction and Targeted Therapy期刊发表了题为“EphrinB2-mediated CDK5/ISL1 pathway enhances cardiac lymphangiogenesis and alleviates ischemic injury by resolving post-MI inflammation”的研究论文,阐述了EphrinB2在心梗后心脏淋巴管新生中的关键作用,并探讨了其改善心梗后心脏重构和心功能潜在的分子机制,表明EphrinB2促进心脏淋巴管新生可能成为缺血性心脏病治疗的新靶点。

首先,研究人员通过分析小鼠心脏单细胞测序数据和免疫荧光染色验证,发现Efnb2 (EphrinB2)在内皮细胞群中高表达。进一步分析内皮细胞亚群,发现EphrinB2在淋巴管内皮细胞中表达。由于Efnb2基因纯合敲除(Efnb2-/-)小鼠难以生存和繁育,研究人员采用Efnb2基因杂合敲除(Efnb2+/-)小鼠进行实验研究。心超和病理等方法表明,Efnb2+/-小鼠在心梗后出现更严重的心功能不全和不良心室重构表型,并伴有淋巴管新生不足。
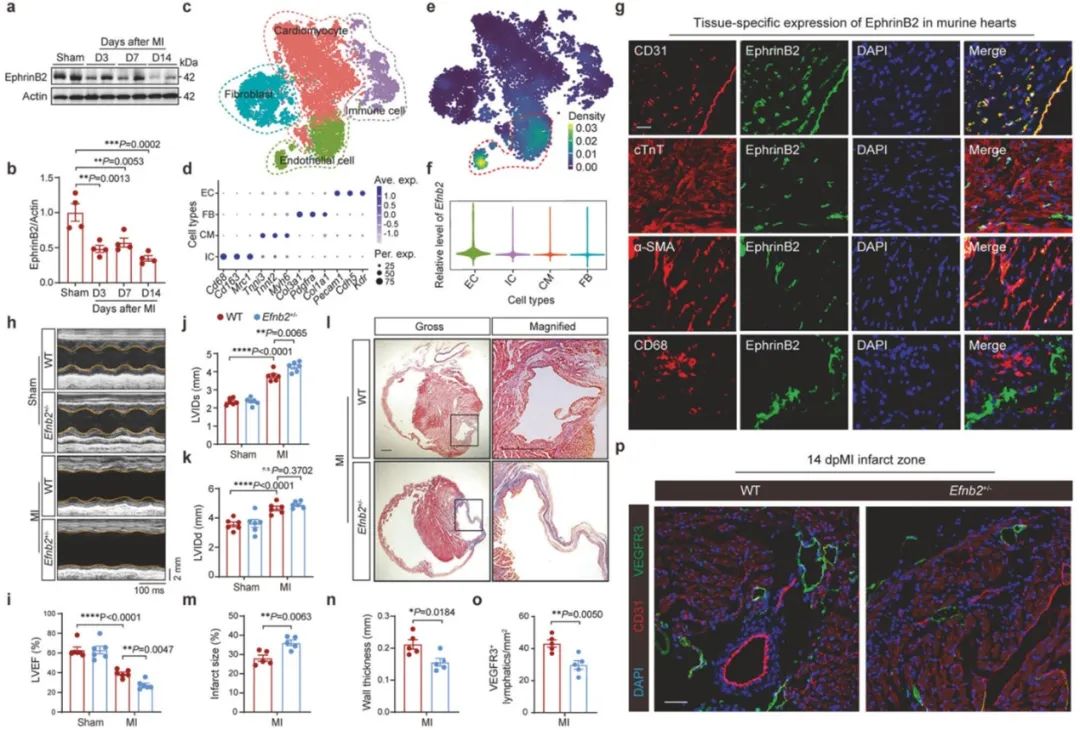
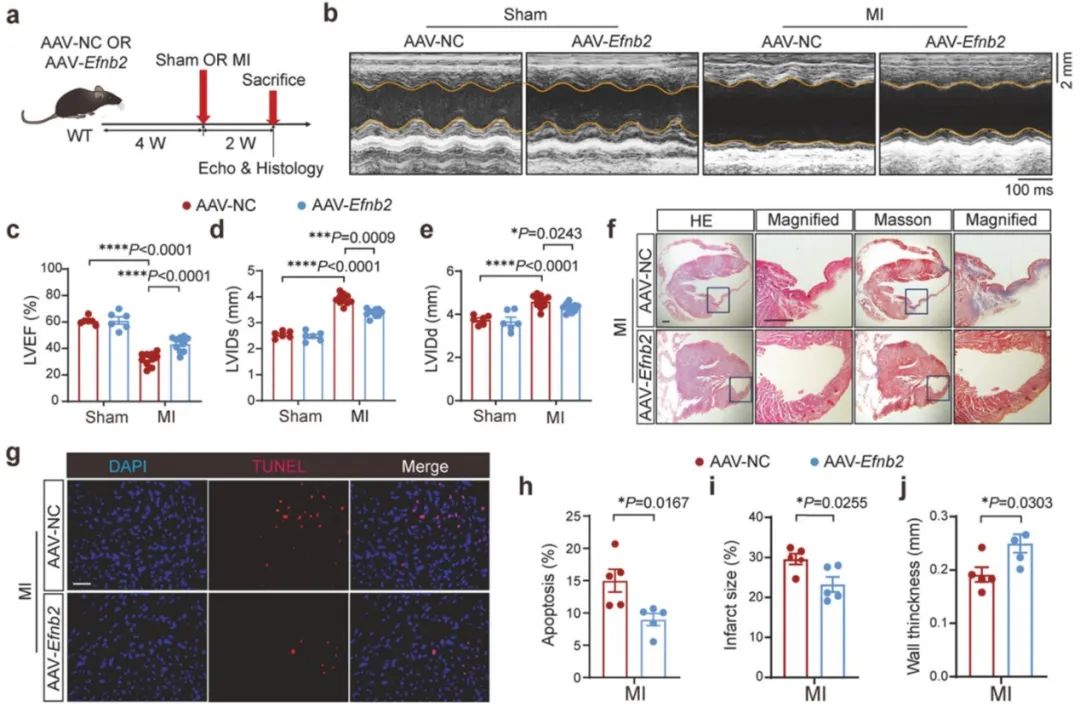
接下来,研究人员构建了腺相关病毒载体,在小鼠体内促使Efnb2基因过表达。结果表明,Efnb2过表达可促进心梗后淋巴管新生,并减轻心功能不良表型。进一步研究发现,Efnb2基因过表达不仅改善了淋巴管重构,还缓解了促炎性巨噬细胞和促炎介质在损伤心肌中的积累。Efnb2基因过表达不仅改善了心梗后心脏损伤局部的巨噬细胞浸润,免疫荧光染色结果显示,还促进了纵隔淋巴结回流的巨噬细胞增多。当研究人员敲除淋巴管内皮细胞膜上介导巨噬细胞黏附和转移的LYVE1分子时,Efnb2过表达对炎症缓解和心脏修复的保护性效应显著减弱。
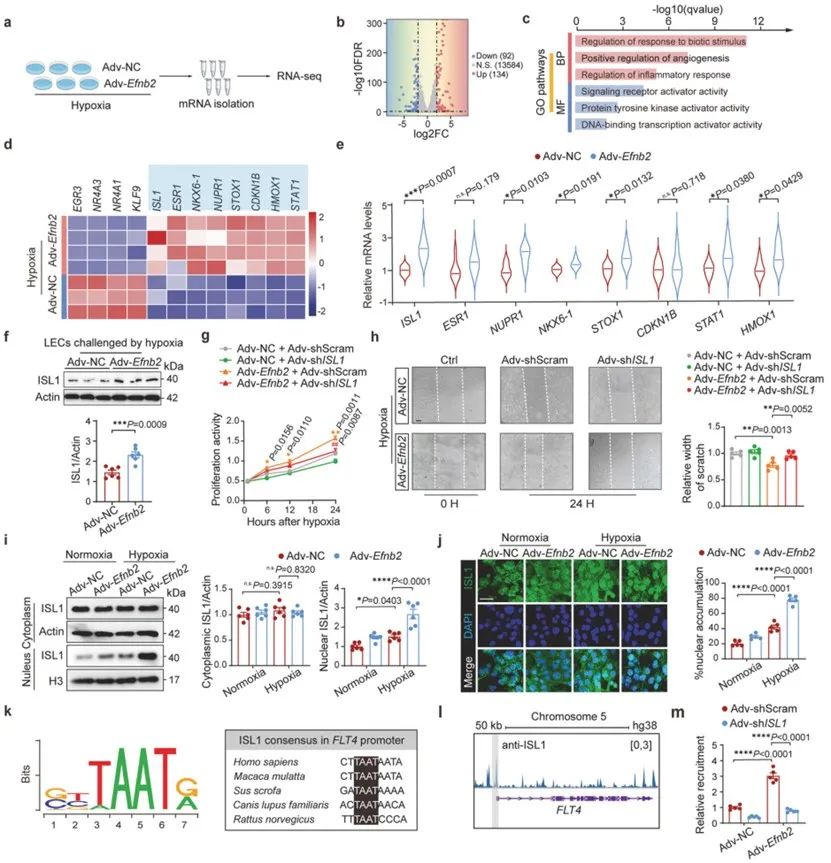
在分子机制层面,研究人员利用RNA-seq和qPCR技术筛选出ISL1作为EphrinB2的下游候选因子。进一步的功能实验表明,Efnb2基因过表达通过促进ISL1表达和核易位,从而介导淋巴管内皮细胞的增殖和迁移。这一效应可能是通过ISL1促进FLT4基因(VEGFR3)转录来实现的。为进一步探索ISL1核易位的分子机制,研究人员筛选了潜在激酶,发现CDK5通过磷酸化ISL1影响其转录活性,从而介导淋巴管内皮细胞的增殖和迁移。
综上所述,该研究表明EphrinB2在淋巴内皮细胞高表达,通过增强EphrinB2表达可以促进心梗后淋巴新生,显著改善心梗后心肌损伤局部的炎症细胞聚集,促进促炎性巨噬细胞和促炎因子引流,对于心梗后心脏重构和心功能修复带来新的治疗获益。
该论文的第一作者是复旦大学附属中山医院心内科博士研究生陈利明以及上海交通大学医学院附属国际和平妇幼保健院助理研究员郭方浩,复旦大学附属中山医院心内科葛均波院士、邹云增教授、王时俊研究员和白英楠副主任医师为该论文的共同通讯作者。美国Houston Methodist的John Cooke教授、中国科学院营养与健康科学研究所荆清教授、复旦大学阮承超教授、上海市同仁医院李文毅教授、复旦大学附属中山医院陈学颖教授、东方医院路青主任等作者均对该研究提供了大力支持。该研究受到了国家自然科学基金、上海科委等多个项目的资助。
原文链接:
https://www.nature.com/articles/s41392-024-02019-4