乙型肝炎病毒(HBV)作为一种嗜肝性病毒,感染婴幼儿后易引起慢性肝炎,并可进一步发展成肝硬化和肝细胞癌等严重肝脏疾病,严重威胁国民健康,现有抗病毒手段虽可控制但尚无法有效治愈慢性乙肝。成年人在感染HBV后超95%表现为急性自限性感染,展现出机体存在高效的自然清除HBV的机制,但仍缺乏分子层面对其的认知,这也阻碍了新型干预策略的研发。因此,深入研究解析宿主控制清除HBV的分子机制兼具重要科学意义和应用价值。
2024年09月27日,复旦大学上海医学院医学分子病毒学教育部/卫健委/医科院重点实验室与附属华山医院合作团队在Nature Communications发表题为“Liver Mechanosignaling as a Natural Anti-Hepatitis B Virus Mechanism”的研究论文(Featured),探讨了肝脏力学微环境在宿主应对HBV感染中的作用,发现肝细胞通过内在机械力通路感知响应细胞外基质硬度变化进而控制清除HBV,在国际上首次揭示宿主经由机械力感知通路直接抗病毒的全新机制。

目前认为,宿主可经由细胞毒性T细胞等免疫细胞,以“杀细胞”方式来清除HBV感染的细胞。此外,宿主被认为还存在不依赖细胞死亡的“非杀细胞”式清除病毒途径,由于该方式不造成组织损伤,因此长期备受关注,但具体机制仍不清楚。先前有报道显示,干扰素和白介素6等炎性细胞因子可能在宿主“非杀细胞式”控制清除HBV中起有一定作用,包括影响HBV共价闭合环状DNA(cccDNA)的活性和稳定性,但总体效应有限。
除传统细胞因子和化学信号外,近年研究表明,细胞所处微环境的物理特性对细胞功能具有显著影响。肝脏作为人体最大的实质性器官,有着重要生理功能和独特组织结构,其组织物理硬度在正常生理值条件下有较大范围(2.0~7.5 kPa),在某些感染情况下可瞬时升高。一般认为,肝脏硬度持续处于高位与严重肝脏疾病的发生发展密切相关,但肝脏硬度变化是否具有生理学意义鲜有研究。鉴于此,研究团队利用多种细胞、小鼠模型和临床队列标本,深入研究肝细胞所处的力学环境及相关机械力感知通路对HBV转录复制的影响。
首先,研究团队建立了一套可模拟生理性肝细胞外基质硬度变化的体外细胞研究体系,并观察到细胞外高基质硬度可显著抑制原代肝细胞中HBV的复制。同时,发现细胞外高基质硬度能显著激活细胞内的YAP分子及相关下游通路。
已知YAP是一种在机械信号传导中起关键作用的分子,可诱导一系列基因表达。通过外源激活实验,发现YAP可显著抑制HBV的转录和抗原表达,并促进cccDNA的清除。应用转录组学分析和功能研究,鉴定揭示YAP诱导的一系列基因表现出不同程度的抗HBV作用。
进一步采用HBV活跃复制个体的肝组织标本行原位染色分析,结果显示肝内YAP信号激活水平呈异质性分布,其与HBV抗原表达呈一种互斥分布特征。采用单细胞分析发现,在单个肝细胞水平,YAP的激活程度与HBV转录强度之间存在极为显著的负相关性。在HBV小鼠复制模型中,证实过表达YAP和肝组织硬度增加均可显著抑制HBV病毒学指标。而小鼠腹腔注射可激活YAP通路的小分子化合物,也观察到其对HBV转录及抗原表达的有效控制。有意义的是,在机械力通路介导的HBV控制和清除过程中,未发现干扰素系统激活且肝功能未受显著影响。这提示,肝细胞外力学微环境的改变及相关信号通路的激活,可作为一种非依赖传统免疫应答、且不直接杀伤肝细胞的独立的抗病毒机制,促进肝脏对HBV感染的自然控制和清除。
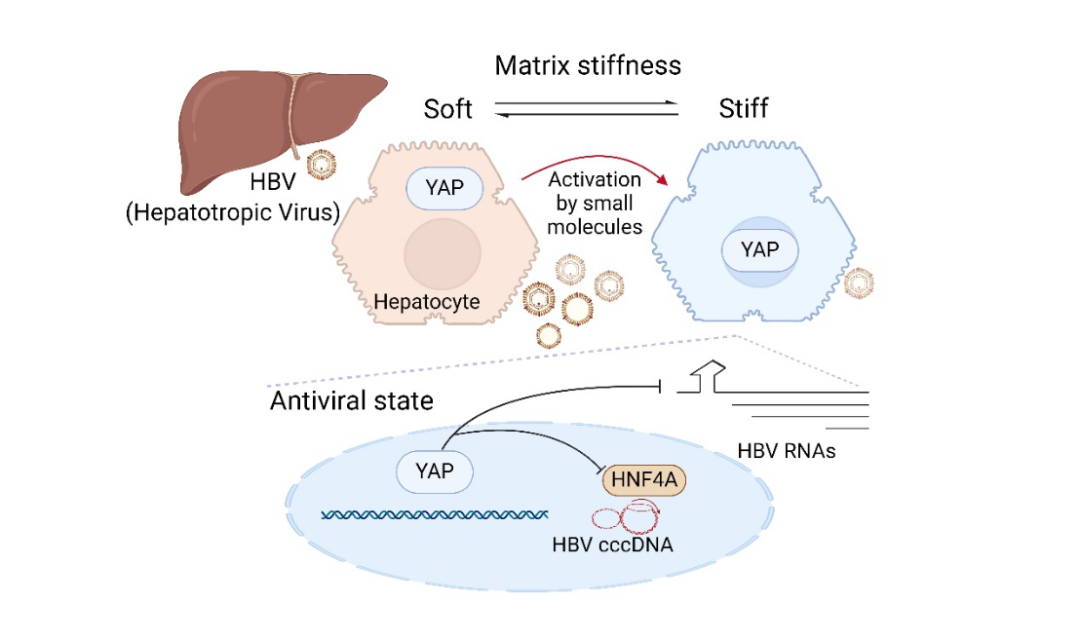
综上所述,针对宿主如何自然清除HBV,研究团队从生物力学视角切入,发现了一种肝细胞外机械力微环境和YAP分子介导的宿主清除HBV感染的新机制。这开拓了对肝脏-嗜肝病毒互作和“非杀细胞式”清除病毒的机理认知,也为新型抗病毒策略的研发和乙肝治愈相关研究提供了崭新视角和理论基础。
复旦大学陈捷亮教授、袁正宏教授和张继明教授为论文的共同通讯作者,基础医学院病原生物学系叶建宇博士、博士生华婷和华山医院感染科李发红博士为论文的共同第一作者。该研究得到国家自然科学基金、国家重点研发计划、中国医学科学院和上海市专项等资助。
原文链接:
https://www.nature.com/articles/s41467-024-52718-3