基于Panel的综合基因组分析 (CGP) 已在世界各地的临床实践中使用;然而,晚期小肠癌患者的大型真实世界数据(RWD)尚未得到表征。研究者分析了按分子定义或按年龄分层的亚组中临床相关变异的发生率差异。这是一项基于CGP检测(Foundation Medicine,Inc)的RWD生物标志物协作研究。对至少324个癌症相关基因和癌症中多达31个频繁重排基因中的选定内含子进行了杂交捕获。总共1364名晚期小肠癌患者可供分析,并按年龄(≥40岁/<40岁)、微卫星不稳定性(MSI)状态、肿瘤突变负荷(TMB)状态(高≥10/低<10 Muts/Mb)和选定基因变异进行分层。使用Yate校正的卡方检验分析变异频率。
频繁发生变异的基因包括TP53 (59.8%)、KRAS (54.8%)、APC (27.7%) 和CDKN2A (22.4%)。频繁发生扩增的基因包括MYC (6.7%)、MDM2 (5.9%)、GATA6 (5.5%) 和CCND1 (3.4%)。40岁以下患者的APC突变频率明显低于40岁及以上患者(10.4% vs 28.7%;P = .0008)。22.3%的患者检测到可用药物治疗的基因变异:BRAF V600E(1.2%)、BRCA1(1.8%)、BRCA2(3.2%)、ERBB2扩增(3.2%)、KRAS G12C(3.3%)、NTRK1/2/3融合(0.07%)、MSI-H(7.0%)和TMB-H(12.2%),不同年龄组间变异发生率无显著差异(<40 岁vs ≥40 岁;22.1% vs 22.3%)。4.8%的患者TMB为10-20 Mut/Mb,7.3%的患者TMB ≥20 Mut/Mb。
临床panel检测的RWD揭示了小肠癌亚组的基因组图谱。这些发现为晚期小肠癌治疗的未来发展提供了见解。
研究背景
小肠癌是一种罕见的恶性肿瘤,占所有胃肠道(GI)癌症的3%。由于病例少,缺乏前瞻性临床研究,小肠癌的标准化治疗尚未建立。目前,小肠癌的治疗是按照胃癌和结直肠癌的治疗,根据原发病灶的位置进行。然而,小肠癌的基因组图谱已被发现与胃癌和结直肠癌不同;因此,应该开发针对小肠癌的特异性治疗方法。
使用下一代测序(NGS)的综合基因组分析已在临床上应用于世界各地的癌症。然而,由于小肠癌患者很少,因此可用的真实世界数据(RWD)有限。特别是,青少年和青壮年(AYA)小肠癌患者和基因组定义亚群的基因组研究结果尚未阐明。因此,研究者检查了自2014年以来在RWD中测序(Foundation Medicine, Inc)的大队列小肠癌,以帮助确定这种疾病的确定和新治疗方法。
研究结果
小肠癌的基因变异总体情况:
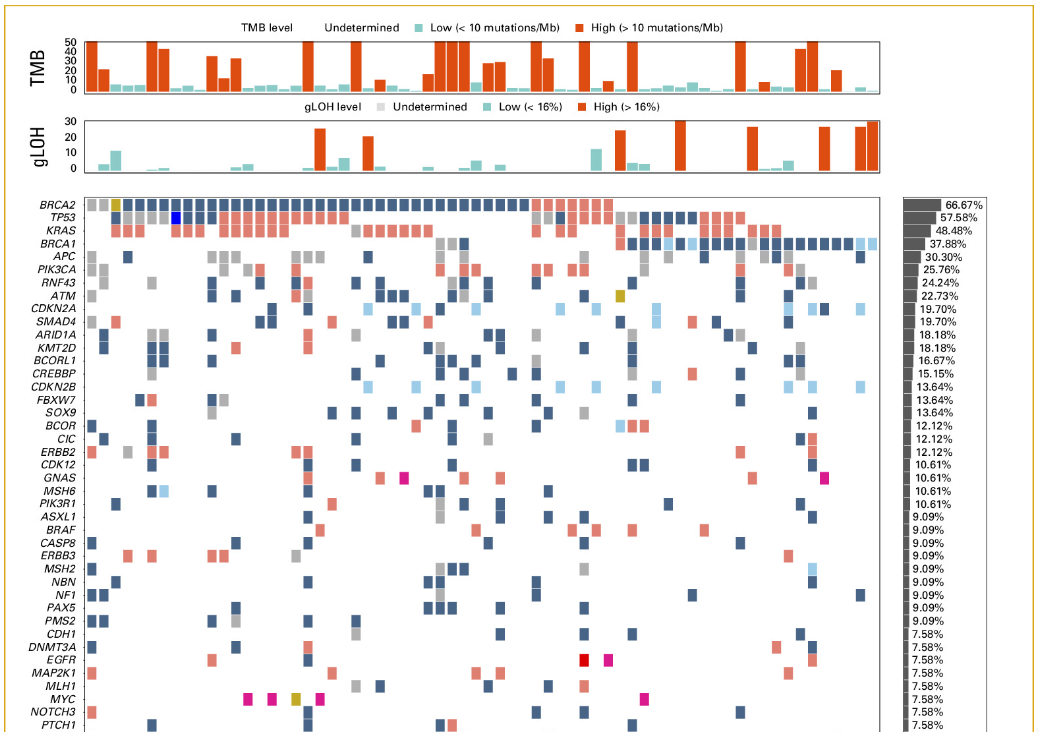
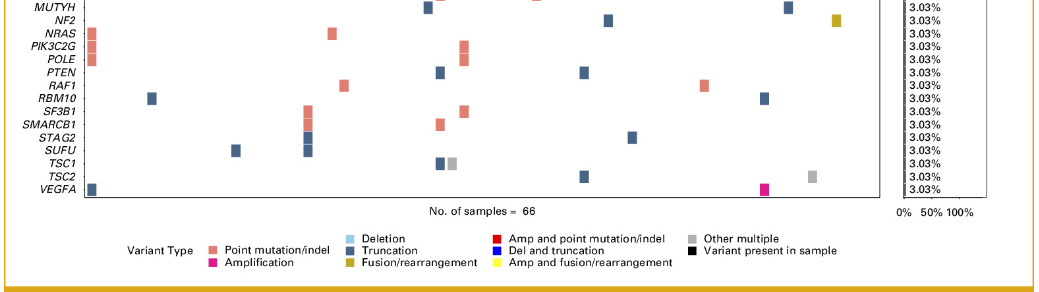
研究人群包括719名小肠腺癌患者和645名十二指肠腺癌患者。整个小肠癌队列的基因组图谱如图1和附录图A1所示。频繁变异的基因包括TP53 (59.8%)、KRAS (54.8%)、APC (27.7%)、CDKN2A (22.4%) 和SMAD4 (20.2%)。频繁扩增的基因包括MYC (6.7%)、MDM2 (5.9%)、GATA6 (5.5%)、CCND1 (3.4%)、FGF19 (3.3%) 和ERBB2 (2.3%)。
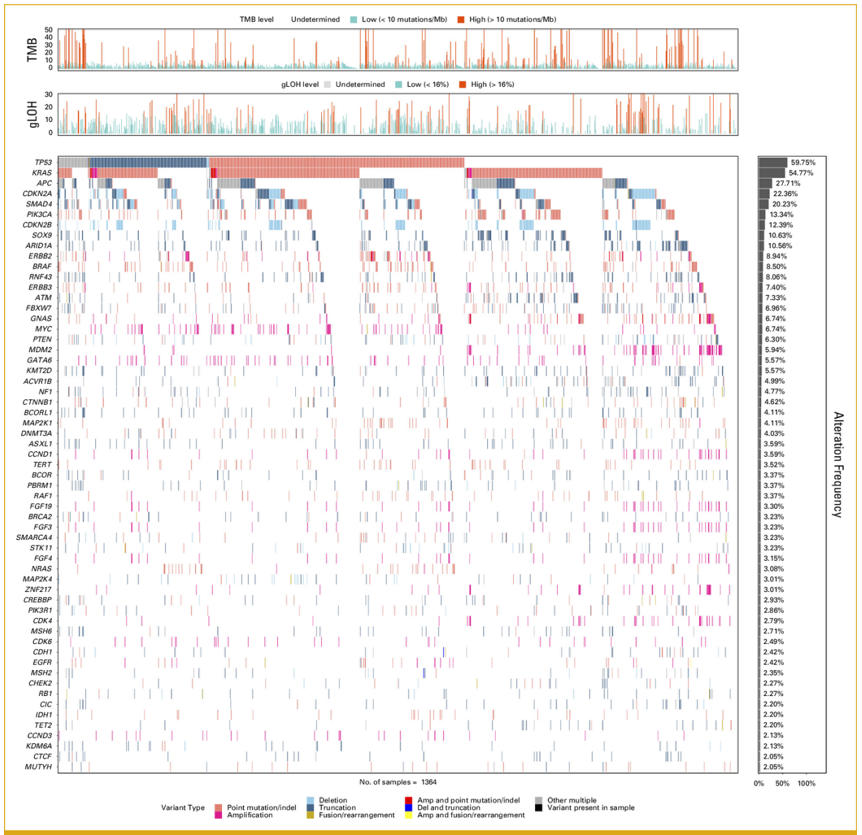
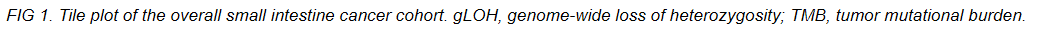
图1
图A1
KRAS短变异和BRAF变异基于类别的发生率:
52.8%的患者检测到KRAS短变异体(SV)变异。在KRAS SV患者中,TP53 (63.1% v 56.1%;P = .0163)、PIK3CA (16.0% v 10.3%;P = .0029) 和SMAD4 (25.6% v 14.1%;P < .001) 变异的检测频率高于不携带KRAS SV的患者。相比之下,在非KRAS SV患者中,ARID1A(13.8% v 7.7%;P < .001)、ERBB2(14.6% v 4.0%;P < .001)和BRAF(12.5% v 5.0%;P < .001)变异的检出率高于KRAS SV患者(附录表A1和图A2)。KRAS SV中观察到的变异包括G12D(31.1%)、G12V(22.3%)、G13D(13.8%)、G12C(6.2%)和 G12R(5.1%)。
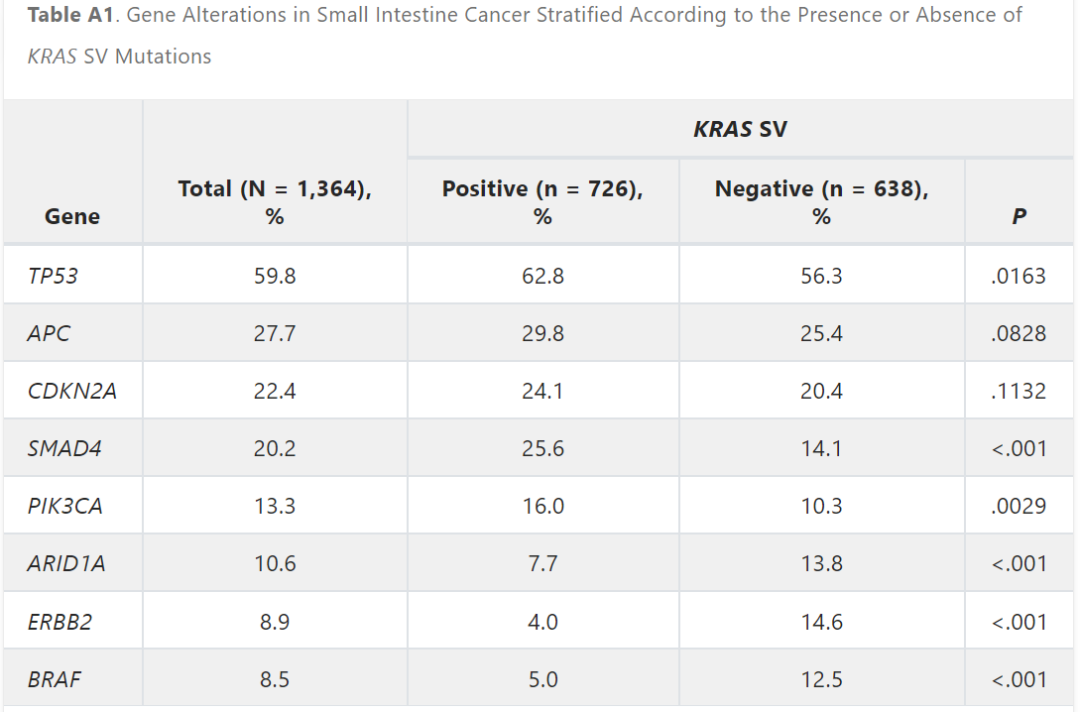
表A1
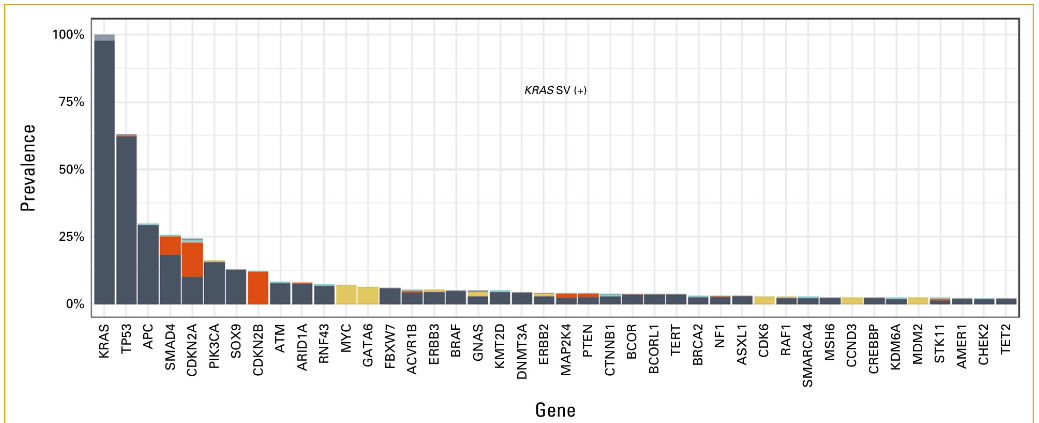
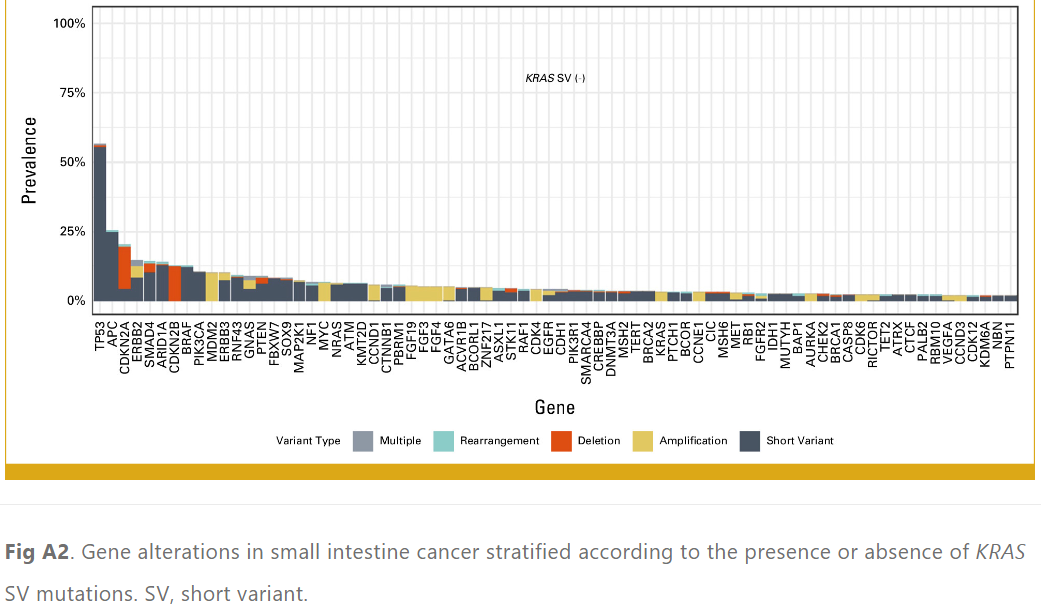
图A2
在本研究中,8.7%的患者出现BRAF变异。根据激酶活性的基础研究,这些BRAF突变被分为1类、2类或3类。因此,在整个队列中,1.3%被归类为1类,2.4%被归类为2类,4.8%被归类为3类(图2A )。在BRAF 3类变异的患者中,KRAS同时发生变异很常见 (43.1%),而在BRAF 1类 (5.6%) 和2类 (15.6%) 变异的患者中,同时发生KRAS变异的频率较低(附录表A2和图A2B)。
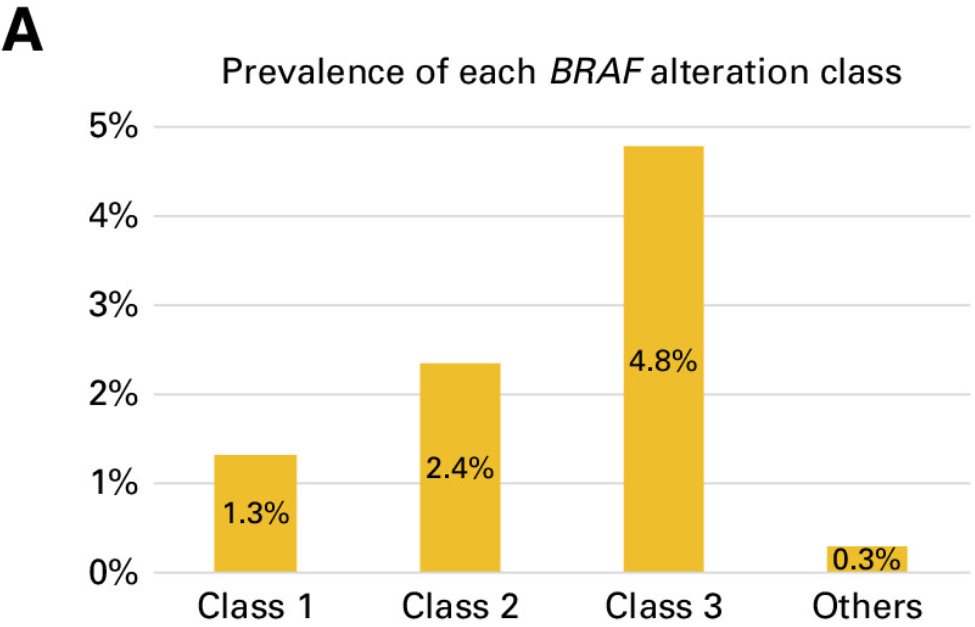
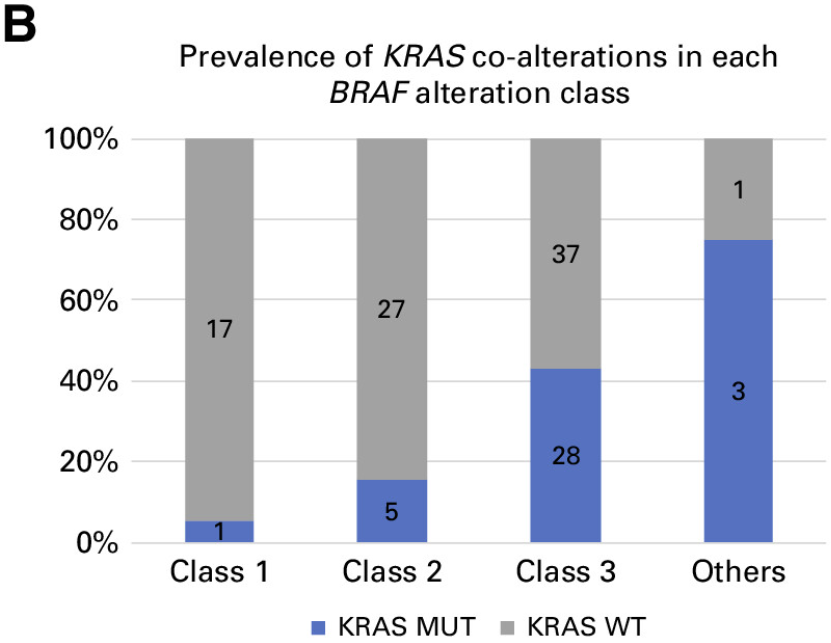

图2
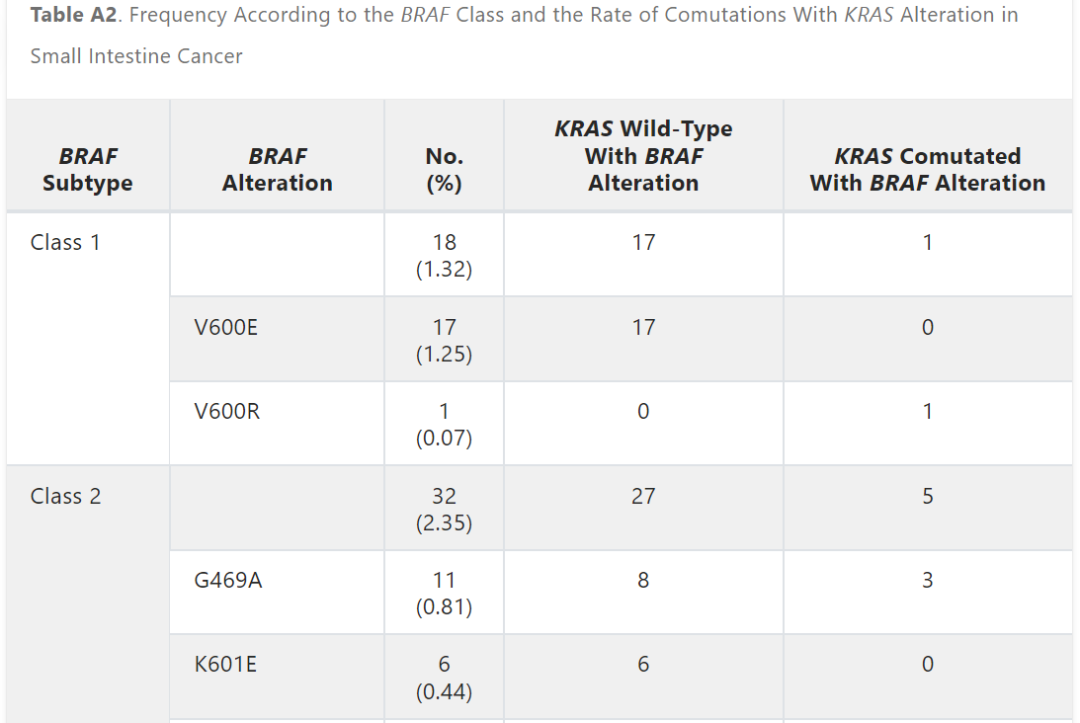
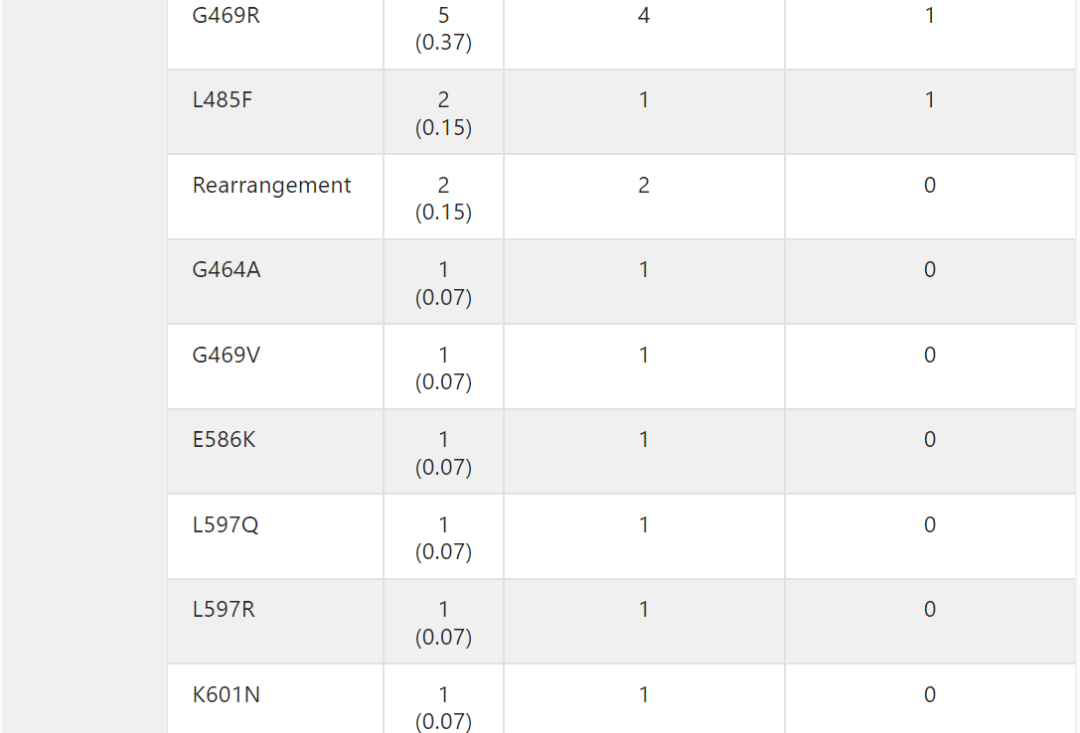
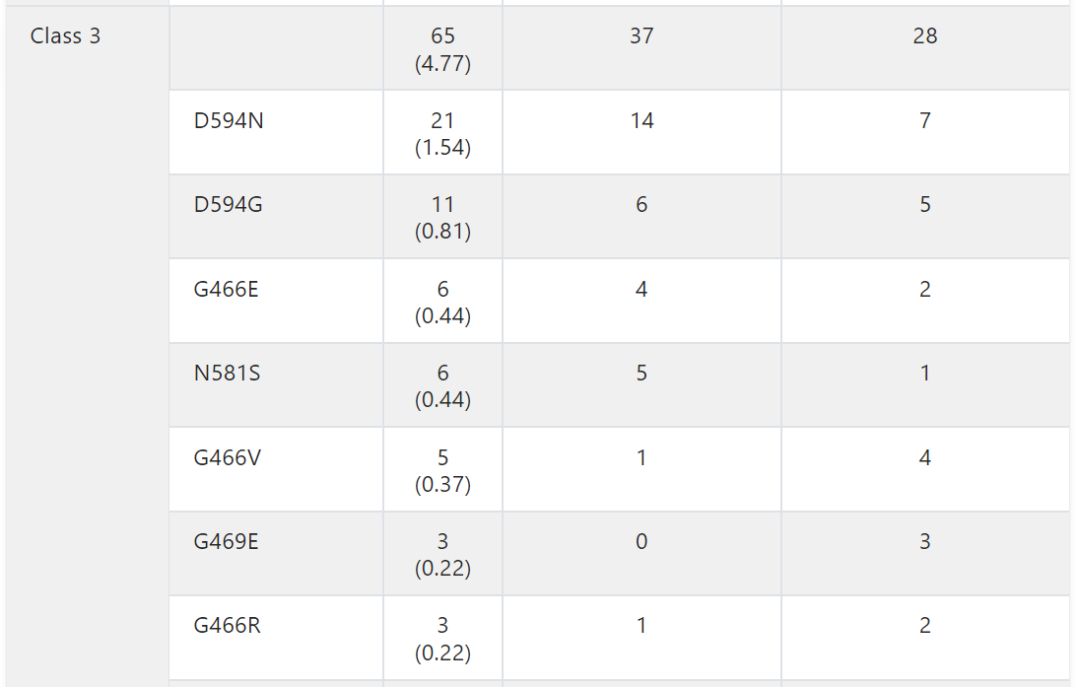
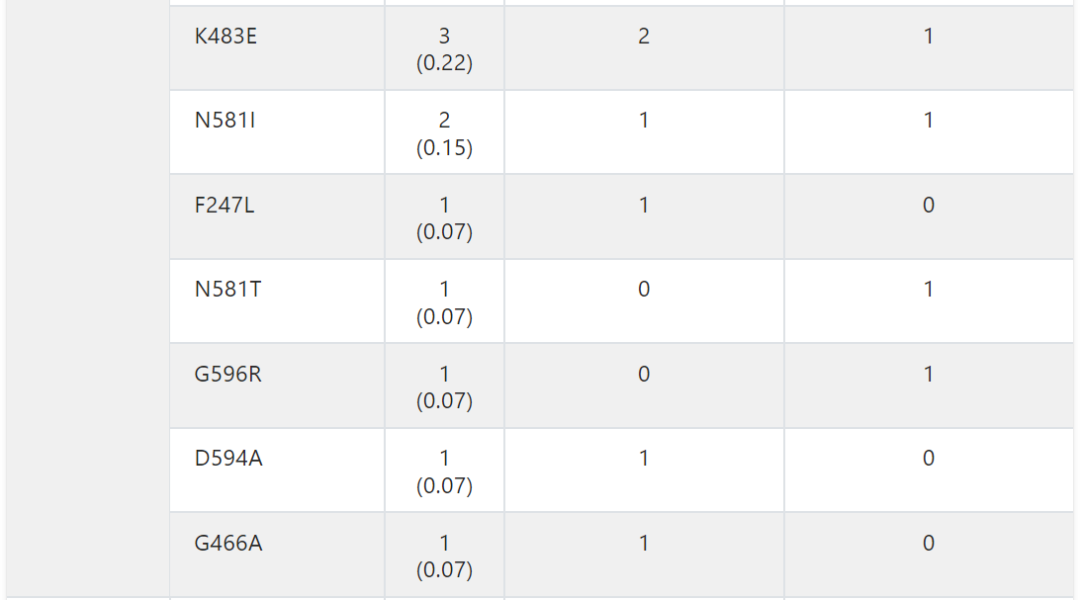
表A2
根据MSI和TMB状态对小肠癌基因变异进行分层:
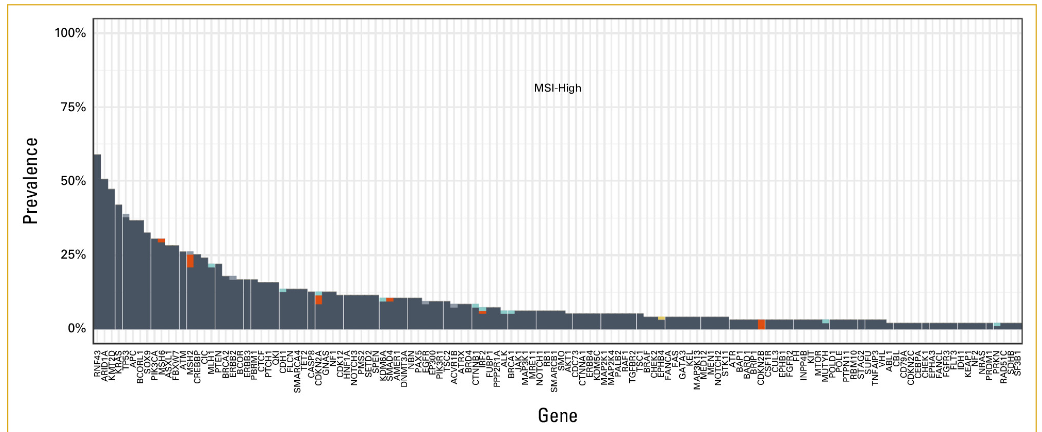
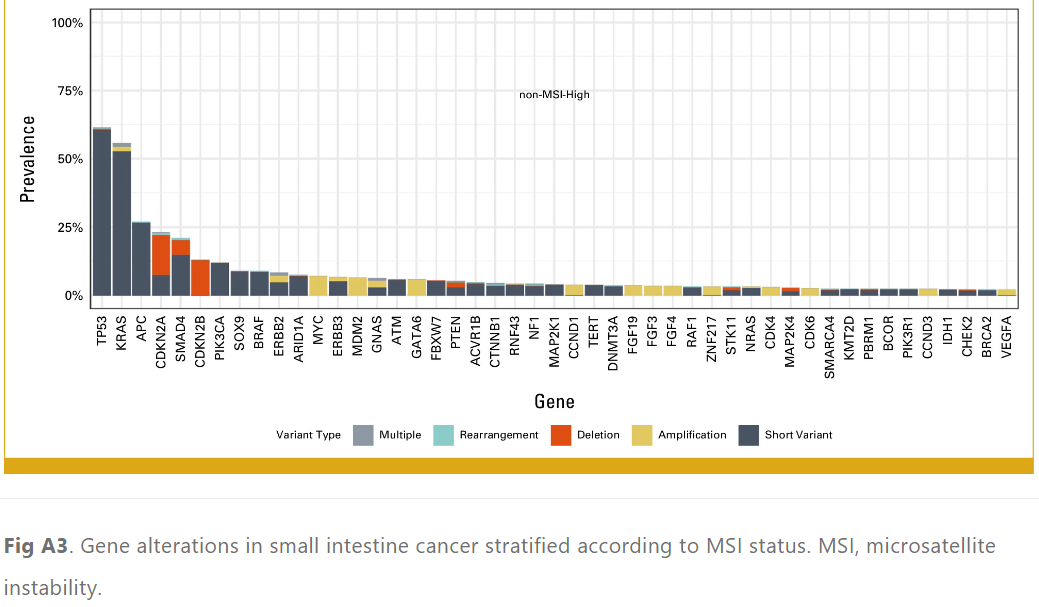
7.0%的小肠癌病例观察到MSI-H。与非MSI-H癌症患者相比,MSI-H癌症患者中PIK3CA (30.5% v 12.1%)、ERBB2 (17.9 v 8.3%)、RNF43 (58.9% v 4.3%)、ARID1A (50.5% v 7.6%) 和KMT2D (47.4% v 2.4%) 变异明显更常见(表1;附录图A3)。TMB-H(≥10 mut/Mb)的发生率为12.2%,非常高TMB(≥20 mut/Mb)的发生率为7.3%(图3)。在TMB-H组中,PIK3CA(27.1% v 11.4%)、RNF43(35.5% v 4.3%)、APC(34.9% v 26.7%)和ARID1A(31.9% v 7.6%)变异的频率显着高于TMB-low组(表1;附录图A4)。在TMB-H组中,MSI-H的发生率为56.0%。与此一致的是,对36名TMB≥50 mut/Mb的患者的突变特征进行分析,发现80.6%(n = 29)存在错配修复特征,5.6%(n = 2)存在聚合酶ε特征。
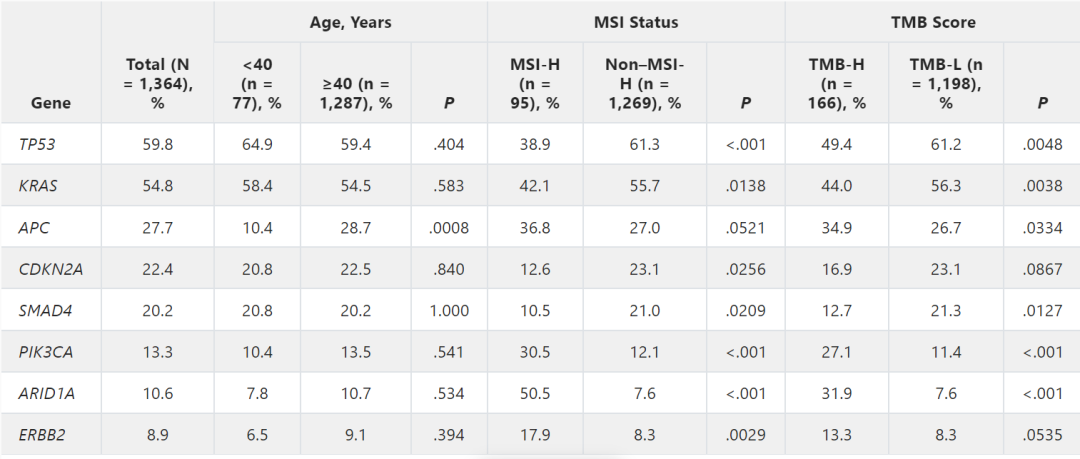

表1
图A3
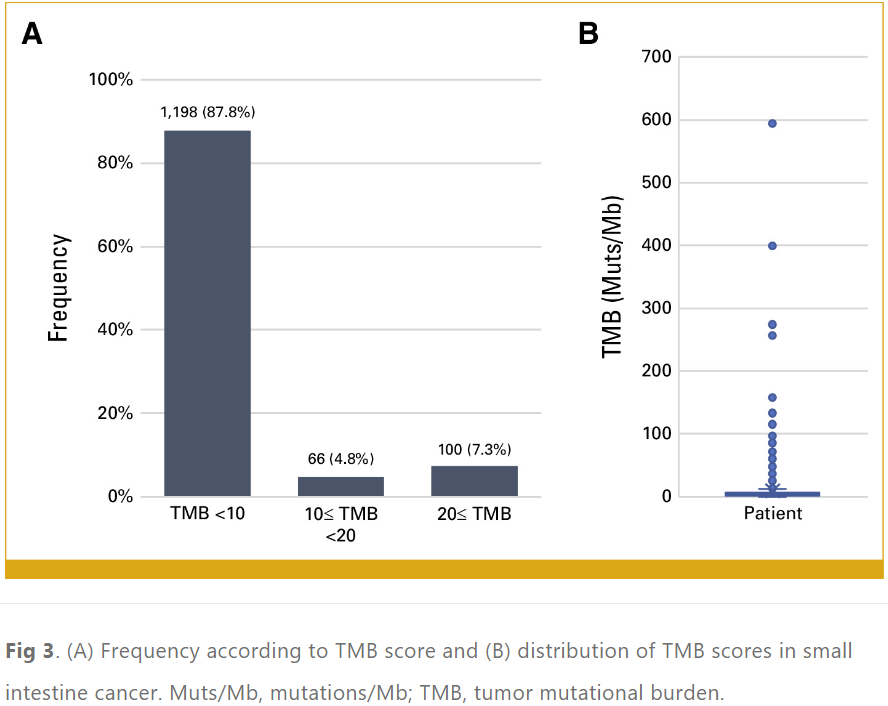
图3
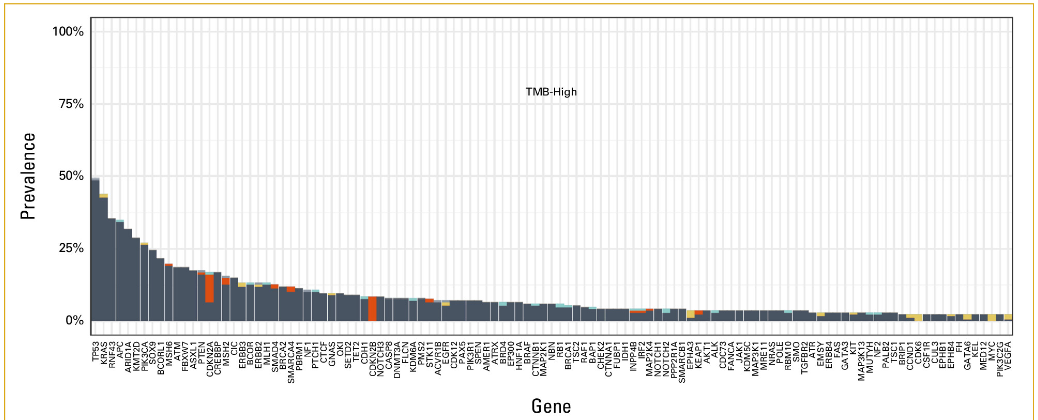
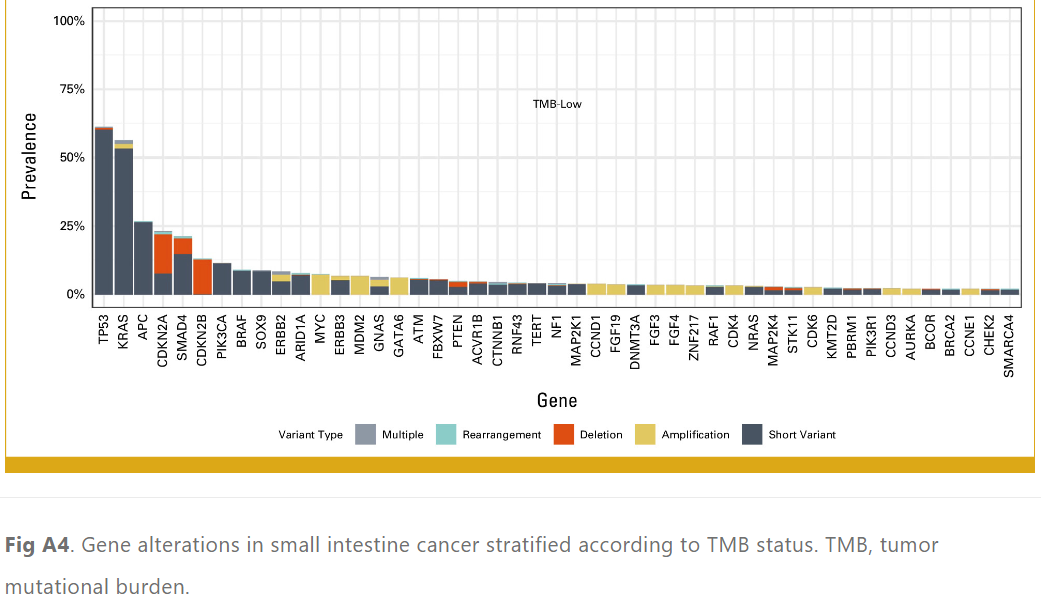
图A4
小肠癌中的其他基因变异:
对于存在MDM2扩增的癌症类型,有人提出MDM2抑制剂可能是有前途的治疗药物。在本研究的队列中,5.9%的患者 (n = 81) 观察到MDM2扩增。在这些患者中,92.6%的患者 (n = 75;附录图A5 ) 为TP53野生型。
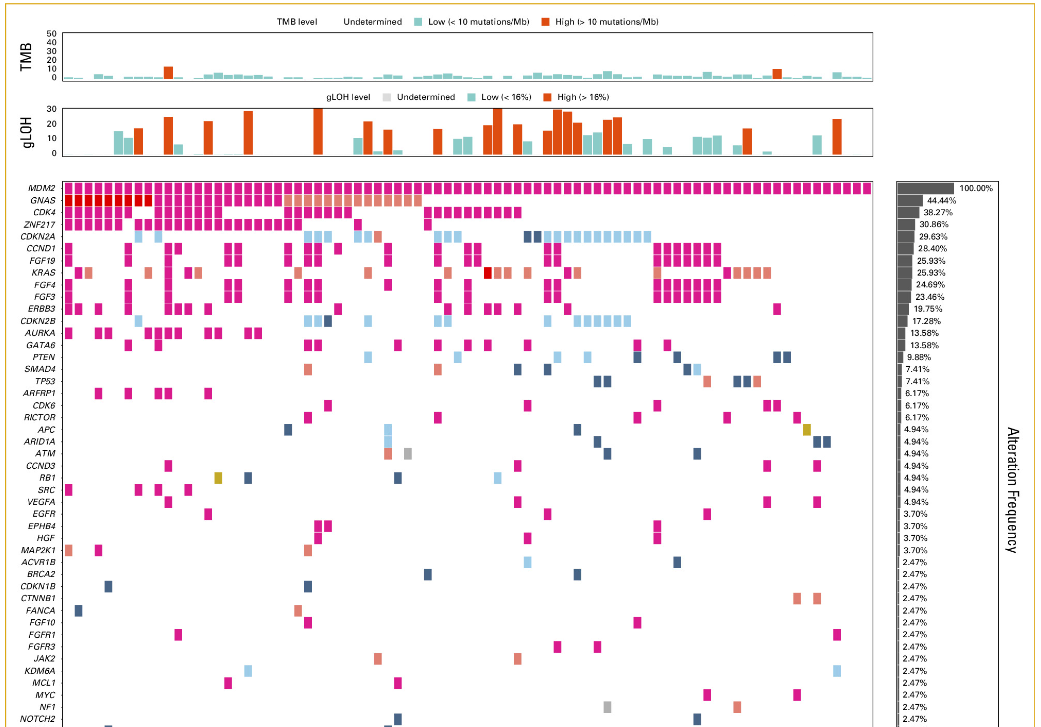


图A5
4.8%的患者 (n = 66) 观察到BRCA1/2变异。在BRCA1/2变异的小肠癌患者中,39.3% (n = 26) 的患者TMB较高 (≥10 mut/Mb),发病率高于总体人群 (附录图A6 )。在25例进行杂合性缺失分析的病例中,分别在8例、6例和11例患者中观察到双等位基因/单等位基因/未知状态,全基因组杂合性缺失评分中位数分别为27.7%、5.5%和2.4%。


图A6
不同年龄段亚组的可用药物基因变异分析:
22.3%的患者被检测到可用药物治疗的基因变异。这些变异包括BRAF V600E(1.2%)、BRCA1(1.8%)、BRCA2(3.2%)、ERBB2扩增(3.2%)、KRAS G12C(3.3%)、NTRK1/2/3重排/融合(0.07%)、MSI-H(7.0%)和TMB-H(12.2%;表2;图4)。BRAF非V600E(7.5%)也被检测到,作为可用药物治疗的基因变异。
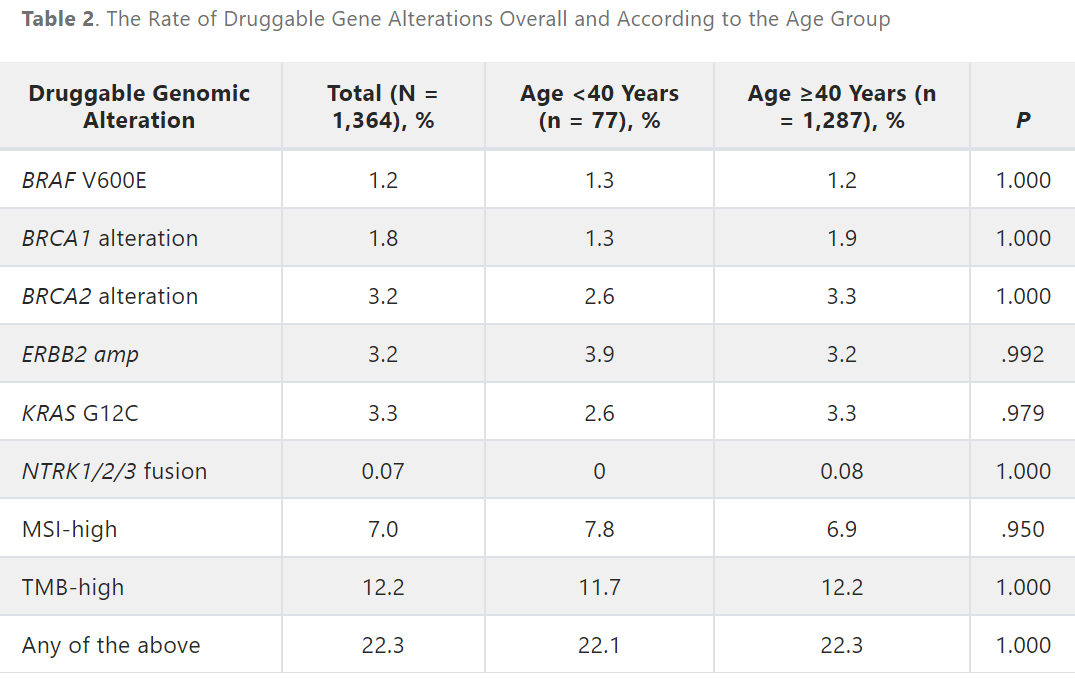
表2
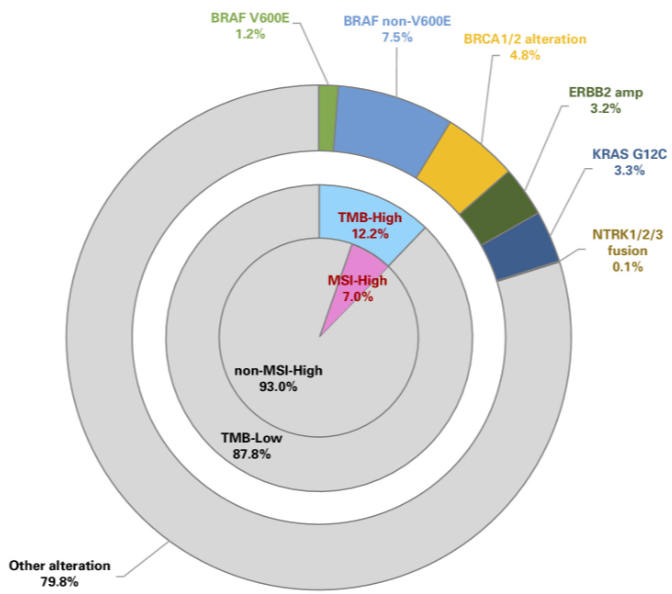
图4
以40岁为界,将患者分为两个年龄组,其中77名患者年龄小于40岁。40岁以下患者(AYA 患者)的APC突变频率明显低于40岁及以上患者(10.4% vs 28.7%;P = .0008;表1;附录图A7)。两个年龄组中均有超过20%的患者检测到可用药物治疗的基因变异,两组之间的基因变异频率无显著差异(表2)。
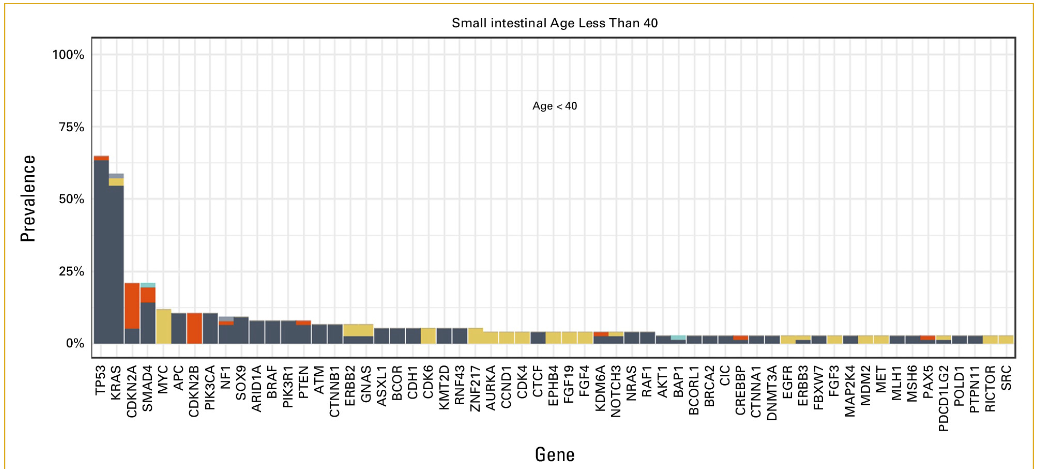
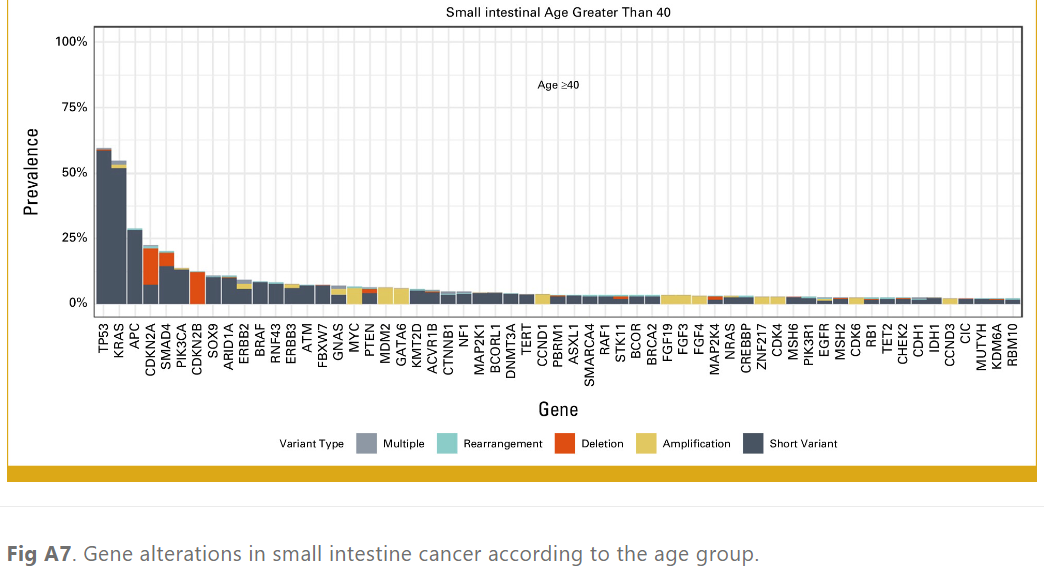
图A7
讨 论
从1364例小肠癌患者中获得的RWD分析发现了可用药物治疗的变异,在AYA和老年患者人群中具有相似的频率。按亚组(MSI-H、TMB-H、KRAS变异)分层时,观察到基因变异存在显著差异。
研究者发现22.3%的小肠癌患者存在可用药治疗的变异。Schrock等人报道,在317名小肠癌患者的基因组分析数据中,91%的患者存在潜在可用药治疗的变异。这些潜在可用药治疗的变异包括ATM(7.6%)、BRAF(9.1%)、CTNNB1(5.7%)、ERBB2/HER2(9.5%)、ERBB3(6.3%)、FBXW7(6.9%)、MDM2(5.7%)、NF1(6.0%)、PIK3CA(16.1%)和PTEN(5.7%)。发生率的差异可能源于“可用药治疗”的定义。在本文中,研究者在更大样本量中,基于对现有已批准疗法的保守定义,将BRAF V600E、BRCA1/2、ERBB2扩增、KRAS G12C、NTRK1/2/3融合、MSI-H和TMB-H视为可通过药物治疗的基因变异。在本研究中,上述潜在可用药治疗的变异包括ATM(7.3%)、BRAF(8.5%)、CTNNB1(4.6%)、ERBB2/HER2(8.9%)、ERBB3(7.4%)、FBXW7(7.0%)、MDM2(5.9%)、NF1(4.8%)、PIK3CA(13.3%)和PTEN(6.3%),其发生率与Schrock等人报道的相似(图1)。
虽然之前研究的病例与本研究有部分重叠,但本研究的创新之处在于与早期研究相比,研究者对更大的队列进行了全面分析。这使得研究者能够根据年龄、MSI状态、TMB状态和基因状态等因素对有临床意义的亚组进行详细调查。具体而言,在年轻患者中,APC突变的频率较低。在MSI-H亚组中,观察到PIK3CA和ERBB2变异的频率较高,而在TMB-H组中,PIK3CA突变的频率较高。没有KRAS SV的患者ERBB2和BRAF变异的检出率更高。此外,具有BRCA1/2突变的亚组显示出 TMB-H频率更高的趋势。
在这项研究中,7.0%的患者患有MSI-H,12.2%患TMB-H。Schrock等人报告了相似的发生率,7.6%的MSI-H和9.5%的TMB-H。据报道,在晚期和早期小肠癌中,MSI-H的发生率都很高。本研究中的基因组分析是在常规临床护理期间进行的,通常用于晚期情况。MSI-H的频率为7.0%,在之前报告的范围内。先前的研究表明,在小肠癌中,TMB趋于随着年龄的增长而增加;然而,在这项研究中,当截止年龄设定为40岁时,未发现不同年龄组TMB-H的频率存在差异。当患者以40岁为截止年龄进行分层时,除了NF1和APC基因变异的频率外,两组之间的基因组谱无显著差异,并且各可用药基因变异的频率无显著差异。这表明,在晚期小肠癌中,无论年龄大小,基因组图谱都没有重大差异,旨在确定治疗靶点的基因组图谱检测可使广泛的年龄组受益。
小肠癌的基因组图谱与胃癌和结直肠癌相比具有明显的特点,其中APC突变在小肠癌中的发生率低于结直肠癌,但高于胃癌。同样,KRAS突变在小肠癌中的发生率高于胃癌,而TP53突变的发生率低于结直肠癌,这与之前的研究结果一致。
尤其重要的是小肠癌和结直肠癌之间BRAF突变类型的多样性。在本研究中,8.7%(119/1364)的小肠癌患者观察到BRAF变异,V600E和V600R突变(相当于BRAF 1类)的频率为15%(18/119)。BRAF突变的位点与结直肠癌明显不同,结直肠癌中大多数BRAF突变为 1 类。Schrock 等人报告称9.1%的小肠腺癌患者(29/317)观察到BRAF变异,V600E突变的频率为10.3%(3/29)。Hänninen等人对106名小肠癌患者进行了外显子组数据分析,所有11名观察到BRAF变异的患者均存在非V600E变异。这些数据表明小肠癌中的BRAF变异主要是非V600E变异。有人提出根据激酶活性和RAS依赖性将BRAF变异分为三类。在本研究的大规模RWD中,大多数BRAF变异为2类和3类,这些2/3类变异经常与KRAS变异同时发生。据研究者所知,这是小肠癌中首次报道的关联。BRAF非V600E变异的治疗方法正在开发中,有研究表明,对于2类和3类,有效的治疗策略有所不同。在少数非V600E变异的黑色素瘤中,已发现使用MEK抑制剂单药治疗有相当好的反应,有研究表明,其有效性因BRAF激酶活性的程度而异。在小肠癌中,尚未报道对BRAF非V600E变异和V600E变异有效的药物。此外,使用MAPK通路抑制剂等治疗对KRAS共变异的影响尚未被描述。因此,BRAF变异的小肠癌的治疗方法仍在开发中,这些RWD有望作为未来临床开发的背景。
KRAS G12C变异的选择性抑制剂已显示出对多种癌症的疗效,包括肺癌和结直肠癌,KRAS G12C的基因组分析也引起了人们的关注。先前对多种癌症类型的KRAS分析报告显示,9%的肺癌患者、3.2%的结直肠癌患者和1.3%的胰腺癌患者中观察到KRAS G12C。在本研究中,3.3%的小肠癌患者观察到KRAS G12C突变,这强调了旨在研究KRAS G12C的基因组分析的重要性。
本研究有几个局限性。首先,病例是在基因组分析数据的基础上积累的,因此缺乏临床数据,例如分期和治疗史,并且尚未评估临床信息与基因组数据之间的关系。其次,作为本分析基础的数据库仅限于那些已订购基因组分析的数据库;这可能会偏向更晚期或侵袭性的肿瘤。最后,基因组分析仅限于324个癌症相关基因。更广泛的分析(例如全外显子组测序)可能会识别出其他潜在的靶向治疗基因。
综上所述,研究者描述了小肠癌的基因组图谱,并根据亚组确定了变异的差异。据研究者所知,这些RWD是迄今为止最大的小肠癌基因组分析报告。本研究的结果提供了小肠癌的临床参考数据,并有助于研究治疗方法的发展方向。
参考文献:
Hiroyuki Takeda et al., Genomic Profiling of Small Intestine Cancers From a Real-World Data Set Identifies Subgroups With Actionable Alterations. JCO Precis Oncol 8, e2300425(2024). DOI:10.1200/PO.23.00425