多形性胶质母细胞瘤(GBM)中浸润大量肿瘤相关巨噬细胞(TAM),具有抑炎性M2表型的TAM(M2-TAM)通过多种途径促进GBM发展,侵袭与免疫抑制微环境的形成。此外,M2-TAM是导致GBM对于一线化疗药物替莫唑胺(TMZ)治疗抵抗的重要因素之一,因此靶向调节M2-TAM对提高GBM的预后具有重要的意义。然而,血脑屏障(BBB)的存在极大地限制了药物向脑部的递送及其在GBM部位的浓度。基于受体介导跨BBB转运机制开发的脑靶向纳米递药系统是有效的策略之一,然而受体-配体亲和力过强往往会导致纳米递药系统滞留在脑内皮细胞中,而无法有效跨过BBB。此外,大多数受体在BBB两侧(血液侧与脑实质侧)均有表达,导致纳米递药系统在进入脑实质后重新结合近脑侧的受体而反向外排到血液中。上述两个科学问题共同导致了纳米递药系统在GBM部位蓄积量低,从而无法最大限度的发挥药物的治疗潜力。
鉴于此,北京理工大学阮少波教授和黄渊余教授等人设计了一种pH响应的双靶头修饰的分级脑靶向胶束递药系统,负载TMZ和免疫调节剂瑞奎莫德(R848)。该刺激响应性脑靶向递药系统(PCPA&PPM@TR)能够实现高效跨BBB转运以及精准GBM药物递送,并通过化疗-免疫联合治疗,有效将M2-TAM重编程至促炎性M1表型的TAM(M1-TAM),并显著抑制GBM生长。相关工作以“Targeted Reprogramming of Tumor-Associated Macrophages for Overcoming Glioblastoma Resistance to Chemotherapy and Immunotherapy”为题发表在Biomaterials。

如图1所示,利用不同分子量的PEG形成了双层配体的纳米胶束PCPA&PPM@TR。外层修饰的Angiopep-2用于识别BBB内皮细胞上高表达的低密度脂蛋白受体相关蛋白1(LRP1),通过受体介导的跨膜转运(RMT)机制高效跨越BBB。pH响应单元增加了纳米胶束在内皮细胞溶酶体的逃逸能力并进入脑实质,同时实现去Angiopep-2配体修饰,阻断了纳米颗粒通过脑实质侧LRP1介导外排。当纳米胶束进入大脑后,暴露的内层配体甘露糖类似物(4α-D-Mannose)增加了体系对GBM和TAM细胞的亲和力。双层靶头实现了对肿瘤的程序性靶向递药,pH响应系统增加了药物在肿瘤区域的富集。
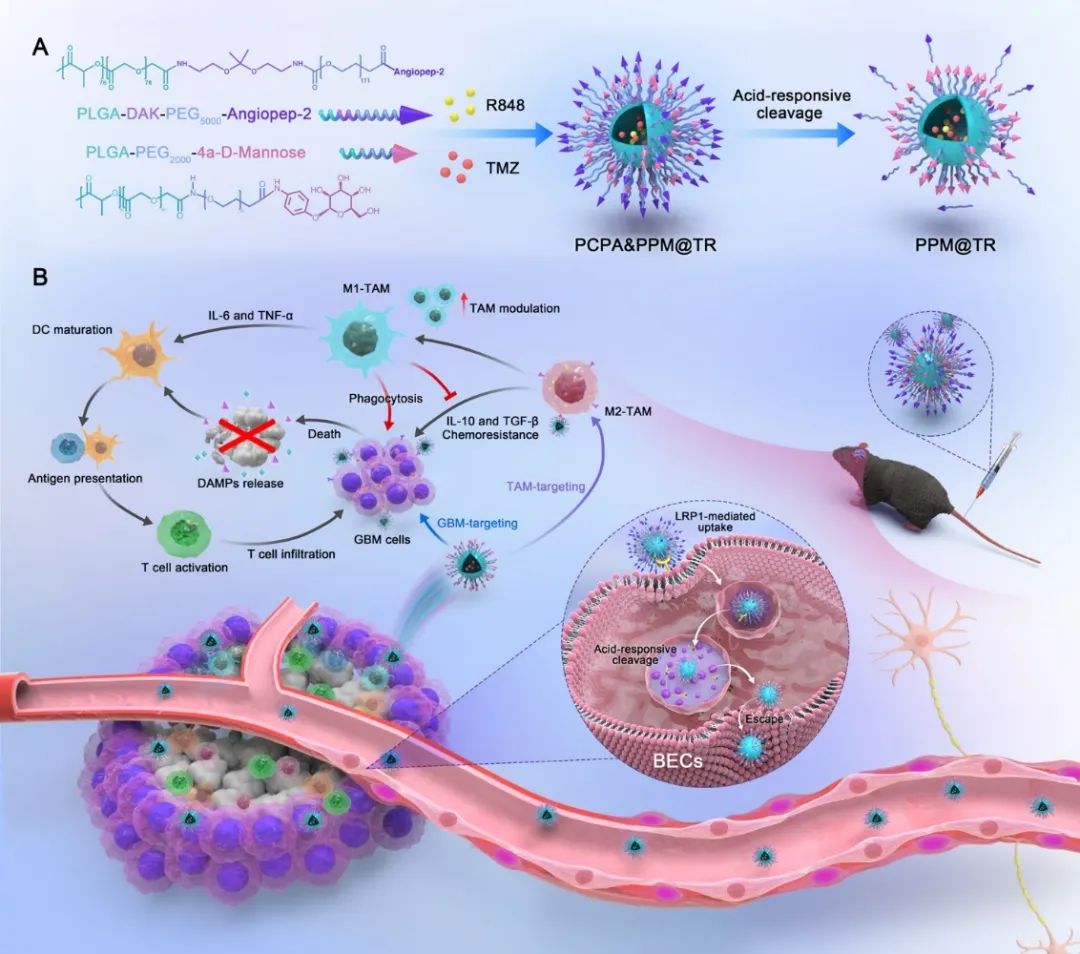
图1 PCPA&PPM@TR
相较于PNPA&PPM@TR(无pH响应能力),PCPA&PPM@TR显著增加了胶束在bEnd.3细胞中的逃逸能力。通过三维重现,观察到PCPA&PPM@TR在bEnd.3细胞层具有更深的穿透能力。(图2)
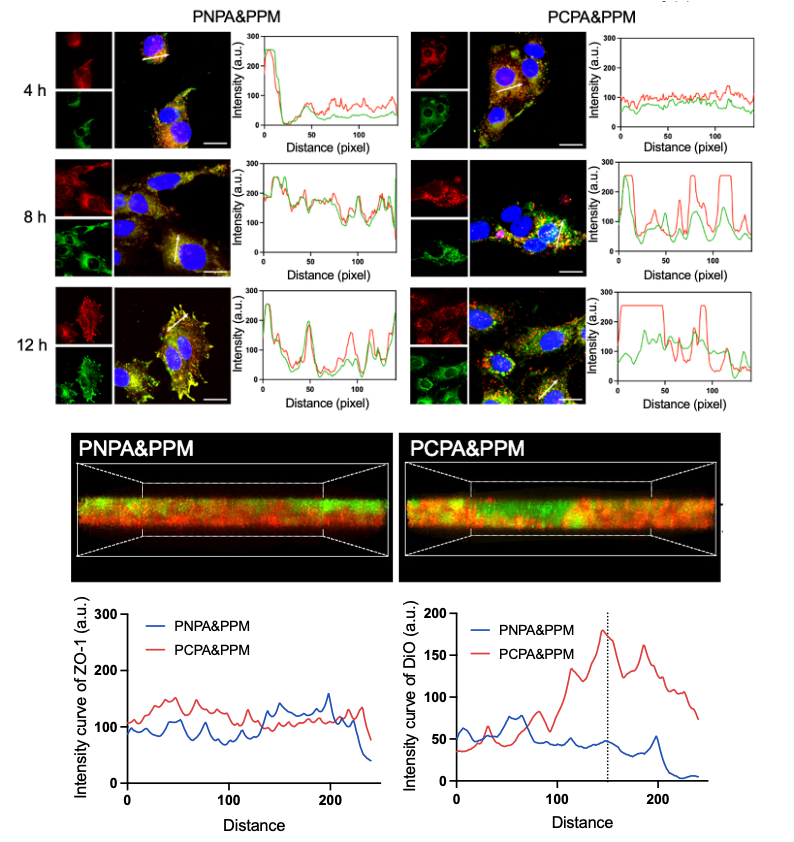
图2 体外溶酶体逃逸和BBB跨越能力评估
与PCPA&PPM@T组、PCPA&PPM@R组相比,PCPA&PPM@TR在小鼠原位脑胶质瘤模型中具有优越的治疗效果。TMZ抑制肿瘤细胞增殖并引起免疫原性细胞死亡(ICD)效应,刺激抗原呈递细胞成熟。R848用于重编程M2-TAM以及刺激DC细胞成熟,促使巨噬细胞发挥抗肿瘤功能,吞噬肿瘤细胞。激活的树突状细胞可有效呈递肿瘤相关抗原,激活适应性细胞免疫力。此外,改善的肿瘤免疫抑制微环境克服了GBM对于TMZ治疗以及TMZ诱导的抗肿瘤免疫治疗的抗性。体内抗肿瘤结果表明TMZ与R848的联用协同增强对GBM的抑制效果。此外,PCPA&PPM@TR具有较好的生物安全性,并且避免了TMZ系统给药对小鼠睾丸的毒性。(图3)
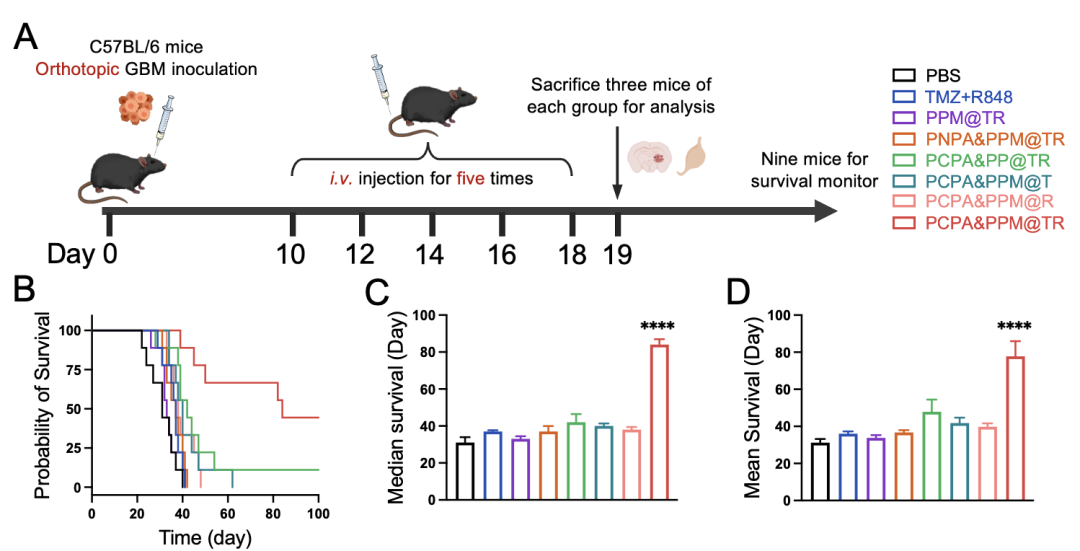
图3 动物治疗方案