引言
在许多疾病的诊断过程中,由于缺乏疾病发生的客观生物标志物,诊断常常延迟。精准医学的核心挑战之一是开发临床上有用的工具来识别高风险个体,这有助于及时诊断、早期治疗和改善患者预后。
目前,心脏病和中风等疾病的发病风险预测工具已被广泛应用,但其他许多疾病的风险预测工具尚未普及。不同疾病的诊断延迟从症状初现到最终确诊可能长达数月或数年。近年来,单一血浆蛋白已经被确立为某些疾病的特异性诊断检测指标,例如心力衰竭的B型钠尿肽(BNP)、急性冠状动脉综合征的肌钙蛋白以及创伤性脑损伤中的泛素C末端水解酶L1(UCH-L1)和胶质纤维酸性蛋白(GFAP)。宽范围捕获的血浆蛋白质组学能够估算数千种蛋白质,并进行不局限于单一疾病的无偏发现研究,是加速解决这一挑战的有前景的技术。血浆蛋白质组特征能够捕捉健康行为和当前的健康状态,可能整合‘静态’的遗传和‘动态’的环境决定因素的风险。
7月22日Nature Medicine的研究报道“Proteomic signatures improve risk prediction for common and rare diseases”,研究团队在英国生物银行的Pharma Proteomics项目中,整合了41,931名个体的约3,000种血浆蛋白的测量数据与临床信息,建立了针对218种常见和罕见疾病(病例数在81至6,038之间)的10年发病率预测模型。研究发现,包含仅5到20种蛋白质的模型在67种病理多样性疾病中,其预测性能优于仅使用基础临床信息的模型。对于包括多发性骨髓瘤、非霍奇金淋巴瘤、运动神经元疾病、肺纤维化和扩张型心肌病在内的52种疾病,蛋白质模型的预测性能也优于结合临床检测数据和基础信息的模型。多发性骨髓瘤的单细胞RNA测序显示,在新诊断患者的骨髓中,五种预测蛋白中的四种特异性表达在浆细胞中,这与这些蛋白的强大预测能力一致。该蛋白质模型在EPIC-Norfolk研究中的外部验证显示,六种疾病的预测具有良好的泛化能力。这些发现表明,血浆蛋白质特征,包括疾病特异性蛋白和多种疾病共用的蛋白预测因子,能够对常见和罕见疾病进行临床上有用的预测。
这些蛋白质特征在临床实践中表现出了优于传统方法的预测能力,为早期诊断和治疗提供了新的可能性。未来,血浆蛋白质组学技术在常见和罕见疾病的风险预测和诊断中的应用将不断扩大和深入。

疾病的早期诊断对改善预后和减少医疗负担至关重要。然而,许多疾病由于缺乏早期生物标志物,诊断往往被延迟。心脏病和中风等疾病的风险预测工具已经被广泛应用,但其他许多疾病的风险预测工具尚未普及。近年来,单一血浆蛋白如B型钠尿肽(BNP)、肌钙蛋白(Troponin)和泛素C末端水解酶L1(UCH-L1)等已被确立为某些疾病的诊断标志物。蛋白质组学技术通过宽范围捕获数千种蛋白质,为无偏发现研究提供了可能性,并有助于识别多种疾病的早期风险标志物。
该研究利用了英国生物银行(UK Biobank)Pharma Proteomics项目的数据,这是迄今为止最大的蛋白质组学实验。研究目标包括:(1)系统地探讨可测量的血浆蛋白质组在10年内对218种疾病的预测潜力;(2)识别疾病特异性蛋白质预测因子及其潜在机制;(3)评估蛋白质组特征在疾病筛查中的效用。
研究中使用的样本来自约54,000名UK Biobank参与者的EDTA血浆样本,利用Olink Explore 1536和Explore Expansion平台进行蛋白质组学分析,这些平台能够捕捉2,923种独特的蛋白质。通过LASSO回归分析和正则化Cox模型,研究团队开发了包含5至20种蛋白质的预测模型。模型的性能通过1,000次自助法进行估计,并与基于基础临床信息和37项临床检测数据的模型进行了比较。
为了验证模型的普遍性,研究还在EPIC-Norfolk研究中对模型进行了外部验证。EPIC-Norfolk研究包含295至1,116名参与者,这些参与者中有5至236个病例在10年随访期间确诊。
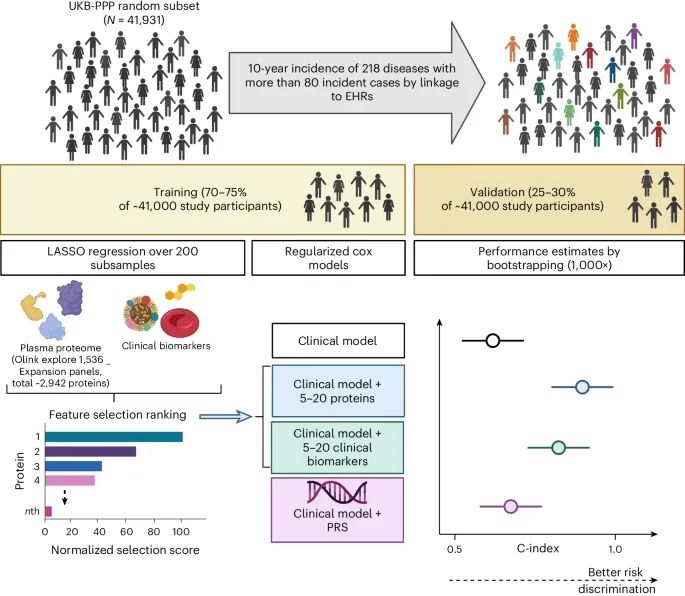
研究设计(Credit: Nature Medicine)
样本和数据收集:研究从UK Biobank的随机子集中选择了41,931名参与者,收集了他们的EDTA血浆样本并进行了蛋白质组学分析。
数据分析流程:研究采用了LASSO回归和正则化Cox模型,通过200次子样本化选择特征,并最终建立了稀疏预测模型。模型的性能通过1,000次自助法进行估计。
性能比较:研究将包含5至20种蛋白质的模型与仅使用基础临床信息的模型,以及结合临床检测数据的模型进行了比较。
外部验证:在EPIC-Norfolk研究中,对模型进行了外部验证,以评估其泛化能力。
研究结果显示,蛋白质模型在67种疾病中表现出优于仅使用临床信息的模型的预测性能。具体来说,对于多发性骨髓瘤(MM)、非霍奇金淋巴瘤(NHL)、运动神经元疾病(MND)、肺纤维化和扩张型心肌病等52种疾病,蛋白质模型的预测性能优于结合临床检测数据和基础信息的模型。以多发性骨髓瘤为例,单细胞RNA测序(scRNA-seq)显示,新诊断患者骨髓中的预测蛋白(FCRLB、QPCT、SLAMF7和TNFRSF17)主要在浆细胞中表达,这与这些蛋白的强大预测能力一致。
模型中的五种至二十种蛋白质比单一蛋白质的预测性能更优越。研究显示,对于包括多发性骨髓瘤、非霍奇金淋巴瘤、运动神经元疾病、肺纤维化和扩张型心肌病在内的52种疾病,蛋白质模型的预测性能也优于结合临床检测数据和基础信息的模型。例如,多发性骨髓瘤(MM)的蛋白质模型中,预测蛋白(FCRLB、QPCT、SLAMF7和TNFRSF17)在新诊断患者的骨髓中主要表达在浆细胞中,这与这些蛋白的强大预测能力一致。
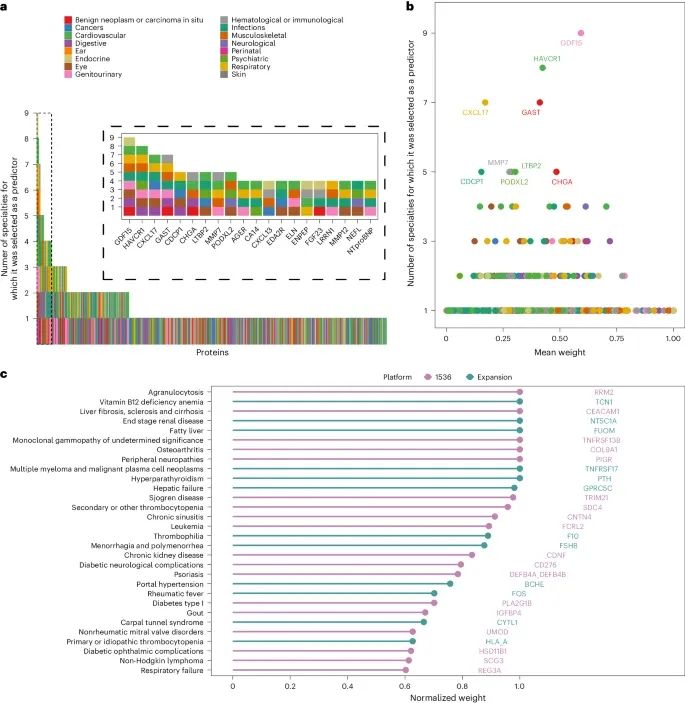
预测蛋白的疾病特异性(Credit: Nature Medicine)
蛋白质的疾病特异性:研究中发现某些蛋白质在多个疾病中被选为预测因子,这表明这些蛋白质具有广泛的适用性。例如,胃泌素(Gastrin)不仅与消化系统疾病相关,还与维生素缺乏、骨质疏松、感染和急性肾损伤等多种疾病相关。
疾病专一性蛋白质:图中展示了那些仅在一种疾病中被选为预测因子的蛋白质。例如,TNFRSF17被证明是多发性骨髓瘤(MM)的特异性预测因子,而TNFRSF13B则是单克隆丙种球蛋白病(MGUS)的强预测因子,这些蛋白质的高水平与未来这些血液肿瘤的发病密切相关。
在EPIC-Norfolk研究中的外部验证显示,六种疾病的预测具有良好的泛化能力,这些疾病包括心脏病、癌症和肺纤维化等。蛋白质特征能够对这些疾病进行有效预测,提供了早期诊断和干预的可能性。例如,对于多发性骨髓瘤,研究建议在早期实施抗TNFRSF17药物治疗,这可能有助于改善患者的长期预后。
该研究表明,血浆蛋白质组学在疾病风险预测中的潜力巨大。蛋白质模型不仅在常见疾病中表现出色,在许多罕见疾病中也显示出较高的预测能力。这些蛋白质模型可以帮助识别高风险个体,为早期干预提供依据。例如,对于多发性骨髓瘤,研究建议在早期实施抗TNFRSF17药物治疗,这可能有助于改善患者的长期预后。
未来,蛋白质组学技术在临床实践中的应用将不断扩大和深入。随着技术的进步和数据的积累,蛋白质组学有望成为疾病早期预测和诊断的重要工具,为精准医学的发展提供新的动力。
总之,该研究结果强调了血浆蛋白质组学在疾病风险预测中的重要性,特别是在识别高风险个体和促进早期干预方面。蛋白质模型展示了其在临床应用中的巨大潜力,有望为疾病的早期诊断和治疗提供新的解决方案。
参考文献
Carrasco-Zanini J, Pietzner M, Davitte J, Surendran P, Croteau-Chonka DC, Robins C, Torralbo A, Tomlinson C, Grünschläger F, Fitzpatrick N, Ytsma C, Kanno T, Gade S, Freitag D, Ziebell F, Haas S, Denaxas S, Betts JC, Wareham NJ, Hemingway H, Scott RA, Langenberg C. Proteomic signatures improve risk prediction for common and rare diseases. Nat Med. 2024 Jul 22. doi: 10.1038/s41591-024-03142-z. Epub ahead of print. PMID: 39039249.
https://www.nature.com/articles/s41591-024-03142-z