表观遗传药物(表观药物)可以破坏癌症细胞并启动先天免疫和适应性免疫,但迄今为止,它们在实体瘤中取得的成功非常有限,部分原因是它们同时诱导了骨髓源性抑制细胞(MDSC)群。
在本研究中,上海交通大学医学院宋海云教授和上海师范大学陈楠教授等人开发了可解离连体纳米颗粒(SIANP),用于肿瘤细胞靶向递送表观药物CM-272和MDSC靶向递送小分子抑制剂伊布替尼(IBR)。SIANP通过颗粒间DNA退火组装,并通过肿瘤微环境触发的链断裂行为进行分离。这种二元调控诱导肿瘤细胞中内源性逆转录病毒表达和免疫原性细胞死亡,同时抑制MDSCs的免疫抑制作用,并协同促进树突状细胞成熟和CD8+T细胞活化以抑制肿瘤。值得注意的是,通过SIANP进行的免疫微环境重塑进一步克服了肿瘤对免疫检查点阻断治疗的耐药性。该研究代表了一种协调免疫反应的新方法,并为在癌症免疫疗法中使用表观药物铺平了新的道路。相关工作以“Unzippable Siamese Nanoparticles for Programmed Two-Stage Cancer Immunotherapy”为题发表在Advanced Materials。

【文章要点】
在这里,作者开发了一种非共价的连接的和ATP响应的连体NP(SIANP),其由靶向肿瘤细胞的NP、靶向MDSC的NP和结合ATP适体的颗粒间DNA链组成。其中,介孔二氧化硅纳米颗粒(MSNs)用于封装CM-272 (272@MSNs),而4T1小鼠TNBC细胞则进一步用于制备细胞膜伪装的272@MSNs (272@MM)。该NP表面进一步用(i)pH低插入肽(pHLIP)进行功能化,其可感应肿瘤细胞附近的弱酸性以形成跨膜螺旋并促进NP对接,以及(ii)包埋有ATP结合适体的ssDNA序列(272@MMP)。同时,作者还使用卵清蛋白NPs(ONs)封装IBR(IBR@ONs),然后用MDSC衍生的细胞膜进行表面涂层化,并用与ATP结合适体互补的ssDNA进行装饰形成最终的IBR@OM(图1)。
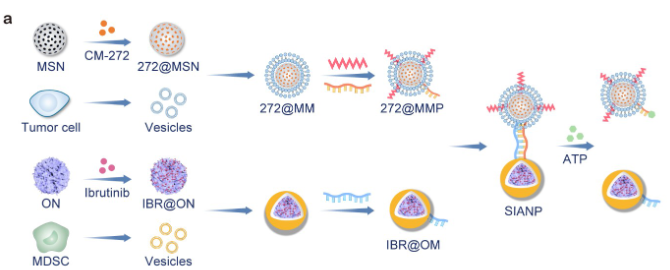
图1 两种NP及其连体形式的制备
这两种NP通过表面修饰的互补单链DNA(ssDNA)序列的杂交相互连接,可在TME中对高水平的细胞外ATP的反应中断开连接。断开连接后,一方面,肿瘤细胞内化的NP释放组蛋白甲基转移酶G9a抑制剂CM-272以激活ERV表达并产生ICD,刺激先天和适应性免疫反应;另一方面,MDSC内化的NP携带用于MDSC重编程的Bruton酪氨酸激酶抑制剂IBR,可减轻免疫抑制。在三阴性乳腺癌小鼠模型中,研究发现SIANP的静脉给药可防止CM-272诱导的MDSC扩增,并对DC成熟、CD8+T细胞募集和激活以及肿瘤抑制表现出协同作用。值得注意的是,通过SIANP治疗的TME重塑进一步克服了肿瘤对免疫检查点阻断(ICB)治疗的耐药性(图2)。
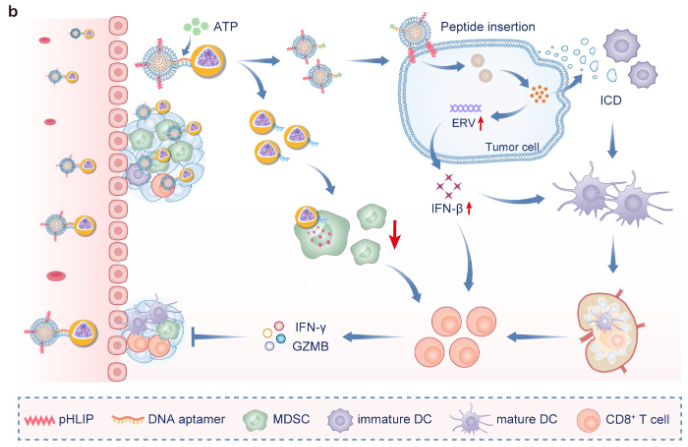
图2 抗肿瘤治疗示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202402456