葡萄糖作为细胞生命的重要能量来源,在肿瘤细胞中扮演着尤为关键的角色。尤其是大多数肿瘤细胞,即便在富氧环境下,也通过所谓的瓦伯格效应(Warburg effect),利用糖酵解的方式产生能量,以满足其无休止的生长、侵袭和转移需求。高速率的有氧糖酵解导致肿瘤细胞从肿瘤微环境(TME)中吸收和消耗更多的葡萄糖,并产生大量乳酸。乳酸的累积导致TME的严重酸化,进而使免疫细胞失活,并促进肿瘤细胞的迁移、免疫逃逸和转移。葡萄糖的吸收和代谢是这种有氧糖酵解的关键限速步骤,因此,降低肿瘤中的葡萄糖水平可以抑制肿瘤的生长。
传统的饥饿疗法主要利用纳米药物催化葡萄糖或使用药物诱导的血栓来阻止肿瘤的营养供应。然而,这些平台对肿瘤的靶向效率低下,稳定性差,比如葡萄糖酶对葡萄糖的不可持续消耗,往往导致治疗效果不理想。在饥饿疗法中,利用具有快速消耗关键营养物质(如葡萄糖)特性的自然、自我复制的剂型,将是纳米酶和纳米药物的更好替代方案。近年来,基于微生物的癌症疗法因其独特的生理特性和多样化的功能已展现出令人瞩目的潜力,如易于基因操作、致病性、自主移动和组织穿透能力、肿瘤趋向性和侵袭性,以及调节肿瘤免疫微环境和诱导抗肿瘤免疫反应的能力。
近期,澳门大学王瑞兵教授团队在《Advanced Functional Materials》发表了题为“In Situ Colonization of Trojan-Yeast for Targeted Glucose Starvation and Reconstruction of Tumor Immune Environment”的工作。该研究开发出一种仿巨噬细胞酵母(M-yeast)的新型生物治疗载体。这种新型酵母,宛如特洛伊木马般的传递系统,能够在体内减少被网状内皮系统(RES)清除的可能性,增加了酵母在循环过程中的生物安全性,提高肿瘤内的积累和定植效率。

巨噬细胞膜的炎症归巢效应使得M-yeast能够高效地在肿瘤组织中定植,并与肿瘤细胞竞争葡萄糖代谢,从而干扰癌细胞的糖酵解过程,导致乳酸产量减少和肿瘤微环境酸中毒的逆转。随后,凋亡的肿瘤细胞和酵母共同促进了树突状细胞的成熟,并增加了肿瘤浸润性细胞毒性T淋巴细胞的数量。与此同时,酵母细胞壁和酵母通过葡萄糖代谢产生的产物,如乙醇和乙醛,能够重新极化肿瘤相关巨噬细胞(TAMs)至抗肿瘤表型(M1),从而重塑了肿瘤的免疫抑制微环境,与葡萄糖饥饿疗法共同产生协同的肿瘤抑制作用。
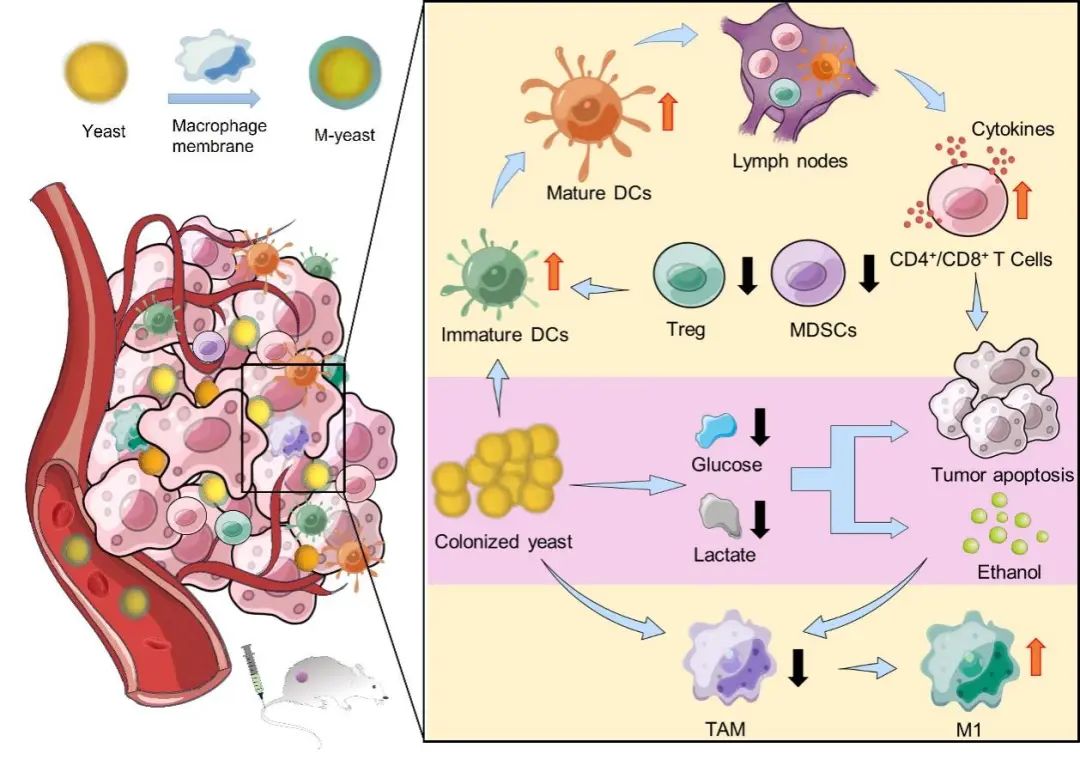
图1.仿巨噬细胞酵母靶向定植肿瘤部位诱导葡萄糖饥饿治疗以及免疫调节示意图。
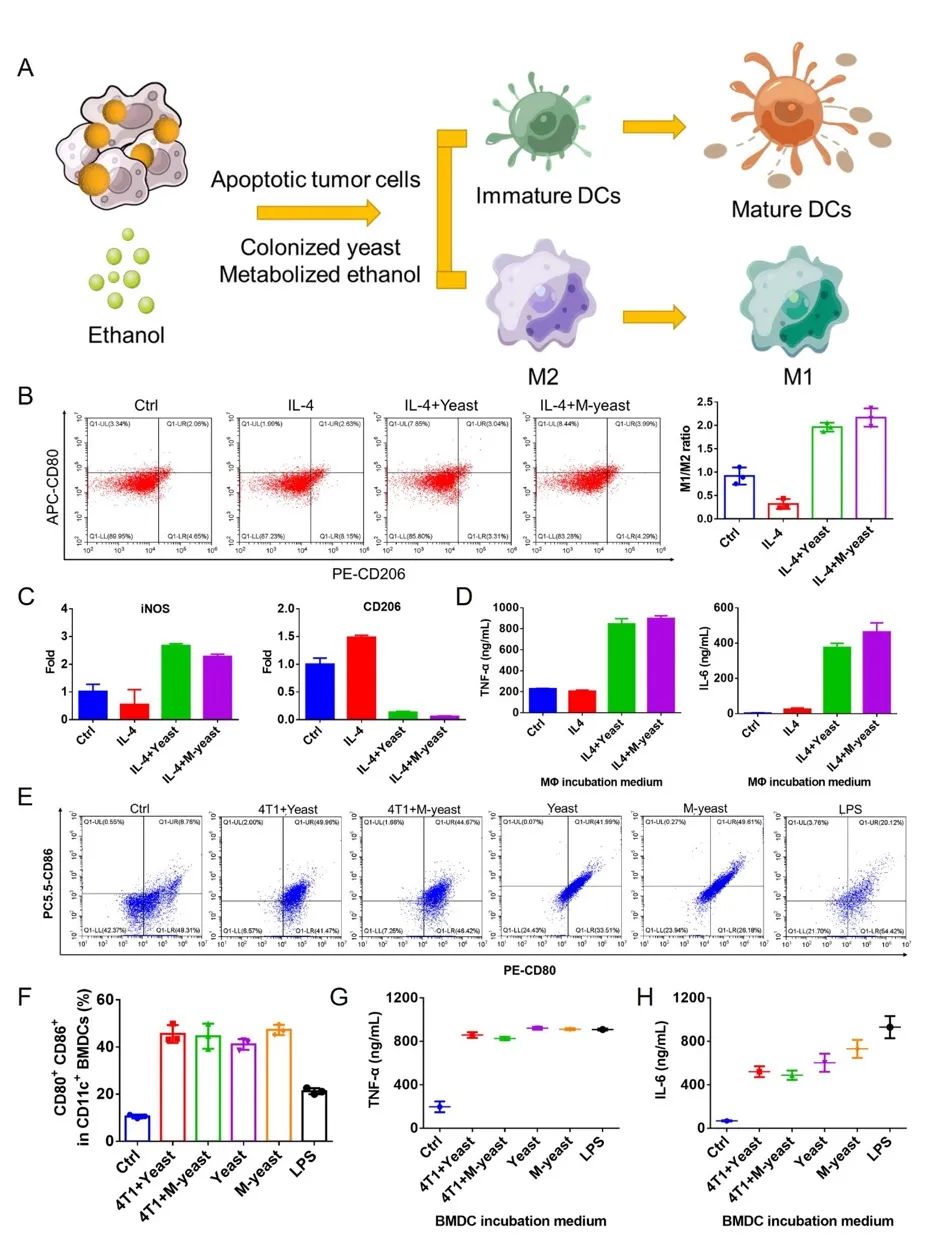
图2. 仿巨噬细胞酵母体外激活免疫细胞。
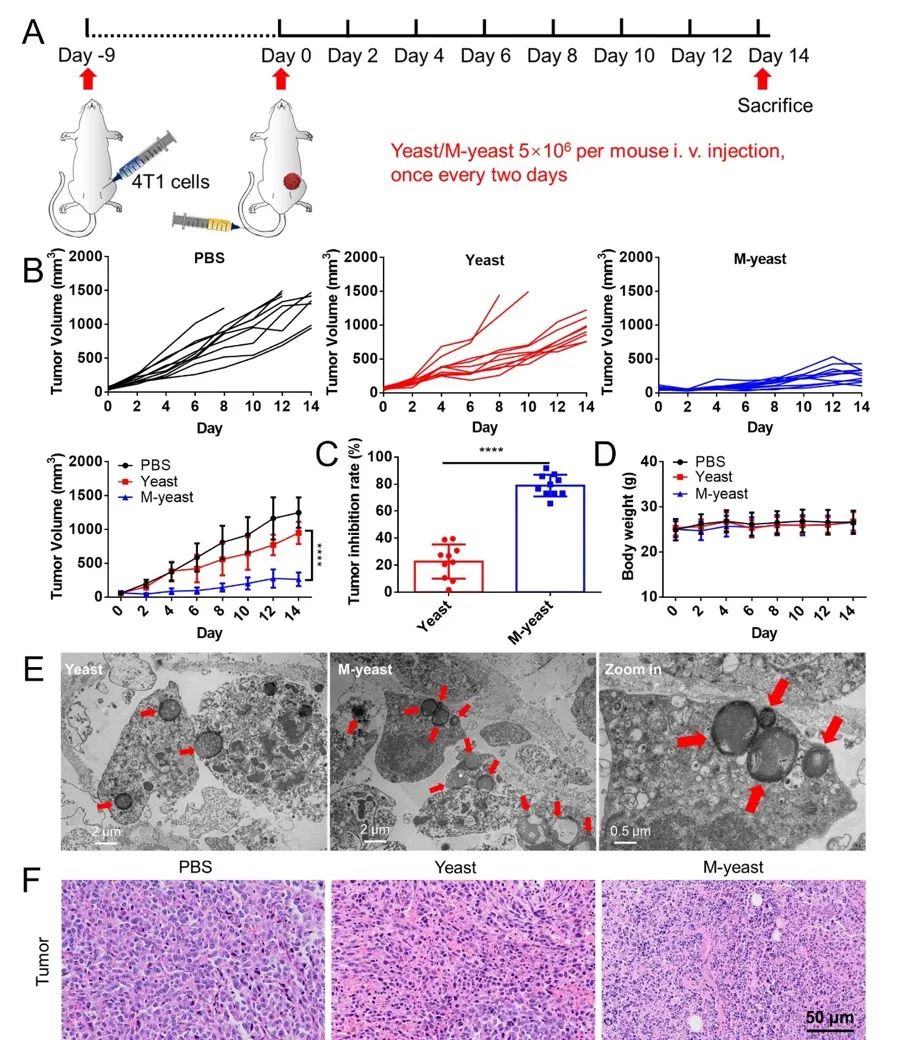
图3. 仿巨噬细胞酵母体内抗肿瘤疗效。
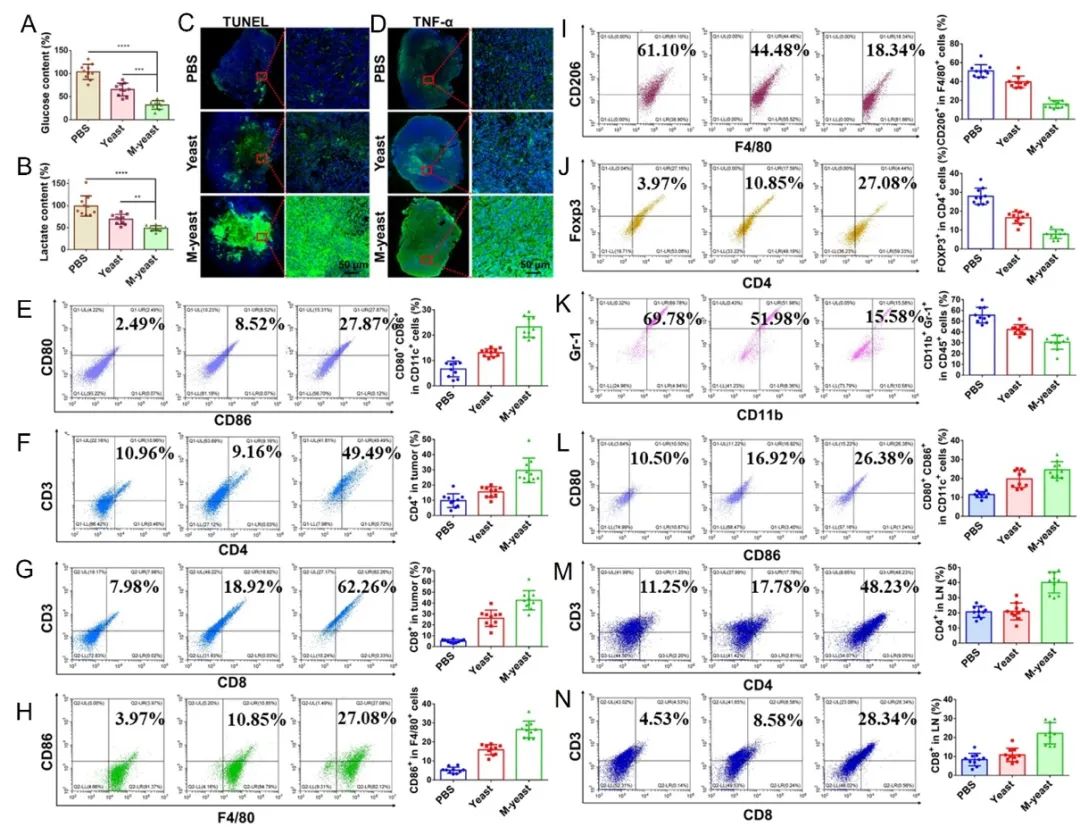
图4.仿巨噬细胞酵母重塑肿瘤免疫抑制微环境及作用机制研究。
研究团队发现,巨噬细胞膜包覆的酵母对酵母的增殖影响微乎其微,同时保留了其与癌细胞竞争葡萄糖消耗的能力,使得肿瘤细胞的葡萄糖摄取量减少,最终导致肿瘤细胞糖酵解紊乱,缓解了肿瘤微环境中的乳酸积累,并代谢产生乙醇。这些变化共同促进了树突状细胞的成熟,增加了肿瘤浸润的细胞毒性T淋巴细胞,并将肿瘤相关巨噬细胞(TAMs)重新极化为抗肿瘤表型(M1),同时下调了调节性T细胞(Tregs)和髓源抑制细胞(MDSCs)的活性。
这一系列的生物学效应导致了肿瘤免疫抑制微环境的重新编程,与葡萄糖饥饿疗法共同作用,实现了对肿瘤的协同抑制。该项工作为基于酵母的癌症疗法提供了新的范式,并为未来的肿瘤治疗研究开辟了新的方向。
澳门大学王瑞兵教授为该论文的通讯作者,成都中医药大学成谦副研究员为第一作者、澳门大学全兴萍博士和澳门大学罗锐锋博士为本论文的共同第一作者。本研究受到国家自然科学基金,澳门大学和深圳市科技创新委等项目资助,以及成都中医药大学动物中心的支持。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202316701