半胱氨酸组织蛋白酶是一个蛋白酶家族,可作为不同癌症和其他疾病的相关治疗靶点。然而,目前还没有临床批准的治疗这些蛋白质的药物,因为它们的全身抑制会引起有害的副作用。
为了解决这个问题,瑞士洛桑联邦理工学院Elisa Oricchio和Bruno E. Correia等人开发了一种基于抗体的模块化平台,通过将非天然肽抑制剂(NNPI)与抗体偶联来进行靶向药物递送。NNPI用反应弹头进行共价抑制功能化,再用深度饱和诱变进行优化,并与抗体偶联,以实现细胞类型特异性递送。该抗体-肽抑制剂缀合物特异性阻断了不同癌症细胞以及破骨细胞中组织蛋白酶的活性,并在体外和体内显示出优异的治疗效果。总体而言,该方法可快速设计选择性组织蛋白酶抑制剂,并可推广用于抑制癌症和其他疾病中的广泛蛋白酶。相关工作以“Antibody–peptide conjugates deliver covalent inhibitors blocking oncogenic cathepsins”为题发表在Nature Chemical Biology。

【文章要点】
为了限制与化疗相关的副作用,人们已将细胞毒性药物与抗体结合,以引导其递送。抗体-药物偶联物通过内吞作用进入细胞,并被运输到溶酶体并限制在溶酶体中,在那里它们被降解。然后,细胞毒性有效载荷从抗体中释放出来,离开溶酶体并到达胞质室发挥作用。除了这类经典抗体-药物偶联物组合外,还可以将抗体与靶向特定蛋白质的药物偶联。因此,作者在此创建一个模块化药物平台,将阻断半胱氨酸组织蛋白酶活性的非天然肽抑制剂(NNPI)与抗体偶联,以引导其递送到所需类型的靶细胞,从而产生抗体-肽抑制剂偶联物(APIC)(图1)。在本研究中,作者利用半胱氨酸组织蛋白酶保守的催化口袋设计了共价抑制剂,并开发了一个快速鉴定针对不同组织蛋白酶的选择性抑制剂的筛选平台。基于该平台,使用位点饱和诱变筛选,作者快速提高了NNPI的效力并实现了特异性。
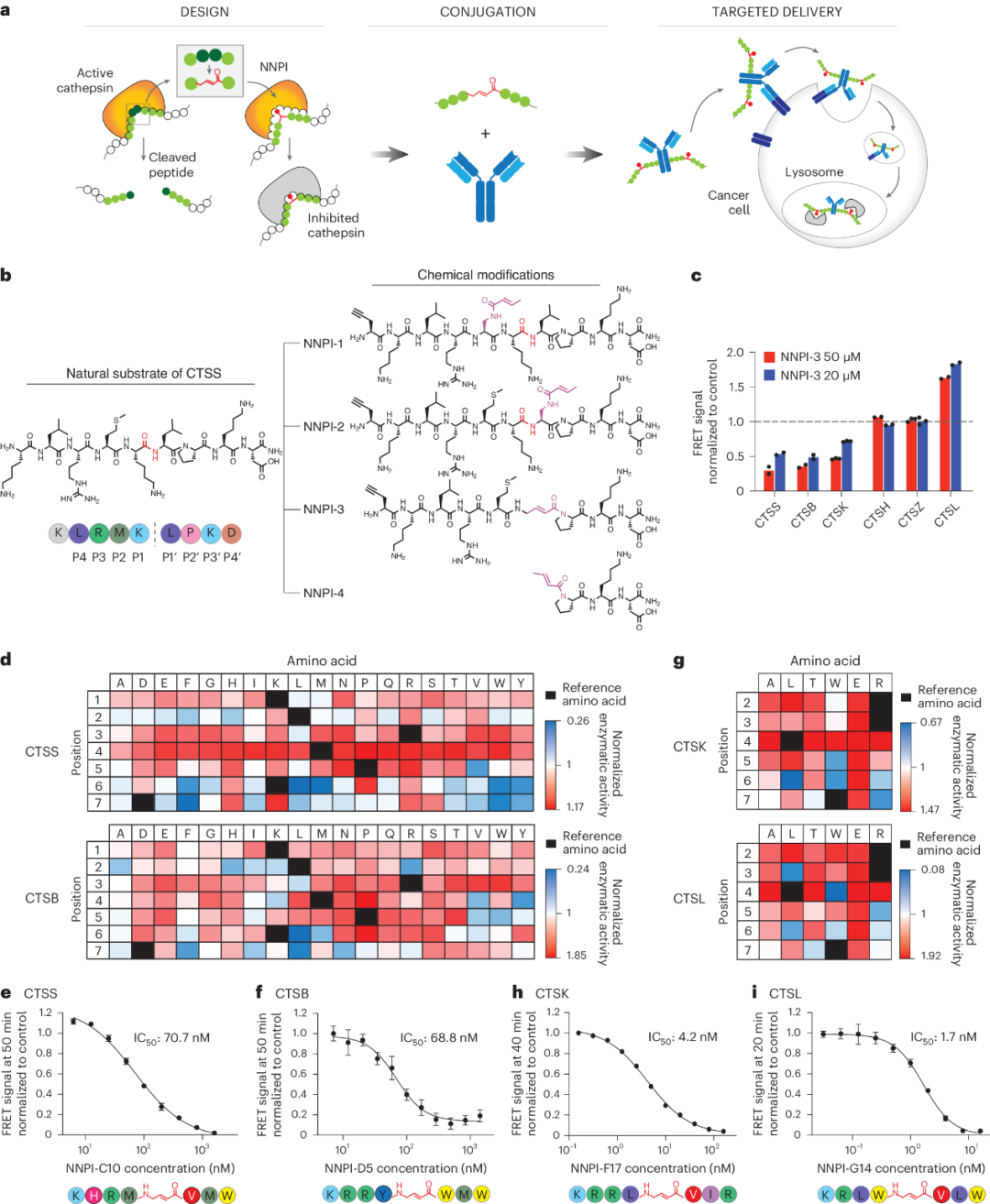
图1 NNPI的设计表征
更重要的是,通过这种方法,作者利用抗体在溶酶体中的自然运输和积累,将NNPI输送到半胱氨酸组织蛋白酶活性的区室。最终,作者通过用特异性抗体-NNPI组合靶向不同的组织蛋白酶,在不同的肿瘤类型中引发了治疗性抗肿瘤反应。此外,研究还证明,该模块化药物平台还可以通过靶向破骨细胞来治疗其他疾病,如骨质疏松症;对于自身免疫性疾病也可以通过调整NNPI和抗体的组合来实现同样的效果(图2)。
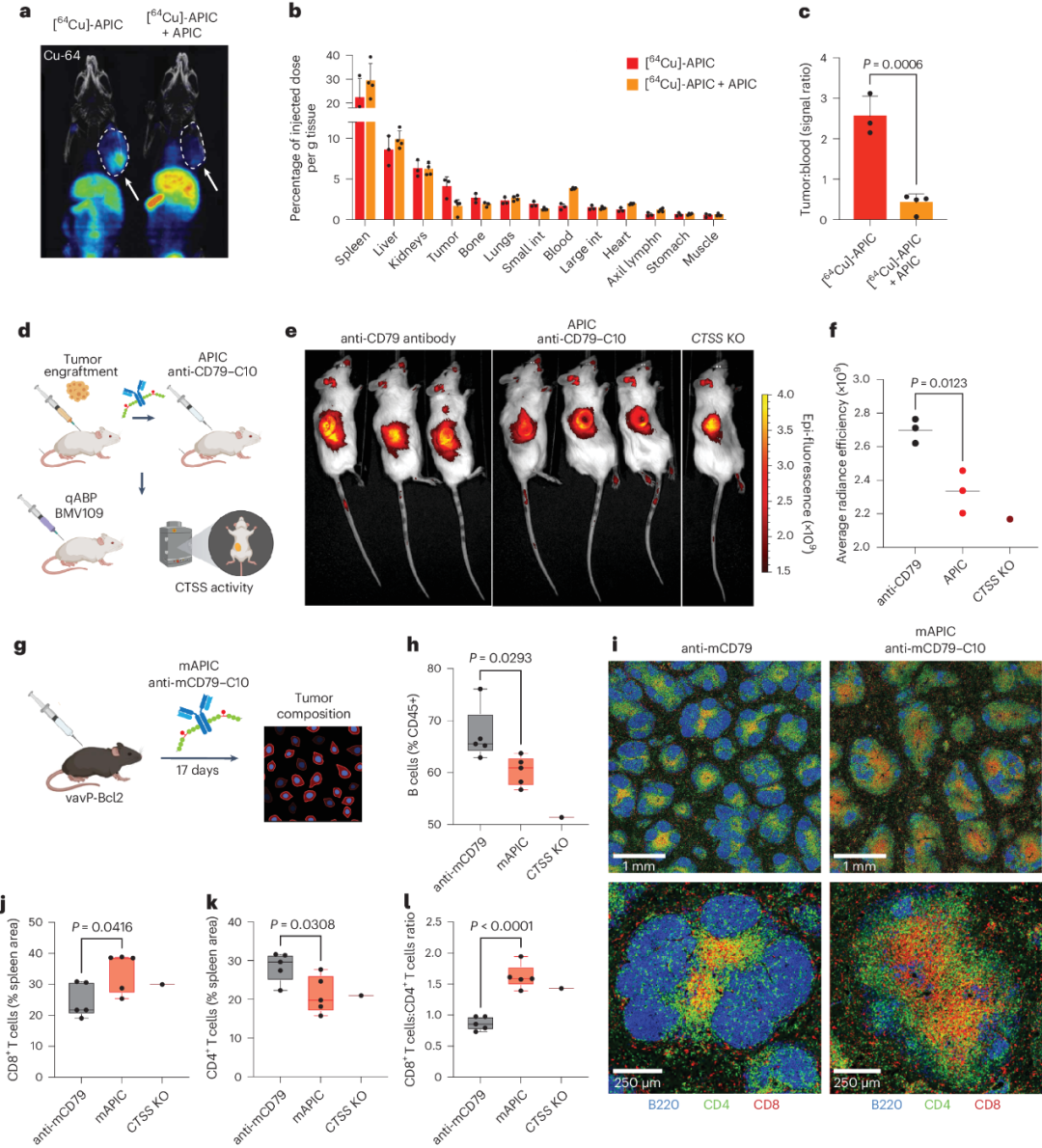
图2 APIC治疗可引发抗癌反应
原文链接:
https://www.nature.com/articles/s41589-024-01627-z