胆管癌(CCA)是肝脏第二常见原发恶性肿瘤,发病率和死亡率呈上升趋势。大多数患者为晚期CCA,其中姑息性化疗干预是唯一的选择。顺铂+吉西他滨(CisGem)系统性治疗已经作为晚期一线治疗长达十余年,尽管最近的TOPAZ-1和KEYNOTE-966研究分别主张在CisGem中添加度伐利尤单抗或帕博利珠单抗。本文报告了一例转移性TMB-H iCCA,在CisGem联合免疫治疗后实现了病理完全缓解(pCR)。
背 景
肝内CCA(iCCA)被认为是一种肿瘤突变负荷低(TMB-L)的恶性肿瘤。有回顾性研究收集了 6130 例患者的组织标本,平均TMB为 1.7 muts/Mb,只有 3.7% 的患者TMB ≥10 muts/Mb(定义为TMB-H)。在该项回顾性研究中,大多数微卫星高度不稳定(MSI-H)的肿瘤患者同时表现出TMB-H。然而,仅有不到 38% 的TMB-H患者同时表现为MSI-H。
虽然TMB-H在iCCA患者中很少见,但TMB评估可能有助于预测免疫治疗的潜在获益。一项汇总文献分析表明,PD-1/PD-L1抑制剂单药治疗的客观缓解率(ORR)与多种肿瘤的中位TMB显著相关,包括CCA(P=.0019)。一项纳入了 647 例患者的回顾性研究报道称,在接受免疫治疗的患者中,与TMB-L相比,TMB-H与总生存期(OS)显著改善相关(P=.01)。在多变量分析中,调整PD-L1和MSI状态后,与TMB-H相关的OS获益得到了保留。
KEYNOTE-158是一项前瞻性、II期、非随机临床试验,调查了 1066 名晚期实体瘤患者使用帕博利珠单抗的疗效,其中包括 63 例胆道癌(BTC)。分别在 29% 和 6% 患有TMB-H和非TMB-H肿瘤的患者中观察到客观反应。基于这些观察结果,美国食品和药品监督管理局批准帕博利珠单抗用于晚期TMB-H实体瘤患者。近期一项针对 77 例晚期TMB-H肿瘤患者进行的帕博利珠单抗篮子试验报告称,在结直肠癌和组织学汇总队列(histology-pooled cohort)中,疾病控制率分别为 31% 和 45%。遗憾的是,欧洲药物管理局尚未批准帕博利珠单抗用于TMB-H肿瘤。
虽然临床试验已经研究了单药免疫治疗在二线晚期BTC中的应用,但免疫单药治疗的作用仍不清楚。DETERMINE试验旨在评估靶向治疗对携带可干预基因变异罕见癌症的疗效,包括携带罕见可干预基因变异的常见癌症(NCT05770102)。本研究纳入了一个治疗组,分配TMB-H或MSI-H泛实体瘤、或结构性错配修复缺陷(constitutional mismatch repair deficiency,MRD)综合征患者接受阿替利珠单抗单药治疗。该试验也许可以进一步了解免疫单药治疗是否可以作为该患者群体中免疫联合化疗的替代方案,从而避免患者出现化疗相关的额外毒性。
本文报告了一例转移性TMB-H iCCA,在CisGem联合免疫治疗后实现了病理完全缓解(pCR)。本文还详细介绍了应用其它临床方案的病例报告,涉及PD-L1阳性和TMB-H患者、仅有淋巴结转移的晚期疾病患者、或免疫联合酪氨酸激酶抑制剂或三联化疗的患者。
病 例
患者男,49 岁,于 2020 年 6 月出现腹痛。CT扫描显示肝脏肿块占据肝V和VI段,延伸至VII和VIII段(图1A)。在右侧肾上腺发现了第二个肿块(图1A)。除有巴雷特食管(Barrett's esophagus)和缺铁性贫血病史外,病史无显著差异。治疗开始前ECOG状态评分为 1。
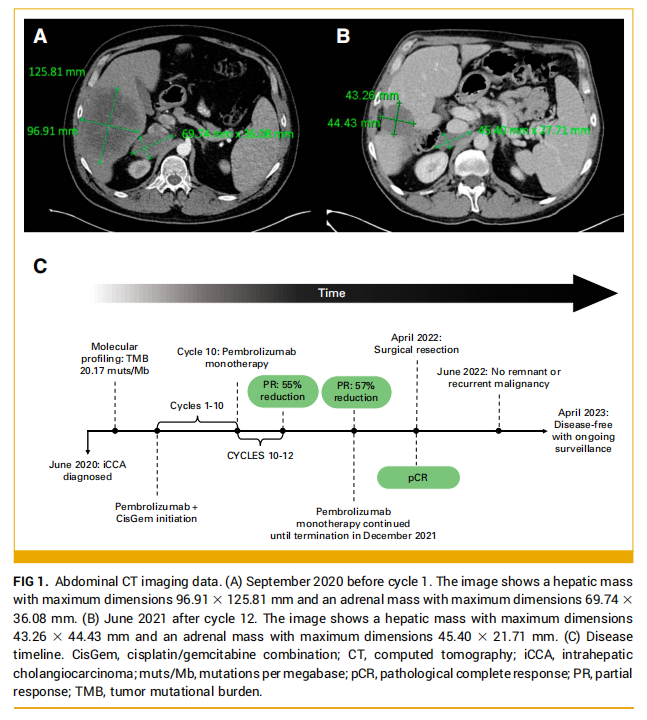
▲图1 腹部CT影像
超声引导下肝病变活检的组织病理学分析显示其特征与iCCA一致。免疫组化染色结果为CK7阳性,CK20、CDX2、甲胎蛋白和PD-L1阴性。经过多学科团队(MDT)的讨论和病例回顾,诊断为iCCA伴有肝外转移。随后肿瘤分子图谱分析发现,MSI稳定,但TMB很高,为 20.17 muts/Mb。对患者进行了基因检测,发现了以下基因变异:INPP4B剪接变异(96711G>T)、TP53 R158L、CDKN2A S56fs*64和BRAF G469A。
考虑到肿瘤的TMB-H状态,以及CisGem联合免疫治疗的临床试验。该患者在签署了书面知情同意书后成功入组临床试验。2020 年 9 月至 2021 年 6 月,患者接受了 10 个周期为三周的帕博利珠单抗联合CisGem治疗(CisGem每 21 天周期第 1 天和第 8 天,帕博利珠单抗每 21 天周期第 1 天),然后是两个周期的免疫单药治疗(CisGem因血小板减少复发而停用;图1C)。2021 年 1 月,再分期扫描显示肝脏病变缩小到 93×78 mm,肾上腺病变缩小到 62×37 mm。血液生物标志物分析显示CA19-9、CA125和CEA水平分别为 4499 U/mL(范围 0-37)、4051 U/mL(范围 0-30)和 6748 mg/L(范围 0-5)。第 12 个周期时,CT影像上可见部分缓解(靶病灶大小减少了 55%)。除了影像学缓解的证据外,生化指标也观察到了反应。肿瘤标志物CA125、CA19-9和CEA分别在 6、8 和 10 个治疗周期后正常(图2、表1)。患者在第 5 个周期时还报告了癌症相关症状的完全缓解。
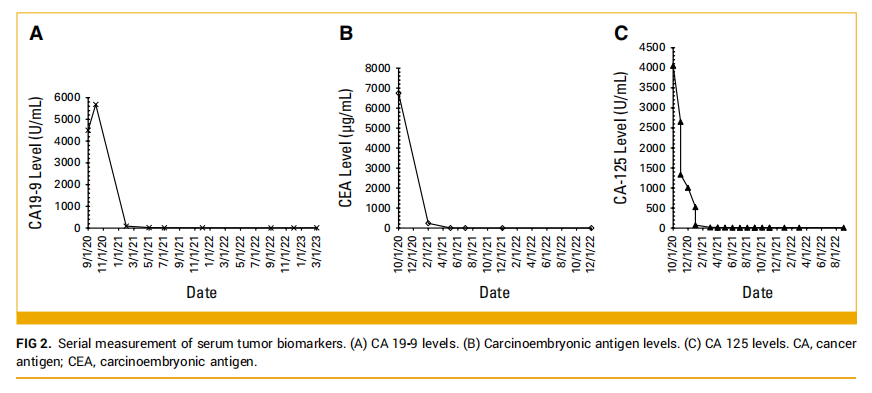
▲图2 血清肿瘤标志物的连续监测
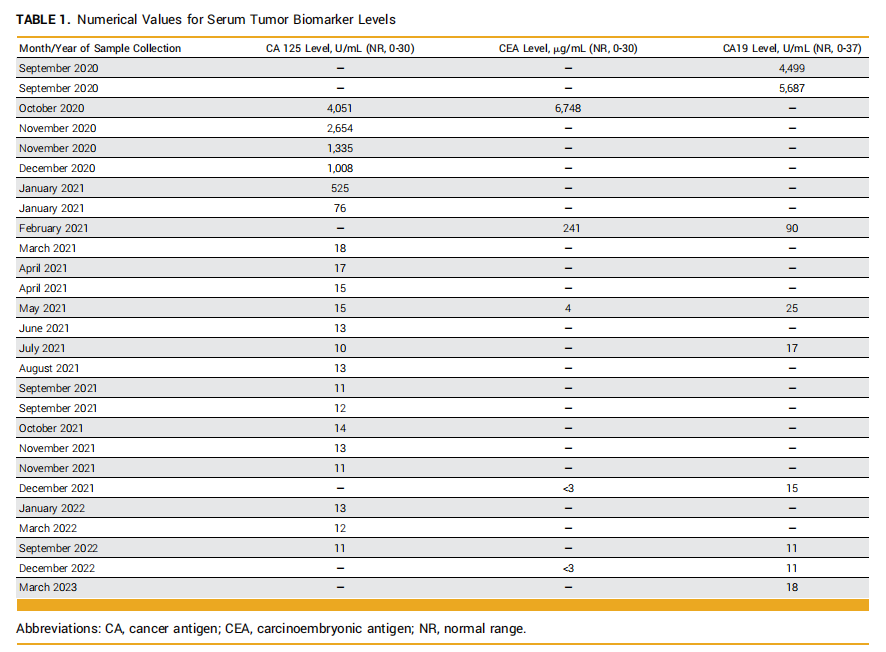
▲表1 血清肿瘤标志物水平
在治疗安全性方面,这些干预措施在第 1-12 个周期期间没有发生严重的治疗相关不良事件。观察到 1 级疲劳、恶心、脱发和血小板减少,并且对血小板减少的反应需要减少剂量。从第 6 个周期开始,CisGem剂量减少 25%,从第 10 个周期开始,由于复发性血小板减少和生活质量影响,患者只接受了免疫治疗。帕博利珠单抗单药治疗一直持续到 2021 年 12 月,ORR为 57%。根据试验方案的规定,由于患者出现 3 级丙氨酸转氨酶升高,需要永久停用帕博利珠单抗(图3)。
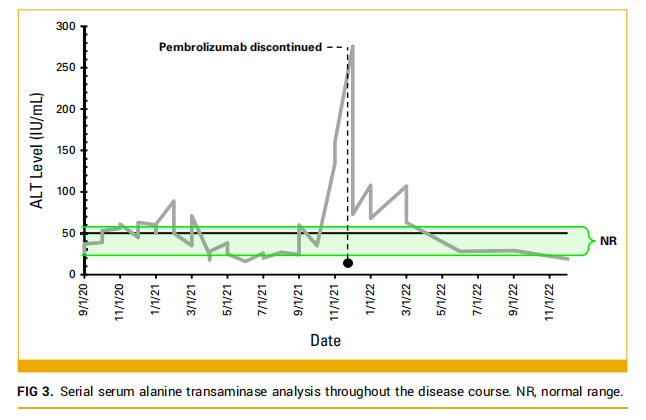
▲图3 治疗过程中血清丙氨酸转氨酶连续监测结果
由于转氨酶升高停用帕博利珠单抗,研究人员在MDT中重新讨论了本文病例,结论是有三种潜在的治疗策略:监测、手术干预或替代局部治疗。患者最终决定接受手术,行右前段切除术和右肾上腺切除术。监测影像显示,在 2022 年 4 月期间(即帕博利珠单抗停药和手术干预期间),患者两个病灶均保持稳定(图4A和4B)。术前PET-CT扫描显示,在肝脏和肾上腺病变中均无明显的FDG摄取(图4C)。
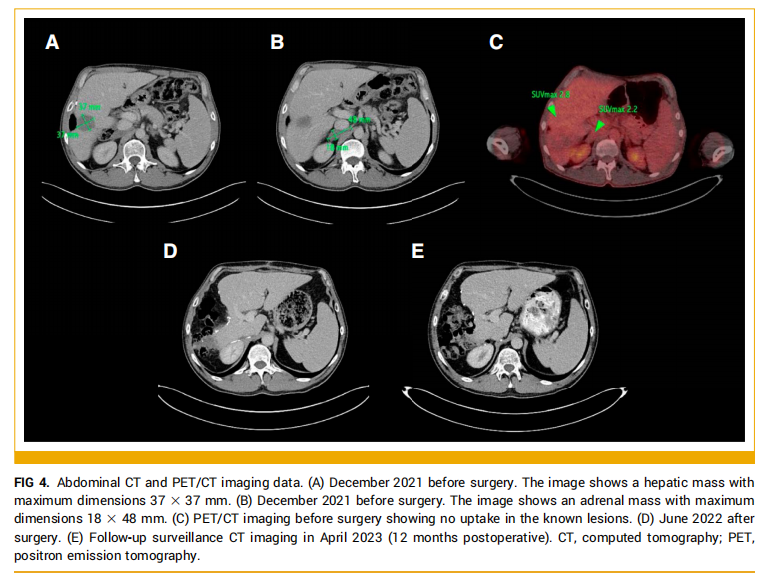
▲图4 腹部CT和PET-CT影像
手术标本的组织学分析显示,在这两个部位均无肿瘤组织存活,这意味着患者在帕博利珠单抗治疗期间取得了pCR(图5)。截止 2022 年 6 月的术后随访显示,没有残留或复发的恶性肿瘤,ECOG状态改善至 0(图4D)。截至 2023 年 4 月(图4E)和 8 月进行的影像监测,患者仍然无疾病。迄今为止,无进展生存期超过 38 个月。
讨 论
本文病例描述了一个相对罕见的临床结果。在转移性iCCA患者中,很少观察到成功的治愈性切除。在ABC-02研究中观察到一例患者经CisGem或吉西他滨单药治疗完全缓解。关于免疫治疗,KEYNOTE-158研究的最新分析调查了在MSI-H或MRD的晚期非结直肠癌患者(N=321)中的安全性和有效性。研究纳入 22 例CCA或BTC,这些患者的缓解率为 40.9%。尽管根据可能与免疫治疗应答增加相关的标志物进行了患者选择,但该队列中只有 8.4% 的参与者观察到完全缓解。
首先,本案例强调了在整个iCCA疾病过程中的关键时间点进行MDT重新讨论的重要性,以促进患者管理决策的改变。本文最初的目的是通过化疗和免疫治疗来实现疾病控制,最终因转氨酶升高而停止免疫治疗,仅进行影像监测。然而,通过MDT讨论,研究人员探索了替代方案,并获得了显著的生存和生活质量获益。本病例还强调了对分子频谱数据进行全面回顾的重要性,为患者定制合适的治疗方案。本病例报告的一个局限性是没有收集到细胞游离DNA和外周血单个核细胞(PBMC)数据。因此,无法解释整个病程中这些参数的变化。
虽然人们认识到MSI状态是预测免疫检查点抑制反应最可靠的生物标志物,但本文病例表明,有肝外转移的TMB-H CCA患者,即使没有MSI-H状态或MRD的证据,也可能从免疫治疗中获益。此外,本病例报告表明,在一线治疗前,晚期CCA患者有必要进行肿瘤分子频谱检测,包括TMB状态,从而挑选最合适的临床试验,并提供有效的干预措施。
Kendre G等人对未指定分期的iCCA患者进行了基因检测,其中 1.3% 的患者被归类为MSI-H,并且在<1%的CCA患者中发现了神经营养受体酪氨酸激酶(NTRK)融合。在许多临床实践中可以通过常规基因检测方式评估CCA患者的NTRK融合和MSI状态,并用于临床治疗。尽管TMB-H发生得相对频繁(Kendre等人研究数据为 3.7%),但TMB状态并不总是可获取的。因此提倡将TMB分析纳入常规的临床基因检测。此外,在BTC最近的两项使用CisGem联合免疫治疗的一线前瞻性研究中,将评估TMB状态并提供相关信息。最后,全球应重新评估并推动免疫疗法获批用于TMB-H肿瘤患者的治疗。
参考文献:
Robinson MD, Wheatley R, Foster L, Jamdar S, Siriwardena AK, Lamarca A, Hubner R, Valle JW, McNamara MG. Intrahepatic Cholangiocarcinoma With Extrahepatic Metastasis and High Tumor Mutation Burden: Case of Complete Pathological Response to Cisplatin/Gemcitabine/Pembrolizumab. JCO Precis Oncol. 2024 Apr;8:e2300572. doi: 10.1200/PO.23.00572. PMID: 38662981.
