肺癌是全球导致癌症相关死亡的首要原因之一,同时也是我国的高发肿瘤之一,其中非小细胞肺癌约占肺癌的 80%。由于受到当前临床治疗手段的限制,以及肿瘤微环境 (TME)和免疫抑制的复杂特性,晚期的非小细胞肺癌 (Non-small cell lung cancers, NSCLC) 的死亡率长期以来居高不下。
最近,重庆医科大学基础医学院蒋宁/彭奇龄/王建为/魏余贤团队设计出一种独特的重编程外泌体药物,偶联PD-L1抗体阻断免疫检查点靶向治疗非小细胞肺癌,中空二氧化锰负载光敏剂吲哚菁绿(Indocyanine Green, ICG)实现光动力联合免疫多层次治疗策略,缓解肿瘤细胞内缺氧,疗效显著。重庆医科大学基础医学院硕士研究生郭焦、赵薇为该论文的共同第一作者,文章发表在Bioactive Materials杂志上。
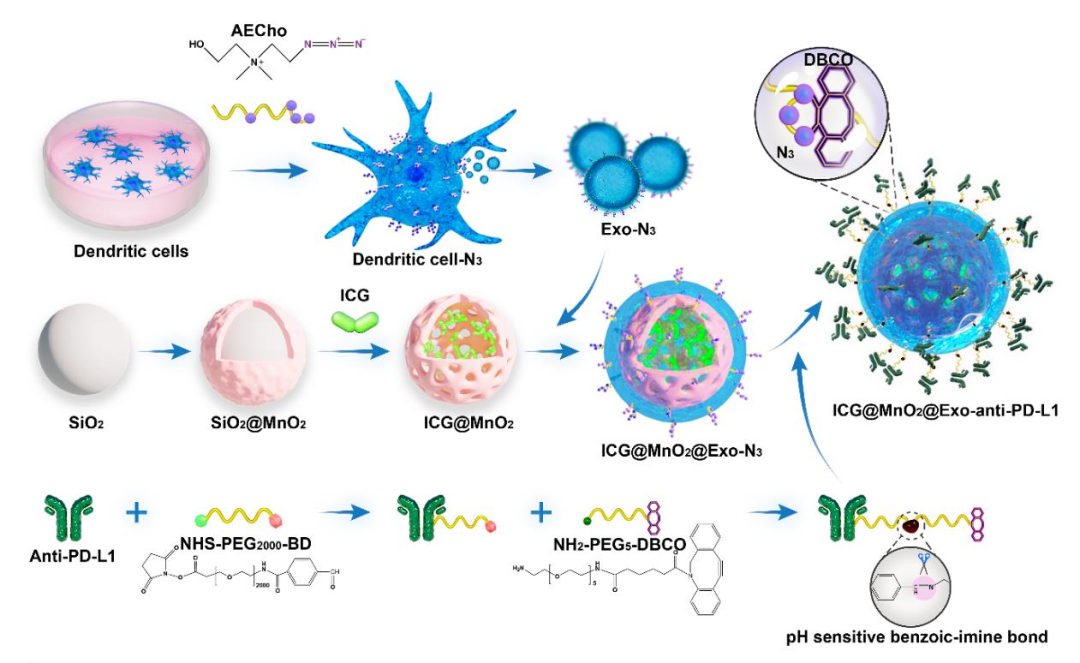
图1:重编程外泌体药物合成步骤示意图
该科研团队利用模板法合成具有中空结构的 MnO2,并将吲哚菁绿(Indocyanine Green, ICG) 负载到 MnO2 内。叠氮胆碱与小鼠 DC2.4 细胞共孵育获得叠氮化的 DC 外泌体;同时,利用二苯并环辛炔 (Dibenzocyclooctynes, DBCO) 修饰 PD-L1 单克隆抗体。最后,将 ICG@ MnO2、Exo 及 anti-PD-L1-PEG2000-DBCO 构建成为 ICG@MnO2@Exoanti-PD-L1纳米递药系统。(如图1所示)。另外,紫外可见光谱、溶解氧测定和动态光散射等方法对其进行表征和功能性测试。结果均表明多功能的 ICG@MnO2@Exo-anti-PD-L1 NPs的成功构建,该递药系统可以利用 H2O2 产生 O2的同时可产生 Mn2+,并能实现 PD-L1 单克隆抗体的酸响应释放。(如图2所示)
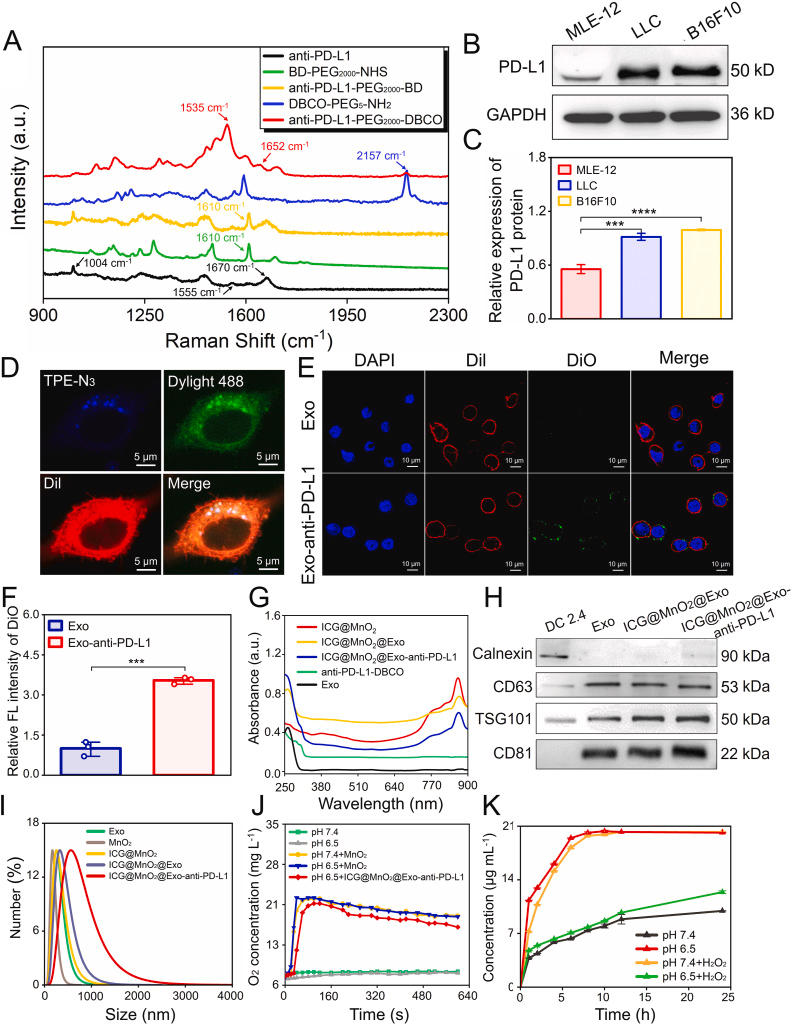
图2:重编程外泌体药物的合成与表征
为了进一步验证 ICG@MnO2@Exo-anti-PD-L1 NPs 纳米递药系统的功能,该组研究人员采用 CCK-8 实验评估纳米递药系统的细胞毒性,然后构建细胞缺氧模型,通过 western blot 实验和免疫荧光实验评估对肿瘤细胞缺氧的缓解作用和增强 PDT 的作用。结果表明,该纳米递药系统具有较低的细胞毒性、缓解细胞缺氧并促进 PDT 作用下单线态氧的产生。(如图3所示)
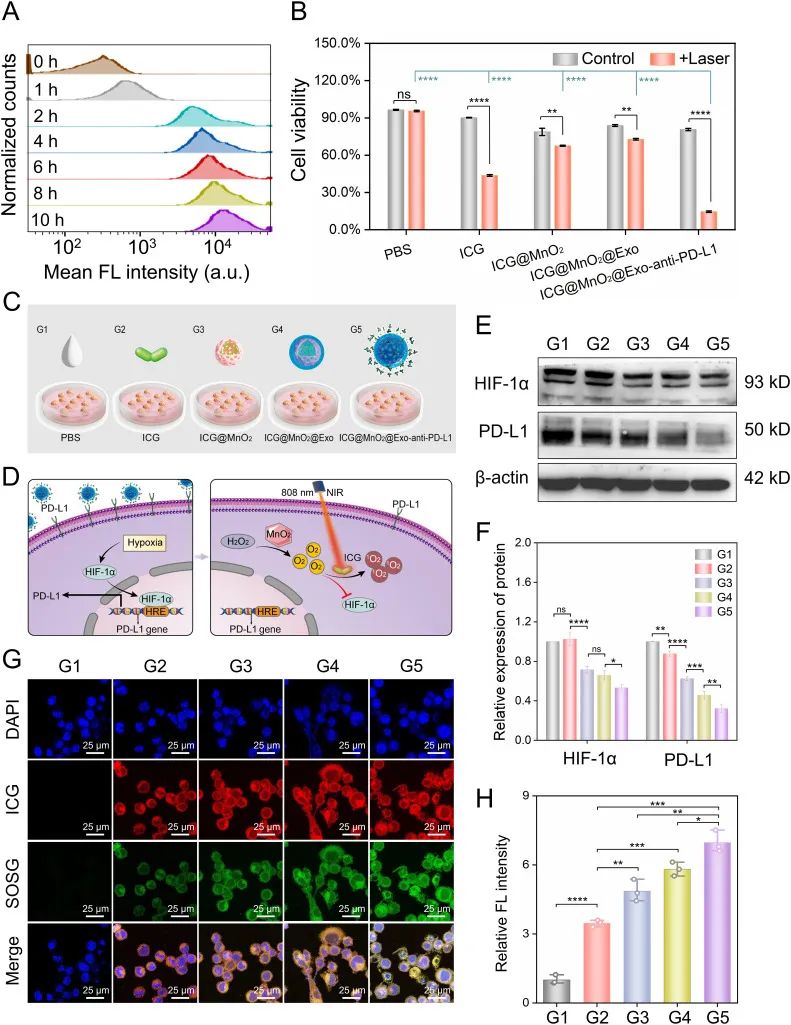
图3:重编程外泌体药物体外缓解细胞缺氧及增强光动力治疗的验证
为了进一步验证 ICG@MnO2@Exo-anti-PD-L1 NPs 对 NSCLC 的治疗作用,首先建立 NSCLC 小鼠肿瘤模型,利用动物活体荧光成像研究ICG@MnO2@Exo-anti-PD-L1 NPs 对肿瘤的靶向作用,再通过对小鼠体重、肿瘤大小、生存时间的观察记录以及肿瘤的 Ki-67,TUNEL 染色结果来评估 ICG@MnO2@Exo-anti-PD-L1 NPs 的体内抗肿瘤作用。结果表明,ICG@MnO2@Exo-anti-PD-L1 NPs 可以特异性靶向 NSCLC 肿瘤病灶并具有较长的体内循环时间,该纳米递药系统的光动力协同免疫治疗具有显著抑制 NSCLC 模型小鼠的肿瘤生长和重塑肿瘤内免疫微环境的作用。(如图4所示)
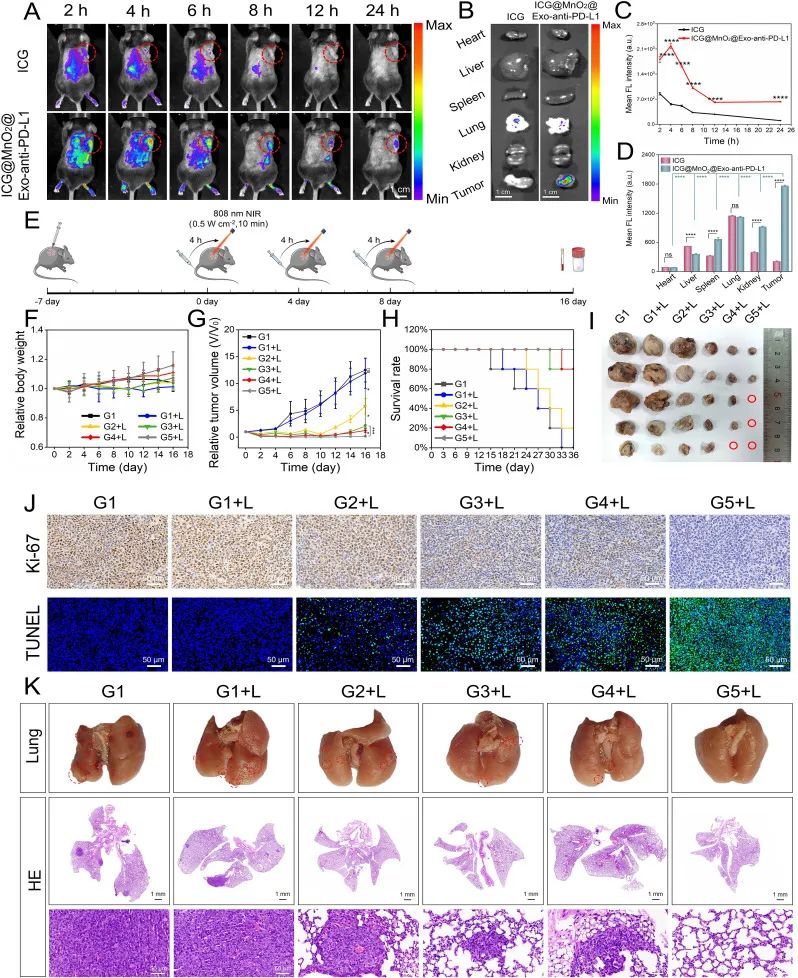
图4:重编程外泌体药物的体内抗肿瘤效果评估
基于上述结果,ICG@MnO2@Exo-anti-PD-L1 纳米药物以点击化学反应的方法对外泌体进行重编程,通过 PDT 和免疫治疗的协同作用有效调节 TME。该研究旨在为NSCLC治疗研究提供新的视角,并显示出安全有效的临床应用潜力,同时也为癌症相关治疗提供新的临床可能性。
参考文献:
Jiao Guo#, Wei Zhao#, Xinyu Xiao , Shanshan Liu , Liang Liu , La Zhang , Lu Li ,Zhenghang Li , Zhi Li , Mengxia Xu , Qiling Peng *, Jianwei Wang *, Yuxian Wei *,Ning Jiang *. Reprogramming exosomes for immunity-remodeled photodynamictherapy against non-small cell lung cancer. Bioactive Materials. 2024,39 (2024): 206-223.
原文链接:
https://www.sciencedirect.com/science/article/pii/S2452199X24001968