近期,复旦大学/天津大学仰大勇教授与天津大学赵怀鑫副研究员合作在DNA功能材料用于光动力肿瘤治疗方面取得新进展,发展了包含长余辉纳米粒子(PLNP)、光动力单元以及免疫佐剂组成的储能DNA水凝胶,实现了肿瘤微环境重塑和肿瘤特异性的无激光光动力免疫治疗。相关成果发表在生物材料领域权威期刊Biomaterials。主要作者包括硕士生王中昱和博士生杨森。该工作得到国家重点研发计划和国家自然科学基金等资助支持。
光动力疗法(PDT)是一种有前景的恶性肿瘤治疗方法,依赖于光敏剂、光源和氧气。然而,外部光源对生物组织的穿透深度有限,限制了光敏剂对光的吸收,极大地影响了治疗效果。PLNP是一种重要的储能材料,能够储存各种光能,并且能发光数小时甚至数天。前期,团队利用该特性构建了无激光光动力系统(Adv. Mater. 2022, 34 (13), 2109920. Doi: 10.1002/adma.202109920)。最新研究发现,PDT破坏肿瘤细胞产生的细胞碎片具有强烈的免疫原性,能够作为肿瘤特异性抗原刺激树突状细胞(DC)成熟并激活T细胞,从而激发抗肿瘤免疫反应。此外,实体瘤中复杂的肿瘤微环境包括乏氧和免疫抑制的微环境,限制了光动力效率和免疫细胞的功能,导致光动力免疫疗法的抗肿瘤效率低。因此,将无激光光动力肿瘤治疗与肿瘤微环境重塑、肿瘤免疫治疗相结合,建立一种新型高效的光动力免疫癌症治疗的新模式,将大大提高深层实体瘤的治疗效果。
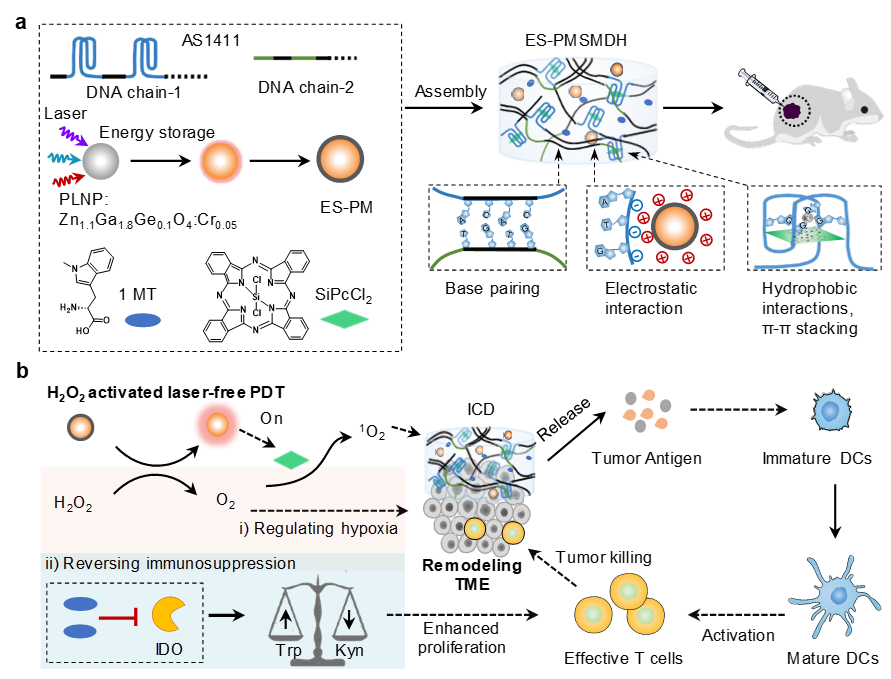
图1. 储能DNA水凝胶用于无激光光动力免疫疗法的示意图。
研究团队开发了一种储能DNA水凝胶(ES-PMSMDH),负载有ES-PM(储存能量的长余辉纳米粒子)、光敏剂(硅酞菁)和免疫抑制剂(1-甲基色氨酸,1MT)。该水凝胶在无需外部激光照射的情况下实现了肿瘤选择性的光动力治疗,并调节肿瘤微环境以增强PDT介导的肿瘤免疫疗法。该水凝胶由滚环扩增产生的两条DNA单链通过碱基互补配对形成,其中一条链上编码特异性识别肿瘤细胞的AS1411适配体;AS1411的G-四链体结构通过疏水相互作用和π-π堆叠负载光敏剂SiPcCl2;PLNP通过预储能和包覆MnO2得到ES-PM;带正电荷的ES-PM与负电荷DNA磷酸骨架通过静电作用结合;吲哚胺-2,3-二氧化酶(IDO)抑制剂1MT通过物理吸附负载到DNA水凝胶。在肿瘤部位,该水凝胶能够特异性结合肿瘤细胞,肿瘤部位高浓度的H2O2激活系统持久释放光能,激活光敏剂,开启PDT杀伤肿瘤细胞,诱导癌细胞免疫原性死亡,释放肿瘤抗原,引发抗肿瘤免疫反应。同时,DNA水凝胶释放出1MT,抑制IDO的活性,色氨酸浓度增加,从而促进T细胞增殖,增强肿瘤杀伤能力。在乳腺癌小鼠模型中,该DNA水凝胶对肿瘤的抑制率达78.3%。该DNA水凝胶重塑了缺氧和IDO介导的免疫抑制肿瘤微环境,实现了高效的肿瘤部位特异性的无激光光动力免疫治疗。
原文链接:
https://doi.org/10.1016/j.biomaterials.2024.122620