一、活检(含内镜活检或肿物穿刺活检)
1、大体检查
Ⅰ级推荐:组织大小和数目。
取材要求:
-
核对临床送检标本数量,送检活检标本必须全部取材;
-
将标本包于纱布或柔软的透水纸中以免丢失;
-
每个蜡块内包埋不超过5粒活检标本,并依据组织大小适当调整(每个蜡块内不超过3粒更佳)。
2、镜下检查
Ⅰ级推荐:明确病变性质和类型;肿瘤/非肿瘤、良性/恶性、组织学类型、组织学分级。
组织学类型:
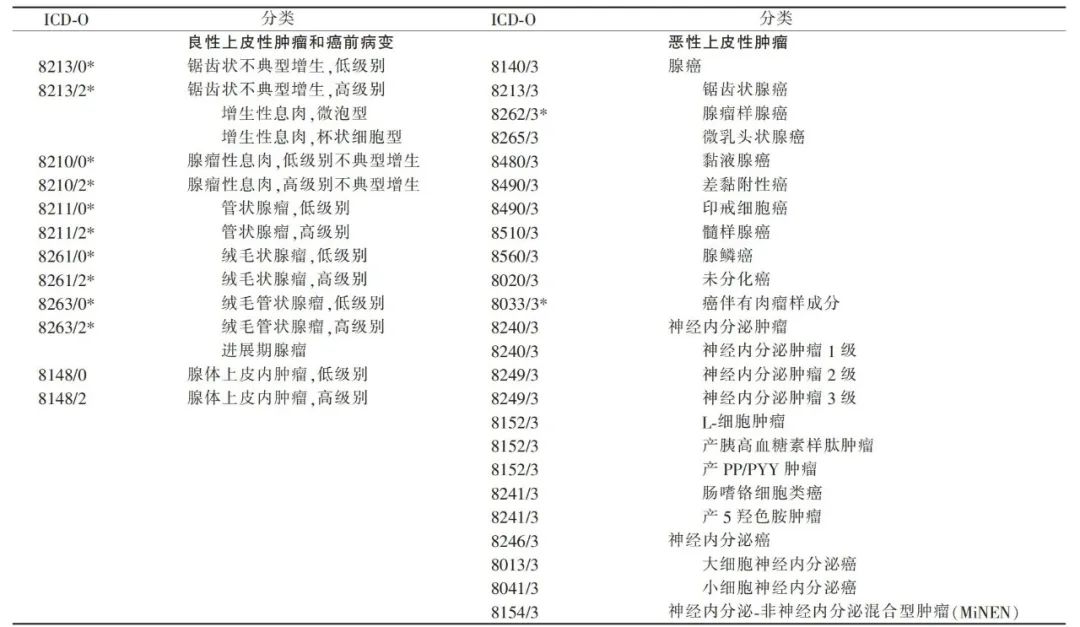
WHO结肠直肠肿瘤分类
组织学分级:
-
针对结直肠腺癌(普通型),可按照腺管形成比例分为高分化(>95%腺管形成)、中分化(50%~95%腺管形成)、低分化(0~49%腺管形成)和未分化(无腺管形成、黏液产生、神经内分泌、鳞状或肉瘤样分化)4级;
-
也可以按照2019版WHO将结直肠腺癌分成低级别(高-中分化)和高级别(低分化),并指出分级依据分化最差的成分。对于侵袭前沿的肿瘤出芽和分化差的细胞簇不应该包含到分级中,应该单独报告。
3、免疫组织化学
Ⅰ级推荐:错配修复(mismatch repair,MMR)蛋白表达。
Ⅱ级推荐:用于鉴别诊断的免疫组化标记物检测。根据鉴别目的选取,结直肠腺癌典型的免疫表型为CK7-/CK20+/CDX2+。
4、分子病理检测
Ⅰ级推荐:微卫星不稳定性(microsatellite instability,MSI)。
目前常用的检测panel包括由2个单核苷酸重复位点和3个双碱基重复位点组成的NCI Panel(BAT-25、BAT-26、D5S346,D17S250,D2S123),和由5个单核苷酸组成的Promega Panel(BAT-25,BAT-26、NR-21、NR-24、MONO-27)。
判断标准为:
所有5个位点均稳定为MSS(微卫星稳定)
1个位点不稳定为MSI-L(微卫星低度不稳定)
2个及2个以上位点不稳定为MS-H(微卫星高度不稳定)。
MSI多由MMR基因突变及功能缺失导致,也可以通过检测MMR蛋白缺失来反映MSI状态。一般而言,dMMR相当于MSI-H,pMMR相当于MSI-L或MSS。dMMR/MSI-H的结直肠癌治疗具有特殊性。
5、与NCCN及ESMO指南比较
此部分三版指南描述一致。
二、腺瘤局部切除标本(套圈切除/内镜下黏膜切除术/内镜黏膜下剥离术)
1、大体检查
Ⅰ级推荐:肿瘤大小,有蒂/无蒂。
取材要求:
(1)内镜切除标本:
-
标本固定建议由临床医师规范化处理:活检标本离体后,应由内镜医师及时将活检黏膜组织基底面黏附于滤纸上,立即浸入固定液中固定。内镜下黏膜切除标本离体后,内镜医师展开标本,黏膜面向上,使用大头针固定于软木板或泡沫板,标示口侧缘和肛侧缘,翻转令黏膜面朝下放入固定液中。息肉切除标本,有蒂息肉可直接放入固定液中,无蒂息肉用墨汁标记好切缘后放入固定液中。
-
建议记录标本和肿瘤病变的大小、形态,各方位距切缘的距离。
-
息肉切除标本的取材:首先明确息肉的切缘、有无蒂以及蒂部的直径,推荐用墨汁涂蒂切缘(有蒂)及烧灼切缘(无蒂)。取材时要考虑到切缘和有蒂息肉蒂部的浸润情况能够客观正确地评价。建议按如下方式取材:无蒂息肉以切缘基底部为中心向左、右两侧全部取材,见图1。有蒂息肉当蒂切缘直径>2mm时,略偏离蒂切缘中心处垂直于蒂切缘平面切开标本,再平行此切面,间隔2~3mm,将标本全部取材,见图2;蒂切缘直径≤2mm时,垂直于蒂切缘平面间隔2~3mm,将全部标本取材,使蒂部作为一个单独的蜡块,见图3。推荐按同一包埋方向全部取材。记录组织块对应的方位。
(2)内镜下黏膜切除术和内镜黏膜下剥离术标本的取材:
-
由于肿物距切缘距离一般较近,切缘的评估尤其重要。建议涂不同的颜料标记基底及侧切缘,以便在观察时能够对切缘做出定位,并评价肿瘤切缘情况。每间隔2~3mm平行切开标本,见图4。如临床特别标记可适当调整,分成大小适宜的组织块,应全部取材并按同一方向包埋(最后一个组织条应该与其他组织条反向包埋,确保最两边的组织条刀切面向下包埋)。
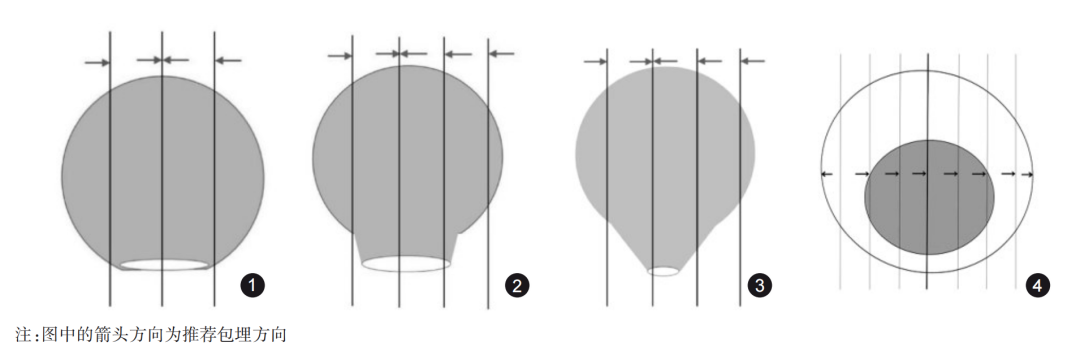
图1 无蒂息肉取材:以切缘基底部为中心平行切开,向左、右两侧全部取材
图2 宽蒂(直径>2mm)有蒂息肉取材:垂直于蒂切缘平面,间隔2~3mm将标本全部取材
图3 窄蒂(直径≤2mm)有蒂息肉取材:垂直于蒂切缘平面,间隔2~3mm将全部标本取材,使蒂部作为一个单独的蜡块
图4 内镜下黏膜切除术和黏膜剥离术标本取材:间隔2~3mm平行切开标本,全部取材并按同一方向包埋
2、镜下检查
Ⅰ级推荐:明确腺瘤类型;异型增生/上皮内瘤变级别(高级别/低级别);伴有浸润性癌时:需明确组织学类型、组织学分级、浸润深度、侧切缘和基底切缘、脉管侵犯、肿瘤出芽等。
(1)腺瘤伴浸润性癌是指腺瘤含有穿透黏膜肌层浸润到黏膜下层的腺癌(pT1);
(2)腺瘤伴高级别上皮内瘤变包括腺瘤伴重度异型增生,原位癌和黏膜内癌;
(3)“高级别腺癌”“肿瘤距离切缘小于1mm”“脉管侵犯”和“高级别(3级)肿瘤出芽”为预后不良因素。

肿瘤出芽分级标准
3、免疫组织化学
Ⅰ级推荐:错配修复(mismatch repair,MMR)蛋白表达。
Ⅱ级推荐:用于鉴别诊断的免疫组化标记物检测。
4、分子病理检测
Ⅰ级推荐:微卫星不稳定性(microsatellite instability,MSI)。
5、与NCCN及ESMO指南比较
NCCN指南
阳性切缘定义:
1)肿瘤距切缘<1mm;2)肿瘤距切缘<2mm;3)肿瘤细胞在切缘的热疗范围内。
ESMO指南
不良预后相关的组织学特征:
1)淋巴管或静脉侵犯;2)3级分化;3)明显的肿瘤出芽(>1级)。
三、根治术标本
1、大体检查
Ⅰ级推荐:标本类型、肿瘤部位、肠段长度、肿瘤大体类型、肿瘤大小、肿瘤距离两侧切缘距离、有无穿孔、全直肠系膜切除术(total mesorectal excision,TME)标本系膜完整性、淋巴结检出数目、大小和分组。
TME标本系膜完整性评估标准:
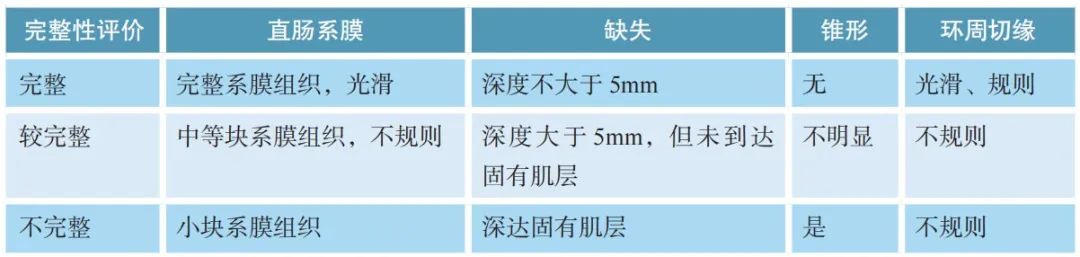
淋巴结按淋巴引流方向进行取材并分组(肠旁、中间、中央),未经新辅助治疗的根治术标本,检出淋巴结总数原则上不少于12枚。若第一次未找到12枚淋巴结,建议复检。
取材要求:
-
沿肠壁长轴剪开肠管、垂直于肠壁切取肿瘤标本,肿瘤组织充分取材,视肿瘤大小、浸润深度、不同质地、颜色等区域分别取材,肿瘤浸润最深处至少1块全层厚度肿瘤及肠壁组织,以判断肿瘤侵犯的最深层次。仔细观察浆膜受累情况,当肿瘤邻近或侵犯浆膜时,取材可疑侵犯浆膜的区域,以便镜下准确判断浆膜受累情况。切取能够显示肿瘤与邻近黏膜关系的组织。
-
切取远侧、近侧手术切缘。推荐切取系膜、环周切缘(距离癌组织最近的软组织,非腹膜覆盖的所有区域),对于可疑系膜、环周切缘阳性的病例,建议按手术医师用墨汁标记的部分切取。建议尽量对不同切缘区分标记。
-
切除标本若包含回盲部或肛管、肛门,应当于回盲瓣、齿状线、肛缘取材。若肿瘤累及上述部位,应切取充分显示病变程度的组织块。常规取材阑尾。
-
行中低位直肠癌根治术时需要完整切除直肠系膜,推荐病理医师对手术标本进行系统检查及评价,包括系膜的完整性、环周切缘是否有肿瘤侵犯,病理检查是评价直肠系膜完整性最直观的方法。
-
淋巴结:包埋所有检出的淋巴结,较大淋巴结应剖开包埋,未经新辅助治疗的根治术标本应至少检出12枚淋巴结。
-
新辅助治疗后的直肠癌手术标本,需仔细观察原肿瘤部位的改变并进行记录。如仍有较明显肿瘤,按常规进行取材。如肿瘤较小或肉眼无明显肿瘤,需根据治疗前肠镜等描述将原肿瘤所在范围全部取材。
-
推荐取材组织块体积:不大于2.0cm*1.5cm*0.3cm。
2、镜下检查
Ⅰ级推荐:组织学类型、组织学分级、浸润深度、脉管侵犯、神经侵犯、两侧切缘、环周切缘、淋巴结转移数和总数、癌结节数目、肿瘤出芽、TNM分期、肿瘤退缩分级(TRG)。
(1)“环周切缘”是指没有腹膜覆盖的肠壁“基底”切缘,建议手术医师在环周切缘处涂色或加以标识。“环周切缘阳性”是指肿瘤距离切缘≤1mm。
(2)肿瘤退缩分级(TRG)的病理学评估依据残留肿瘤成分以及纤维化程度进行分析。推荐使用AJCC第8版TRG评分系统。

TRG评分
3、免疫组织化学
Ⅰ级推荐:错配修复(mismatch repair,MMR)蛋白表达。
Ⅱ级推荐:用于鉴别诊断的免疫组化标记物检测。
4、分子病理检测
Ⅰ级推荐:微卫星不稳定性(microsatellite instability,MSI)。
Ⅱ级推荐:RAS和BRAF基因突变检测。
5、与NCCN及ESMO指南比较
(1)NCCN指南在此部分中着重提及了孤立肿瘤细胞及微转移的概念:
孤立肿瘤细胞:IHC或多个HE水平检测到的单个肿瘤细胞和/或<0.2mm的肿瘤细胞团。
微转移:直径≥0.2mm且≤2mm的肿瘤细胞团块或10-20个肿瘤细胞的细胞簇,视为标准的阳性淋巴结(pN+)。
(2)ESMO指南在此部分详细列出了II期风险评估的主要及次要预后参数。
主要预后参数:切除淋巴结<12;pT4分期包括穿孔。
影响较小的参数:高级别肿瘤;血管浸润;淋巴管浸润;周围神经侵犯;梗阻;术前CEA水平高。
四、转移性结直肠癌手术/活检标本
1、大体检查
Ⅰ级推荐:同根治术标本。
2、镜下检查
Ⅰ级推荐:同根治术标本。
3、免疫组织化学
Ⅰ级推荐:错配修复(mismatch repair,MMR)蛋白表达。
Ⅲ级推荐:HER-2状态检测。
4、分子病理检测
Ⅰ级推荐:微卫星不稳定性(microsatellite instability,MSI);RAS和BRAF基因突变检测。
Ⅲ级推荐:NTRK融合、POLE/POLD1基因突变检测。
相比于2023版CSCO结直肠癌诊疗指南,2024版指南中新增了POLE/POLD1基因突变的检测。
增加了注释内容:POLE/POLD1基因是DNA合成和损伤应答相关基因,部分发生在POLE/POLD1蛋白DNA外切酶结构域的突变会导致肿瘤超突变。这种功能性突变使肿瘤中免疫原性突变数量和质量提高,T细胞被激活、功能增强,改善肿瘤免疫微环境,因此预后较好且对免疫治疗更敏感。2%-8%的MSS/pMMR型结直肠癌具有体细胞POLE功能性突变,而POLD1突变极其罕见。可以用单基因测序的方法进行检测,但大panel的NGS不仅可以检测到包括POLE/POLD1在内的基因改变、也可以获得肿瘤突变负荷(TMB)等数据。
5、与NCCN及ESMO指南比较
2024CSCO及2024V1 NCCN指南均新增了“POLE/POLD1基因突变”。
POLE/POLD1基因编码的蛋白为DNA聚合酶亚基,在DNA复制和修复中发挥重要作用。若其发生突变,会导致大量突变的基因在体内大量累积,称为超突变表型,形成高免疫原性结直肠肿瘤。
2022年ESMO上公布的一项研究显示:
在中国结直肠癌患者中,POLE突变率在6.3%(411/6489),其突变与CRC患者中较高的TMB水平相关。同时,在子宫内膜癌,POLE突变型患者被证明有更好的预后和免疫治疗获益。也就是这样一部分病人POLE/POLD1突变合并或不合并MSS-H可能同样获益于免疫治疗。
2024 V1版结直肠癌NCCN指南还新增RET融合基因检测。
RET是一种受体酪氨酸激酶,主要通过下游MAPK和PI3K信号通路,在神经和泌尿生殖组织的发育和维持中发挥关键作用。RET的体细胞激活改变包括点突变和基因重排,并已在多种肿瘤中被鉴定。胚系RET激活突变可导致2型多发性内分泌腺瘤病(MEN2),而功能丧失突变与先天性巨结肠症以及先天性肾脏和泌尿道畸形相关。
体系RET激活突变包括点突变和基因重排,最常见的基因融合伙伴包括KIF5B、CCDC6和NCOA4。RET抑制剂塞普替尼已被FDA批准用于携带激活性RET融合的实体瘤患者。RET融合的存在可以通过多种技术进行询问,包括IHC、FISH、PCR和NGS测定。
参考文献及书籍:
1.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)结直肠癌诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.
2.NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Colon Carcinoma. Version 1.2024
3.国家卫生健康委员会医政司, 中华医学会肿瘤学分会. 国家卫生健康委员会中国结直肠癌诊疗规范(2023版)[J]. 中华胃肠外科杂志, 2023, 26(6): 505-528.