导读
阿尔茨海默病(AD)是一种神经退行性疾病,临床表现为认知功能的进行性下降,其发病机制涉及罕见和常见的遗传变异,APP、PSEN1和PSEN2这三个基因的突变可导致早发性常染色体显性阿尔茨海默病(ADAD);其次是唐氏综合征带来的APP基因多拷贝,由此发展为唐氏综合征相关的阿尔茨海默病(DSAD)。
此外,还有数十个其他基因的变异与更常见的迟发性AD(LOAD)发病风险增加有关。在这些基因中,APOE4被认为是最强的遗传风险因素。已有研究表明,APOE4纯合子个体患AD的终生风险在85岁时可达60%,显著高于杂合子或非携带者。但尚未有研究评估APOE4纯合子症状发作的可预测性,也没有研究全面分析APOE4纯合子中淀粉样蛋白、tau蛋白、神经退行性变框架(AT(N))等生物标志物类别与年龄和症状发作估计年份之间的基因剂量效应。
近日,西班牙圣十字圣保罗医院的科研人员在Nature Medicine发表了题为“APOE4 homozygozity represents a distinct genetic form of Alzheimer’s disease”的文章。研究团队分析了美国国家阿尔茨海默病协调中心(NACC)的大型病理数据集,以及迄今为止发表的5个大型多中心队列10,039人的AD生物标志物数据。分析结果发现,APOE4不应当仅被视为AD的风险基因,而应当被认定为AD的致病基因。APOE4纯合完全满足遗传性AD的三大主要特征:近乎完全的疾病外显率、症状发作年龄的可预测性、病理/生物标志物/临床表现的可预测变化。将APOE4视为AD的致病基因,不论对AD的诊断治疗,还是临床药物的研发与试验设计,均会产生巨大影响。

文章发表在Nature Medicine
主要研究内容
01 AD在APOE4纯合子中的生物学外显率
研究团队收集了来自NACC队列的3,297名脑捐献者病理数据和临床队列中10,039名个体的数据,分析了人口统计学特征、APOE单倍型、神经病理学数据和生物标志物数据,并在NACC死后数据和临床队列的体内生物标志物结果中计算了AD的生物学外显率。具体而言,对于死后数据,研究团队探究了AD神经病理改变(ADNC)评分(神经病理负荷的一种衡量指标)随年龄的变化情况。值得注意的是,几乎所有的APOE4纯合子个体都表现出高或中等的ADNC得分,而约50%的APOE3纯合子个体出现这种情况。此外,APOE4纯合子个体的神经病理学结果与死亡时的年龄无关。
APOE4和APOE3纯合子在5年年龄间隔内的阳性淀粉样蛋白和tau生物标志物频率显示,几乎所有APOE4纯合子都表现出AD病理,并且从55岁起,APOE4纯合子中异常生物标志物水平始终高于APOE3纯合子;到65岁时,几乎所有APOE4纯合子参与者都显示脑脊液淀粉样蛋白(Aβ1-42)水平异常,75%参与者淀粉样蛋白扫描呈阳性。对于其他生物标志物,AD的生物外显率随着年龄的增长而增加,所有淀粉样蛋白和tau生物标志物在80岁时达到88%。
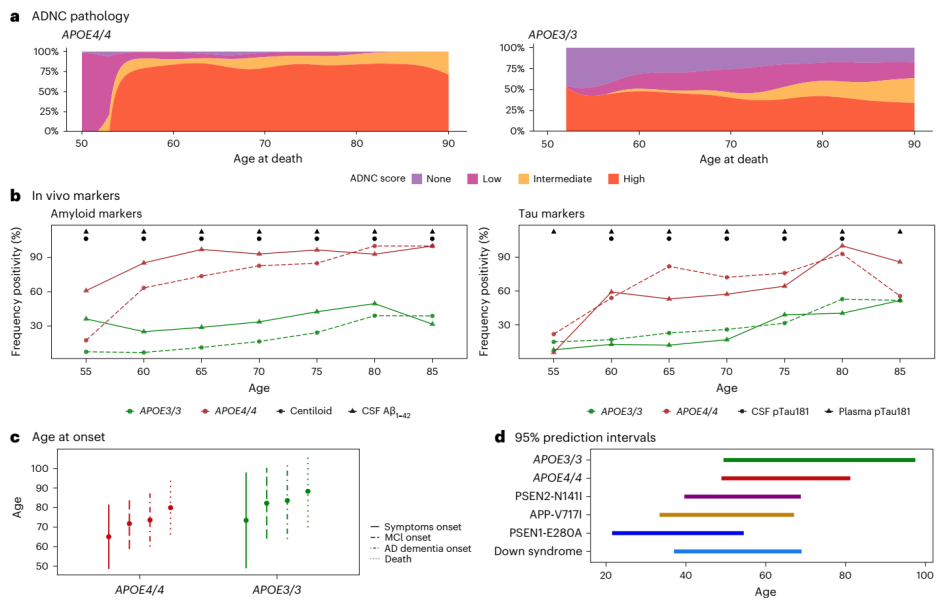
图1. APOE4纯合性在AD中的外显率及预测价值
02 APOE4纯合子症状的可预测性
接下来,研究团队分析了病理研究队列(死后数据)中APOE4和APOE3纯合子个体的症状发作年龄、轻度认知障碍(MCI)临床诊断、痴呆和死亡年龄。结果显示,APOE4纯合子个体在65.6岁开始出现AD症状,71.8岁开始出现MCI,73.6岁开始出现痴呆,77.2岁开始出现死亡,大约比APOE3纯合子个体早7-10年。Kaplan-Meier生存分析结果也证实,基因剂量对发病年龄和死亡年龄存在影响。
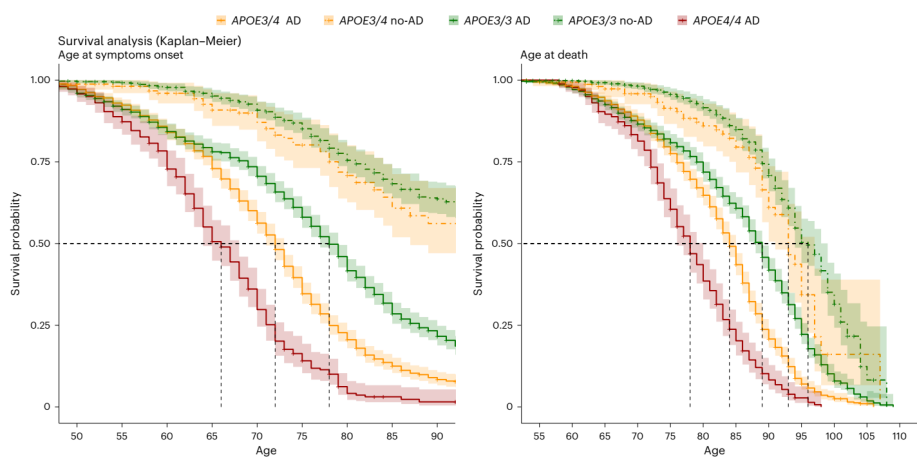
图2. 不同APOE单倍型的生存比较分析
此外,研究团队分析了与其他遗传形式决定的AD相比,APOE4纯合子在症状发作年龄上的差异,并计算了症状发作的95%预测区间。结果显示,APOE4纯合子症状发作的可预测性和生物标志物变化序列与常染色体显性AD和DSAD一致,其95%预测区间较窄;APOE3 纯合子的可预测性则显著更高。
03 APOE4纯合子个体AD生物标志物变化
为探索生物标志物变化的时间,研究团队采用“症状发作的估计年数”这一概念,将基线年龄设置为65.6岁至0(APOE4纯合子的症状发作年龄),比较了AT(N)框架中 几个生物标志物随年龄变化的轨迹,以及APOE4和APOE3纯合子的估计症状发作年龄相关轨迹。
结果显示,APOE4纯合子脑脊液pTau和血浆pTau浓度的变化轨迹相似,50岁出头参与者中,其pTau浓度在症状出现前10-15年左右开始增加。在神经退行性生物标志物方面,神经纤维丝轻链(NfL)的血浆浓度在所有队列中均呈急剧上升趋势,其模式与海马萎缩相似。值得注意的是,海马开始萎缩的时间很难确定,因为在所有年龄和所有单倍型中,海马体积都随着年龄的增长而急剧下降,这可能反映了APOE4对颞叶内侧神经发育的影响。但无论如何,APOE4纯合子在第六个十年末明显呈现出不同的海马体积。
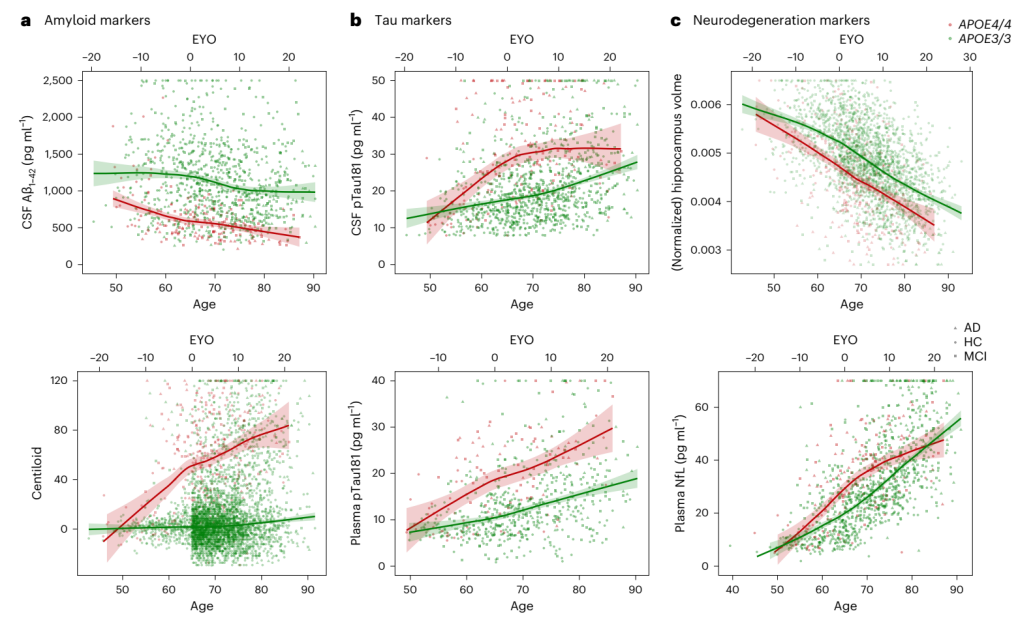
图3. APOE3和APOE4纯合子AD生物标志物随年龄的变化
04 ADAD与唐氏综合征的比较
研究团队利用APOE4纯合子和认知未受损的APOE3纯合子之间的标准化差异构建并整合了一个生物标志物变化模型,以更好地表征APOE4纯合子病理生理变化的顺序和速率,并将其与ADAD和DSAD中表征的相同模型进行比较。组合模型清楚地显示了三种遗传条件下生物标志物变化的时间相似性。
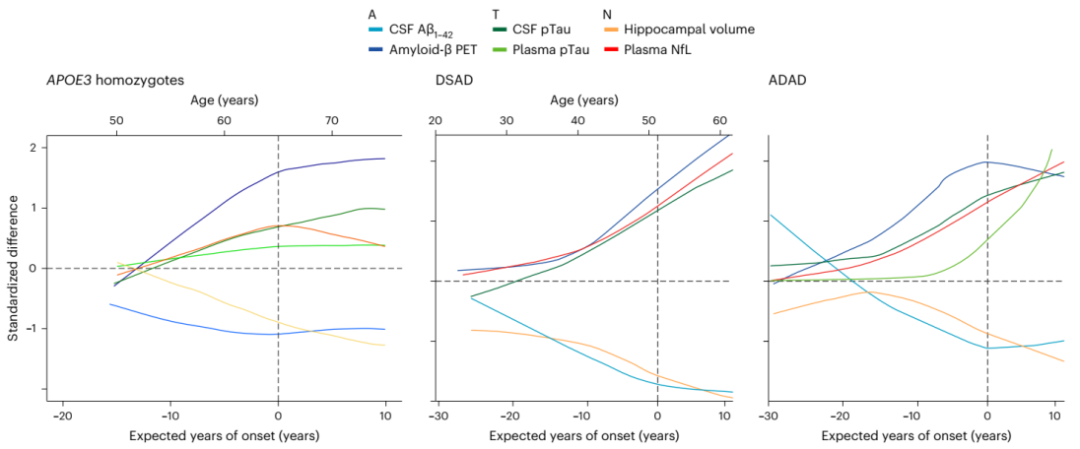
图4. APOE4纯合子AD生物标志物变化的集成模型
05 不同单倍型AD痴呆阶段的生物标志物变化
研究团队还分析了诊断为AD痴呆的患者中生物标志物随年龄的变化。与神经病理学结果一致,几乎所有具有至少一个APOE4等位基因的AD痴呆患者都是淀粉样蛋白PET阳性(无论年龄大小),而APOE3纯合子中淀粉样PET阳性随年龄增长而下降。
为评估单倍型之间AD生物学是否存在差异以及与年龄的潜在关联,研究团队选择了那些被诊断为AD痴呆和淀粉样蛋白PET扫描阳性的患者,并检查了tau和淀粉样蛋白生物标志物的差异。有趣的是,研究结果显示单倍型之间无显著差异。不同单倍型之间在tau-PET摄取方面也无差异,但所有单倍型Braak区域的au-PET 摄取随着年龄的增长而降低。上述结果表明,不同疾病严重程度单倍型之间tau摄取的差异,可能是由APOE4纯合子相对于其他单倍型更早发病所导致。
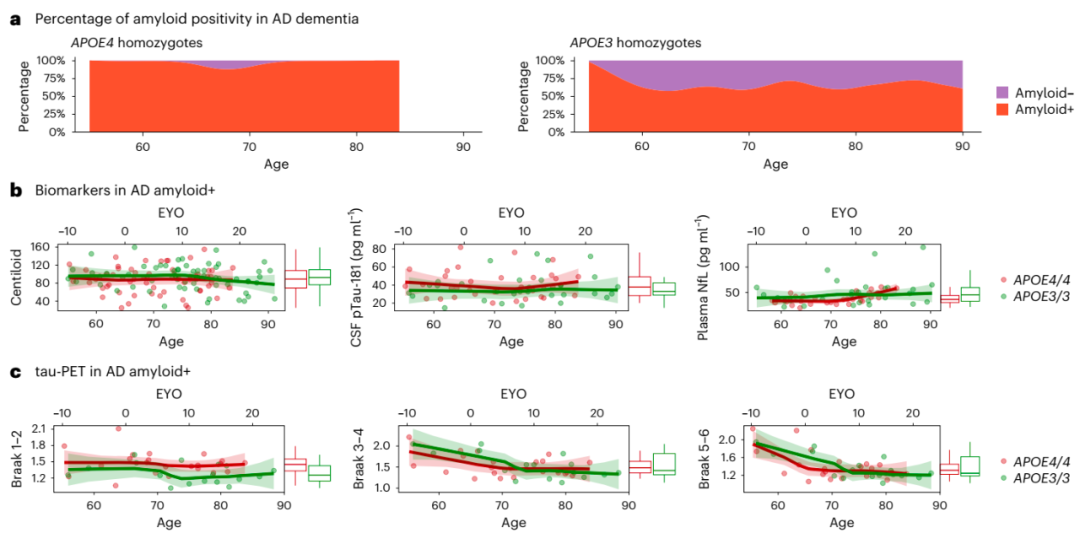
图5. AD痴呆患者的生物标志物变化
结语
综上所述,研究团队利用NACC队列的独特资源,并收集了具有多模态AD生物标志物的多中心队列,分析了超500个APOE4纯合子个体,以评估其临床、病理和生物标志物变化。该研究提供了全面的证据,提出APOE4纯合子代表了一种独特的、遗传决定的AD形式,类似于ADAD和DSAD,需要个性化的预防策略、临床试验和治疗,这对于公共卫生、携带者的遗传咨询和未来的研究方向具有重要意义。
参考原文
Fortea, J., Pegueroles, J., Alcolea, D. et al. APOE4 homozygozity represents a distinct genetic form of Alzheimer’s disease. Nat Med (2024). https://doi.org/10.1038/s41591-024-02931-w.
https://www.nature.com/articles/s41591-024-02931-w