近年来,FGFR(纤维母细胞生长因子受体)基因在多种癌症中被发现存在致病性变异,包括胆管癌、膀胱癌和多种实体瘤,这些变异通常与肿瘤的发生和发展密切相关,FGFR基因的变异包括点突变、融合和重排,这些变异导致FGFR信号通路的异常激活,从而促进肿瘤生长,因此,FGFR抑制剂作为一种针对特定分子靶点的靶向药物,在治疗携带FGFR变异的癌症患者方面具有潜在的应用价值,目前,已有几种FGFR抑制剂在胆管癌和膀胱癌等特定适应症中获得了批准,然而,这些抑制剂对其他实体瘤的疗效尚不清楚,为了探索FGFR抑制剂在治疗其他实体瘤中的应用潜力,研究者开展了本项开放标签、单臂、多中心的第2期篮子试验,评估了培米加替尼对之前治疗的实体肿瘤患者的疗效,该研究的主要目标是研究培米加替尼对FGFR1-3融合/重排和FGFR非激酶域的单核苷酸变异(SNVs)的客观响应率,通过招募不同类型的FGFR变异的实体瘤患者,研究者对培米加替尼的疗效进行了评估。

方法
该研究采用了开放标签、单臂、多中心第2期篮子试验设计,评估了FGFR抑制剂培米加替尼在具有FGFR1-3融合/重排或突变的患者中的安全性和有效性,该研究计划纳入约60例队列A患者和90例队列B患者,队列C的样本量约为20例,所有患者均接受口服培米加替尼,剂量为13.5 mg,每日一次,持续给药,直到影像学疾病进展、不可接受的毒性、撤回同意或医生决定,主要终点为独立评审委员会确认的队列A和B的客观缓解率(ORR),次要终点包括队列A和B的PFS、DOR和OS,以及安全性评估。
研究结果
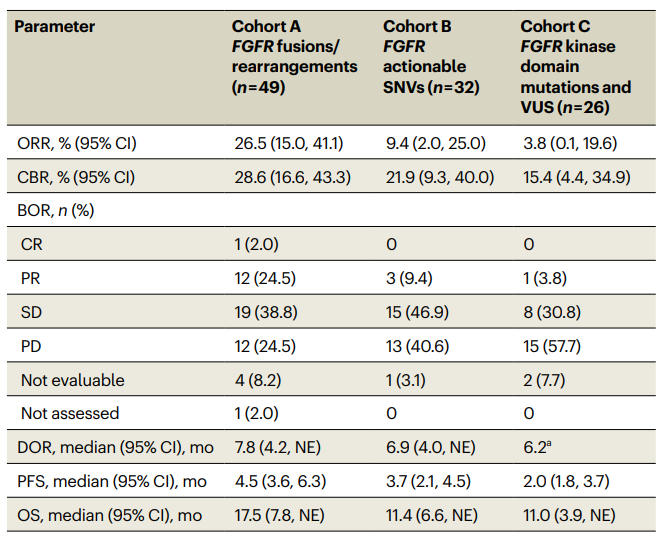
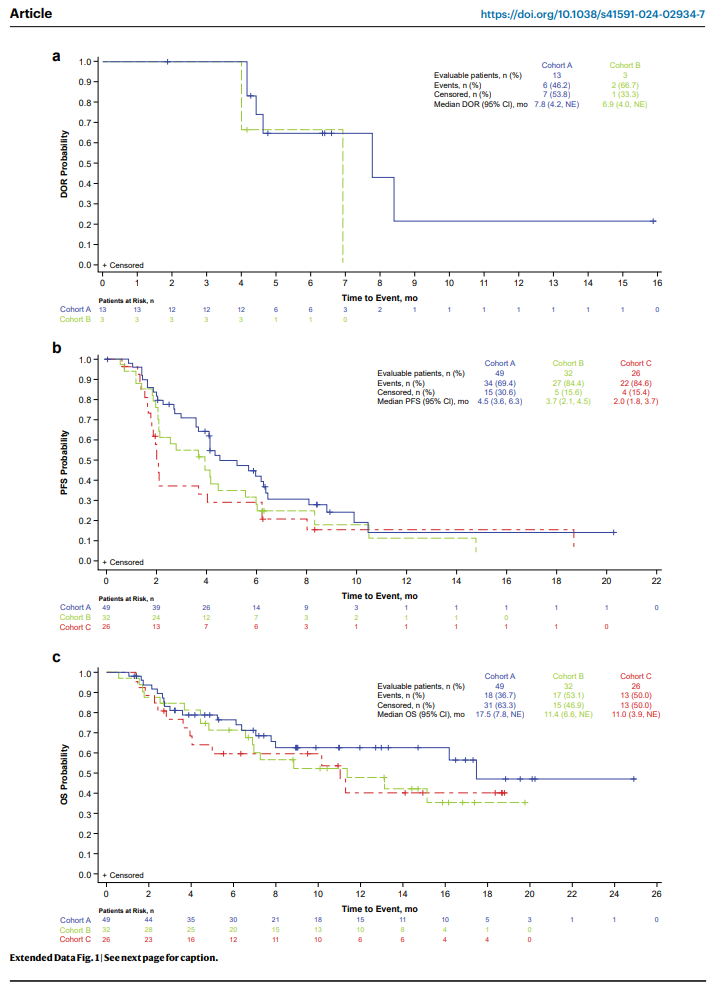
队列A(FGFR1-3融合/重排)和队列B(FGFR1-3非激酶区可操作SNV)的ORR分别为26.5%和9.4%,而队列C(FGFR1-3激酶区突变或VUS)的ORR仅为3.8%。队列A和B的中位PFS分别为4.5个月和3.7个月,中位DOR分别为7.8个月和6.9个月,中位OS分别为17.5个月和11.4个月。
安全性分析
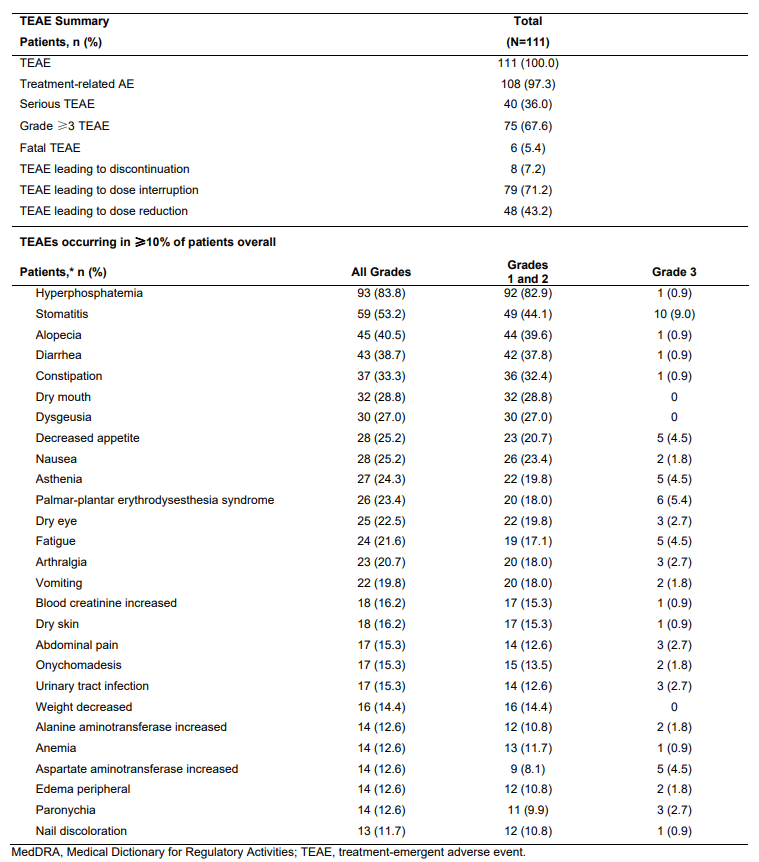
治疗相关不良事件(TEAEs)发生率为97.3%,严重TEAEs发生率为36%,治疗相关TEAEs导致剂量中断的比例为71.2%,剂量减少的比例为43.2%,有6例患者(5.4%)因TEAEs而停止治疗,最常见的不良事件为高磷血症(84%)、口炎(53%)、指甲毒性(45%)和视网膜脱离(14%),没有发生4级或更高级别的TEAEs,大多数患者在治疗期间出现的TEAEs为1级或2级,死亡事件为6例,与培米加替尼的使用无关。
结论
该研究是一项开放标签、单臂、多中心第2期篮子试验,评估了培米加替尼在具有FGFR1-3融合/重排或突变的患者中的安全性和有效性,研究结果表明,培米加替尼对FGFR1-3基因突变或融合的患者表现出一定程度的抗肿瘤活性,并显示出与先前报道一致的安全特征,治疗相关不良事件主要限于1级或2级,且与先前报道一致,获得性耐药机制与FGFR1-3激酶区关键残基突变相关,该研究确定了培米加替尼治疗的一些潜在疗效生物标志物和耐药机制,为FGFR抑制剂治疗新适应症提供了临床证据,然而,由于研究的样本量有限,研究结果需要在更大规模的随机对照试验中得到进一步验证,此外,该研究对培米加替尼在特定FGFR变异类型和肿瘤类型中的疗效提供了初步的证据,但需要更深入的研究来确定其潜在的治疗价值。
原始出处
Rodón, J., Damian, S., Furqan, M. et al. Pemigatinib in previously treated solid tumors with activating FGFR1–FGFR3 alterations: phase 2 FIGHT-207 basket trial. Nat Med (2024). https://doi.org/10.1038/s41591-024-02934-7.