约30%的非小细胞肺癌(NSCLC)患者适合手术治疗,早期NSCLC完全手术切除的患者有治愈希望。然而,术后复发是肺癌患者最致命的潜在威胁,约45%-76%的患者术后在5年内复发。标准的辅助铂双药化疗可使复发率降低15%,然而5年总生存期(OS)获益有限,为5%。早期辅助试验的结果导致同时进行的新辅助试验停止,并在某种程度上阻碍了新辅助化疗的探索。来自meta分析的新辅助证据表明,术前化疗使5年OS率提高了5%,这与辅助治疗结果相似。这一有限的生存获益表明在系统性控制中迫切需要新的治疗策略。
随着靶向治疗和免疫检查点抑制剂在晚期NSCLC治疗中疗效的提高,这些新疗法被整合到围手术期护理中,改变了可切除NSCLC患者的临床管理标准。奥西替尼是首个获得FDA批准用于EGFR突变NSCLC辅助治疗的靶向药物,随后纳武单抗联合化疗、阿特珠单抗和帕博利珠单抗分别获得免疫治疗在围手术期和辅助治疗中的批准。同时,随着早期NSCLC治疗的快速发展,如何在临床实践中选择最好的治疗方案成为亟待解决的问题。(图1)
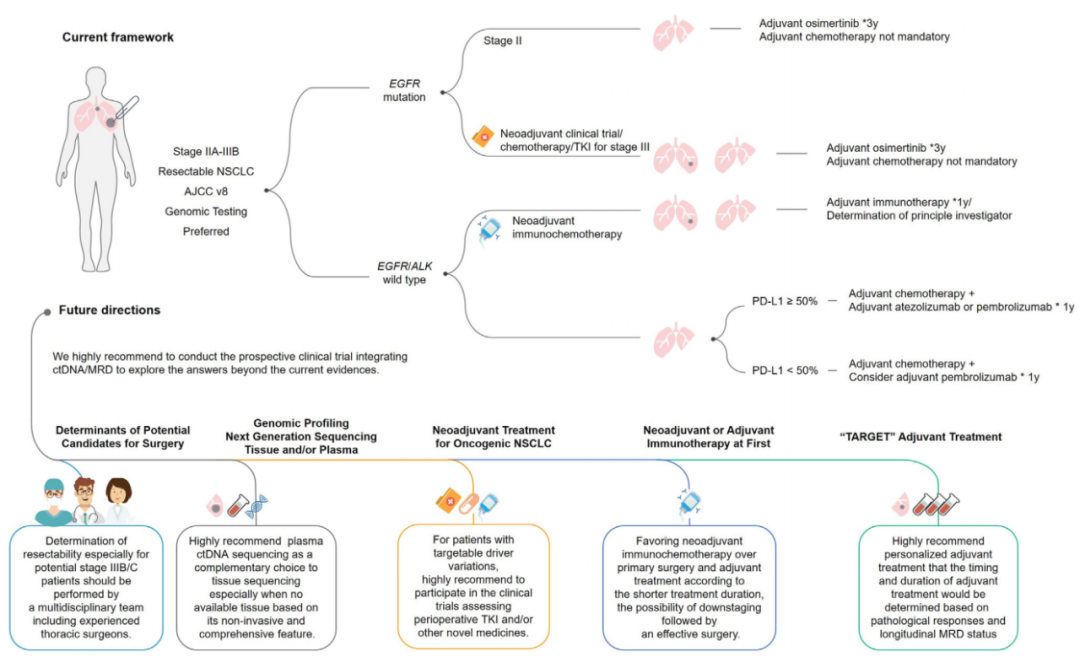
图1.早期NSCLC的治疗模式
近日,广东省人民医院、广东肺癌研究所吴一龙教授团队在Cancer Cell发表了题为“Immunotherapy in resectable NSCLC: Answering the question or questioning the answer?”的评论文章,总结了NSCLC免疫治疗的临床试验结果,对如何确定免疫治疗的最佳受益人群、治疗持续时间和优先治疗模式指出了方向,强调将循环游离DNA(ctDNA)监测有效地纳入临床试验设计,并提供明确的治疗指导至关重要。

文章发表在Cancer Cell
1.IMpower010研究显示,PD-L1 R1%的II-IIIA期患者的无病生存期(DFS)在辅助阿特珠单抗治疗后显著提高(HR=0.66),在PD-L1 R50%组中DFS获益更为显著(HR=0.43)。阿特珠单抗已成为FDA批准的首个用于II至IIIA期PD-L1 R1% NSCLC患者的辅助治疗免疫检查点抑制剂,欧洲药品管理局(EMA)批准了PD-L1 R50% NSCLC患者的辅助阿特珠单抗治疗。
2.KEYNOTE-091研究显示,与安慰剂相比,辅助性帕博利珠单抗治疗显著延长了DFS,所有水平PD-L1的IB-IIIA期患者的DFS在辅助性帕博利珠单抗治疗后显著提高(HR=0.76)。辅助性帕博利珠单抗获得了FDA相对更广泛的适应症批准,包括未接受过辅助化疗的患者,以及无论PD-L1表达水平的IB-IIIA期NSCLC患者。
3.CheckMate816研究首次比较了新辅助纳武利尤单抗联合铂类双药化疗与单独化疗在可切除的IB-IIIA期NSCLC患者中的疗效,纳武利尤单抗联合铂类双药化疗获得了24.3%的完全缓解率(pCR)和63.8%的2年无事件生存率(EFS),这有助于FDA批准纳武利尤单抗联合铂类双药化疗作为可切除NSCLC患者的新辅助治疗。
4.近期的CheckMate77T研究了4周期术前纳武单抗联合铂类双药化疗,随后进行1年术后纳武单抗治疗,在IIA-IIIB期NSCLC患者中取得了25.3%的pCR,将死亡或进展风险降低42%。
5.全球AEGEAN随机试验研究了术前术后抗PD-L1抑制剂度伐利尤单抗,取得了17.2%的pCR和63.3%的2年EFS。
6.NEOTORCH试验中,IIIA-B期NSCLC患者接受3周期术前特瑞普利单抗联合铂类双药化疗,随后进行1周期术后免疫化疗和1年术后特瑞普利单抗治疗,取得了24.8%的pCR和66.7%的2年EFS。
7.KEYNOTE-671试验中,帕博利珠单抗联合治疗方案取得了18.1%的pCR和61.5%的2年EFS(HR=0.59),以及67.1%的4年OS(HR=0.72)。FDA批准了术前帕博利珠单抗联合铂类双药化疗,术后继续使用单药帕博利珠单抗治疗可切除NSCLC(IIA-IIIB)。
随着免疫疗法进入围手术期,越来越多的临床试验正在扩大可切除NSCLC治疗的证据基础。随着证据的增加,更多的问题也随之而来。确定最佳治疗模式(无论是新辅助、辅助还是两者结合)是至关重要的一步,尤其是确定哪些患者受益最大。这个决策过程需要一个多学科的治疗团队,能够利用组织和血浆基因组检测来告知治疗选择。
01 优先考虑哪种治疗方案?
新辅助、辅助和新辅助后辅助免疫治疗是可切除NSCLC的三种典型治疗模式。
CheckMate816试验确立了免疫化疗在新辅助治疗中的关键作用,同时仍有关键的不确定性,即无法明确在新辅助免疫化疗后进行额外的辅助免疫治疗的必要性和增量价值。疗效数据显示,新辅助免疫化疗可获得17%-25%的pCR,额外的辅助免疫治疗可将2年EFS率提高至62%-67%。CheckMate816提示,在手术前接受3个周期、近9周的免疫化疗,即可实现同等疗效,这意味着较短的治疗时间可获得相当的结果。
目前尚无确凿证据表明已经达到pCR的患者是否需要接受额外的辅助免疫治疗,以及在初始新辅助免疫化疗后,高分期可切除NSCLC患者和残余存活肿瘤是否需要接受额外的辅助治疗。未来试验可能需要关注这三种策略的调整定制,并确定哪些患者真正受益于辅助免疫治疗。
02 新辅助治疗、辅助治疗的最佳持续时间是多少?
目前新辅助免疫化疗周期还没有固定标准,且相似的pCR率表明,更多的周期并不总是与更好的反应相关。例如,CheckMate 816试验提供了3个周期的新辅助治疗,最终手术率为83.2%,而KEYNOTE-671试验提供了4个周期,最终手术率为82.1%,两者相似。此外,并非所有患者都能完成4周期新辅助治疗,延长新辅助治疗可能存在错过治愈手术窗口的潜在风险,因为在新辅助免疫化疗期间,近3.8%-6.7%的患者由于疾病进展而无法接受最终手术。
对于辅助治疗,1年的辅助免疫治疗是常见的设定,但最佳治疗周期仍不明确。由于最佳持续时间尚不清楚,我们需要关注如何确认新辅助免疫化疗的治疗反应。ctDNA最小残留病(MRD)分析被认为是最有希望的方法,可及时识别高风险复发患者,以避免过度治疗或治疗不足。虽然该方法敏感性仍有局限性,但术前和术后ctDNA清除率与pCR和ctDNA/MRD阴性的正相关可能识别潜在的无需辅助治疗的可治愈组。
未来还需要前瞻性临床试验来确定ctDNA/MRD检测能否指导个性化治疗,改变疾病发展轨迹,并提高患者生存益处。
03 新辅助免疫化疗能否重新定义手术的候选者?
新辅助免疫化疗在III期非小细胞肺癌患者中显示出显著的诱导放射性反应能力,约0.6%的患者在完成新辅助免疫化疗后影像学扫描完全缓解。
这里涉及一个悬而未决的问题:如果原发肿瘤在影像上看不见,或者随着人工智能、放射组学、ctDNA/MRD检测的发展,如果术前已经确认了pCR,手术还会是强制性的吗?
这种显著的能力降低了新辅助免疫化疗患者的分期,也为IIIB期NSCLC提供了潜在的手术机会。此外,在新辅助免疫化疗的驱动下,不确定可切除或不可切除的III期NSCLC可能会转移到可切除状态。一项前瞻性的平台临床试验(NCT04580498)显示,约25.2%的不可切除III期NSCLC患者接受3周期SHR-1701(一种PD-L1/TGF-b抗体)治疗后转化为可手术机会,并在IIIA、IIIB和IIIC基线患者中实现了25.9%的pCR。
结果表明,我们有可能重新定义原有的可切除性准则,虽然是与新辅助免疫化疗相结合。然而,由于可切除性仍为主观评估,仍需认真考虑是否将边缘可切除或不可切除的患者转介到假定的手术方法。对此,多学科团队在做出正确决定方面发挥着关键作用。
04 对于EGFR或ALK突变的NSCLC,最佳的新辅助治疗方案是什么?
对于具有EGFR突变或ALK改变的晚期NSCLC患者,免疫治疗疗效不如相应的靶向治疗。较低的肿瘤突变负荷(TMB)和肿瘤微环境炎症可能是导致结果受损的原因。
针对NSCLC的新辅助免疫化法的证据有限:一项中心汇集分析研究发现,19名接受2-4个周期新辅助免疫化疗的IIA-IIIB期EGFR突变NSCLC患者,pCR为10.5%;由于42天的治疗时间和肿瘤异质性,IIIA-N2期EGFR突变NSCLC患者尚未实现pCR。一项II期前瞻性研究的中期分析表明,在18名IIB-IIIB期EGFR突变NSCLC患者中,3周期新辅助免疫化疗均未能诱导pCR。
目前,针对NSCLC的新辅助免疫化疗的作用仍存在争议:正在进行的NeoDIANA试验正在评估EGFR突变NSCLC患者使用阿特珠单抗联合化疗和贝伐单抗的新辅助治疗;NeoADAURA试验正在分析奥希替尼的可行性;LCMC4和NAUTIKA1伞状试验正在评估根据包括罕见突变在内的分子基因分型进行匹配的靶向治疗。
05 新辅助免疫治疗的耐药性机制是什么,如何克服?
即使接受新辅助治疗的患者也可能出现疾病复发。对于复发病例,最佳的后续治疗仍有争议。理解这种机制是先决条件。涉及影响免疫调节功能的遗传改变的肿瘤内在机制,例如cGAMP的作用和与适应性肿瘤微环境进化相关的肿瘤外在机制,提供了鼓舞人心的见解。
由于现有研究主要集中在晚期NSCLC上,围手术期免疫化疗缺乏明确的耐药性定义,例如原发性和获得性耐药。总结新辅助和/或辅助免疫治疗后复发部位和复发模式可能是解决这一临床实践关键问题的第一步。
总结与展望
目前,确定围手术期免疫治疗的最佳受益人群、治疗持续时间和优先模式仍然是一个关键挑战。我们迫切需要找到合适的病人,采用合适的治疗方法,并做出准确的选择。
新辅助免疫化疗可能是一种最佳策略,因为其在手术前的治疗时间有限,而且pCR率很高。pCR作为一种新兴的生存替代指标,病理反应的预测因子研究正在进行中。利用新辅助范式平台,未来的转化研究应关注解释关键免疫细胞亚型,挖掘潜在的免疫入侵机制,并根据配对基线和手术样本确定基因组变化。
ctDNA/MRD检测有助于反映肿瘤负荷的动态,以便医生及时识别缓解或进展性疾病。展望未来,我们亟需开发高灵敏度的液体活检方案来检测和监测微量疾病,以便更准确地确定新辅助治疗的持续时间。将ctDNA/MRD检测与临床设计相结合,进一步明确其对快速治疗的指导意义。
未来可能的合理设计是进行新辅助免疫化疗,然后进行“靶向”辅助治疗,以根除微转移性疾病,将根据病理反应和术后MRD灶状态的综合分析给予辅助治疗。MRD监测有助于最大限度地提高治疗效益,并最大限度地降低辅助环境中的毒性风险。
快速增长的围手术期临床试验为可切除NSCLC的治疗提供了新选择。随着有价值的临床试验进一步推动围手术期治疗,医生需要考虑受益人、模式和持续时间做出深思熟虑的临床决策。未来的临床试验将继续致力于回答新出现的问题,并为可切除NSCLC量身定制精准的治疗模式。
论文原文:
Liu SY, Feng WN, Wu YL. Immunotherapy in resectable NSCLC: Answering the question or questioning the answer?. Cancer Cell. 2024;42(5):727-731. doi:10.1016/j.ccell.2024.04.005
https://www.cell.com/cancer-cell/abstract/S1535-6108(24)00129-6