2022年我国新发肺癌106.06万,肺癌相关死亡73.33万,发病率和死亡率均居恶性肿瘤首位[1]。肺癌发病隐匿,确诊时约50%为晚期 ,骨转移是肺癌常见转移部位之一。研究显示肺癌骨转移发生率大约为10%-15%[2],肺癌骨转移后患者的中位生存时间仅为6-10个月[3]。骨相关不良事件严重影响患者的生活质量。随着影像学和核医学技术不断进步,骨转移早诊水平均有所提高。随着肺癌骨转移综合治疗模式的成熟,其生存率逐渐提高。让患者有更长的生存期、更好的生活质量一直是临床医生追求的目标,本文和大家一起分享下肺癌骨转移的特点、临床表现、诊断及治疗。
一、肺癌骨转移的特点
肺癌骨转移的特点是破骨细胞活化导致的骨破坏,病理上以溶骨性病变多见。一旦骨骼中出现肿瘤细胞,则肿瘤细胞、成骨细胞及破骨细胞之间的相互作用会形成恶性循环,使骨转换增加,从而导致溶骨性破坏并促进恶性肿瘤细胞生存。活化的成骨细胞可刺激核因子-κB受体活化因子配体(RANKL),RANKL与核因子-κB受体活化因子受体(RANK)相互作用激活破骨细胞,激活的破骨细胞随后使骨再吸收,导致骨溶解,同时释放生长因子诱导肿瘤细胞持续生长[4]。肺癌骨转移的好发部位在脊柱和躯干骨近端,发生于脊柱者、股骨、肋骨、胸骨分别占50%、25%、12%、12%[3]。46%的肺癌骨转移患者并发骨相关不良事件(SREs),如骨痛、病理性骨折、脊髓压迫、高钙血症及相关治疗带来的痛苦等。肺癌骨转移患者一旦发生SREs,将显著缩短患者生存期。
二、肺癌骨转移的临床表现
仅50%肺癌骨转移患者出现临床症状,骨痛为骨转移最主要的临床症状。病理性骨折常为肺癌骨转移癌的首发症状,约1/3患者以骨转移癌为首发症状而无原发癌表现。肺癌骨转移可影响患者睡眠、情绪、日常生活能力,晚期还可出现乏力、消瘦、贫血、低热等,相关心理痛苦主要表现为焦虑、抑郁、失望及孤独等。
三、肺癌骨转移的诊断
(一)诊断流程
目前公认的骨转移诊断标准为临床确诊肺癌,骨活检阳性或有明确的骨转移影像诊断。对于确诊肺癌患者且有骨转移高危因素,初筛应首选放射性核素骨显像(bone scintigraphy,BS),特别是有骨转移的高危人群(如骨痛、高钙血症、高碱性磷酸酶、脊髓压 迫症状等)。对于初筛BS阳性的肺癌患者,有必要行CT、磁共振成像(MRI)、正电子发射计算机断层显像/计算机断层显像(PET/CT)或骨活检进一步评估转移病灶,进一步明确诊断。肺癌如仅出现孤立性骨破坏病灶,应积极行病灶骨活检;如确诊肺癌,伴全身多发骨破坏,则不必进行骨活检。具体的诊断流程见图1。
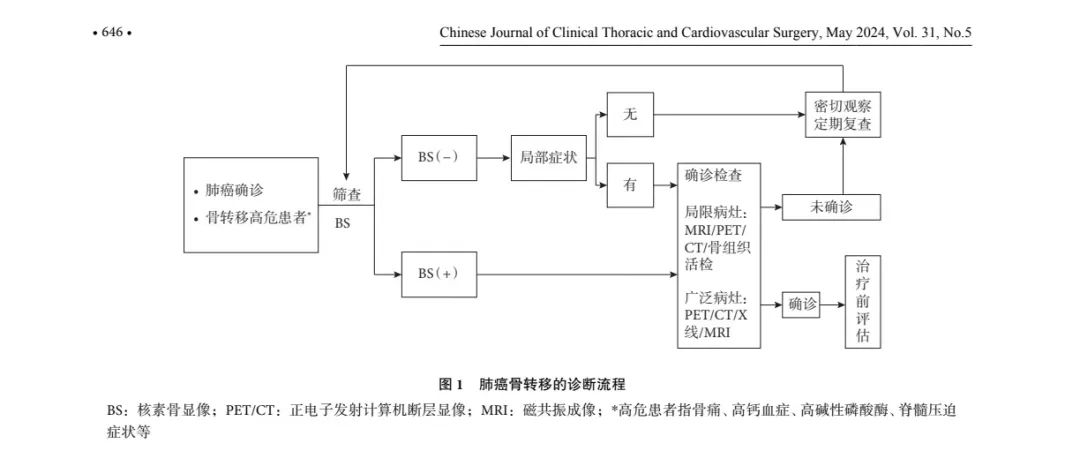
(二)诊断方法
1. 骨扫描
BS的原理是利用示踪剂在成骨细胞活性增加的部位蓄积的特性,反映骨代谢变化,进而提示肺癌骨转移的早期存在。BS检测骨转移兼具敏感性和特异性,全身成像不易漏诊。因此,推荐其作为肺癌骨转移的优选初筛检测方法。但BS无法检测骨髓受累情况,且非转移性骨病变可出现假阳性。故BS需要联合其他影像手段,才能进一步提高诊断准确性。
2. PET/CT和PET/MRI
PET/CT具有更高的空间分辨率,不仅反映全身骨骼受累情况,还可识别更小的病灶。PET/CT诊断骨转移的特异性显著高于BS,但考虑到价格和可及性,一般不推荐常规 PET/CT作为肺癌骨转移的初始筛查手段,除非怀疑肺癌有除骨骼以外的多发转移。PET/MRI作为目前最高端的融合影像设备,集成了MRI和PET的优势,有助于诊断早期骨髓浸润和 PET摄取较低的骨病变。但其对于骨硬化病变特异性较低,且价格高昂,不适合临床常规应用。
3.X线
X线检查由于空间分辨率高、操作简单、费用低廉、辐射较小、有一定特异性,临床上常用于骨痛患者的初步影像学检查。X线平片相比BS和PET/CT,对早期骨转移瘤的诊断往往特异性较高但敏感性较低,比BS显示的骨转移灶晚3-6个月,易漏诊。
4.CT
与X线相比,CT可更好地显示骨的细节,实现骨皮质的高分辨率显像,对骨质破坏及其周围软组织肿块的识别更精准。CT的敏感性与BS接近,推荐用于BS检查阳性而X线平片阴性患者进行CT检查明确诊断;由于CT在骨破坏尚未达到X线片能够检出的程度之前就能检测到骨髓中的溶骨性和成骨性转移,故当怀疑转移瘤位于脊髓时,也推荐行脊柱CT观察椎体稳定性。对于骨皮质的早期转移、骨转移骨髓质的浸润,尤其是在伴有骨质疏松的情况下,CT的敏感性相对较低。
5.MRI
MRI是唯一可以直接显示骨髓腔及其组成结构的成像方法,是检测骨髓病变最敏感的技术。MRI检查转移灶的敏感性高于CT,MRI的准确性高于CT或BS,诊断骨转移的准确性与FDG PET/CT相当。因此,当BS和X线无法确诊,特别是对怀疑髓内及脊髓受累的患者,推荐行MRI检查。
四、肺癌骨转移治疗
肺癌骨转移的防治目标为症状缓解、预防或延缓SREs、最终延长生存期并提高生活质量;必要时还应进行心理干预。肺癌骨转移的治疗推荐遵循MDT制定个体化方案。推荐以肺癌的全身治疗为主,同时联合双膦酸盐和RANKL抑制剂等骨改良药物,预防和延缓SREs;对症止痛治疗可缓解症状,改善生活质量。此外,包括手术和放疗在内的局部治疗可以更好地控制骨转移相关症状。
(一)骨改良药物
1.双膦酸盐
双膦酸盐通过抑制破骨细胞活性而减少骨质吸收和增加矿化,阻止肿瘤转移引起的溶骨型病变、减少骨吸收、减轻骨痛及由骨转移所致的高钙血症及其他SRE。现双膦酸盐类药物已经发展至第3代,以唑来膦酸、伊班膦酸钠和因卡膦酸二钠为代表;相比前2代,除减轻症状、延缓SREs获益外,还可显著降低高钙血症风险、提升骨密度、改善骨代谢。伊班膦酸负荷剂量可快速缓解骨转移患者的疼痛。因卡膦酸相比其他第3代双膦酸盐,发热、肾毒性及下颌骨坏死等不良反应发生率更低。各类双膦酸盐药物的用法用量如图2。

图2
2.RANKL抑制剂
地舒单抗是RANKL抑制剂的代表药物,靶向抑制破骨细胞的分化、活化,打破癌症骨转移的恶性循环过程。推荐的使用方法为皮下给药,每4周 1次,每次120 mg。纳鲁索拜单抗是我国原研的全球首个全人源IgG4 RANKL抑制剂,是国家1类生物制剂。纳鲁索拜单抗与RANKL的亲和力较地舒单抗更强,结合效率提升2.5倍。已在肺癌骨转移患者中完成Ⅰ期及Ⅰb期临床试验。
3.使用疗程及停药指征
虽然骨改良药物可在短时间内改善骨痛症状,但对于SREs则需要超过6个月的治疗时间。有研究显示骨改良治疗超过2年,SREs风险降低,但下颌骨坏死(ONJ)等不良反应的累积风险增加[4]。因此骨改良药物不宜短期治疗,ASCO多发性骨髓瘤指南认为,对于寡转移性疾病控制良好的患者在2年后中断双膦酸盐治疗可行,但其最佳使用时间目前尚无定论。从临床经验的角度,如患者可耐受且治疗符合患者和医生共同治疗目标时,可酌情选择长期治疗。出现严重不良反应或医生认为继续用药无法从治疗中获益是骨改良药物的停药指征。但如果双膦酸盐治疗期间骨痛加重或出现SREs时,应继续用药以降低二次SREs风险,也可以考虑换用地舒单抗或另外一种双膦酸盐,但仍需后续研究进一步[4]。
4.不良反应
双膦酸盐和地舒单抗都可引起ONJ、低钙血症和其他电解质异常以及非典型骨折等并发症。双膦酸盐独有的并发症包括肾功能不全、急性期反应、眼毒性、肌肉骨骼疼痛和心房颤动等;地舒单抗常见的不良反应为肌肉、骨骼疼痛,偶见蜂窝织感染等病例报道,ONJ和非典型性股骨骨折相对罕见[4]。
(二)镇痛治疗
对于合并癌痛的患者,充分评估患者的疼痛,根据患者的疼痛情况酌情使用非甾体类抗炎药、阿片类药物及辅助镇痛药(骨改良药物、糖皮质激素、局部麻醉药、抗惊厥类药物、镇痛性抗抑郁药、骨靶向放射性核素药物等)[4]。
(三)全身治疗
铂类药物为基础的双联方案是此类患者一线化疗的主要选择,可据患者耐受性和疾病特点调整。如果免疫治疗与RANKL抑制剂(地舒单抗)联合应用时,较单药免疫治疗,抑制晚期非小细胞肺癌(NSCLC)患者骨转移的进展效果更优,延长总生存期。为提升骨转移相关NSCLC患者疗效,综合运用化疗联合其他治疗比如抗血管生成疗法、靶向治疗、免疫治疗和骨改良药物等成为趋势。但骨转移的独特性,目前仍难以给出前瞻性、个体化的方案[4]。
(四)局部治疗
1 放疗
外照射是治疗单纯性骨转移的标准治疗,可使50%-80%的患者疼痛缓解,多达1/3的患者实现疼痛完全缓解。立体定向放射治疗主要用于期望寿命较长(>6个月),在标准疗程外照射后仍有骨痛或骨痛复发,并需要再次照射的患者。骨靶向放射性核素治疗适用于经外照射和/或其他形式治疗后仍有疼痛或疼痛复发的多灶性骨痛患者[4]。
2 手术
骨转移的手术治疗通常仅用于有完全性病理性骨折或病理性骨折倾向的病变。对于严格选择的晚期癌症患者,即骨病变是原发部位以外唯一转移灶的患者,整块切除转移灶可使局部肿瘤控制最佳,持久缓解疼痛,并可能延长患者生存期。脊柱转移导致机械性不稳定时,可考虑手术干预[4]。
3介入治疗
症状性肺癌骨转移瘤患者在接受外照射、外科、药物镇痛治疗后或治疗的同时,仍会有部分患者疼痛并未缓解或缓解不充分,或患者的期望寿命有限不适宜外科等其他综合治疗,骨转移瘤的局部介入治疗可有效控制这类患者的局部症状,成为系统治疗的有力补充。介入治疗手段包括:消融治疗、经皮骨成形术、近距离治疗等[4]。
(五)心理支持治疗
肺癌患者抑郁患病率是所有恶性肿瘤中发病率最高的,心理支持主要为心理-社会干预,包括认知-行为学、家庭支持等治疗。如患者合并焦虑抑郁障碍,可联合精神药物治疗,特别是重度焦虑抑郁障碍患者[4]。
参考文献
[1] 郑荣寿,陈茹,韩冰峰等.2022年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2024,46(3):221-231.
[2] Hernandez RK, Wade SW, Lyman GH, et al. Incidence of bone metastases in patients with solid tumors: analysis of oncology electronic medical records in the United States. BMC Cancer, 2018, 18(1): 44.
[3]董智,赵军,柳晨,等. 肺癌骨转移诊疗专家共识(2019版) [J]. 中国肺癌杂志, 2019, 22 (04): 187-207.
[4]支修益,王洁,刘伦旭,等. 中国肺癌骨转移临床诊疗指南(2024版) [J]. 中国胸心血管外科临床杂志, 2024, 31 (05): 643-653.