胶质母细胞瘤(GBM)是一种恶性程度很高的致命性脑肿瘤。由于血脑屏障(BBB)的障碍,大多数化疗药物表现出严重的全身细胞毒性和有限的递送有效性。免疫疗法在侵袭性肿瘤治疗方面具有巨大潜力。令人失望的是,其对GBM的疗效受到免疫抑制肿瘤微环境(TME)和血脑屏障的阻碍。
基于纳米材料-生物相互作用,重庆大学王亚洲教授和尹铁英教授等人开发了一种针对GBM的多重协同免疫治疗策略。研究证明,BM@MnP-BSA-aPD-1可以穿过血脑屏障并靶向TME,从而增强金属免疫疗法和光热免疫疗法(PTT)的协同作用。这种纳米制剂在TME内的旅程有助于干扰素基因通路刺激因子的激活、免疫原性细胞死亡效应的启动以及程序性细胞死亡-1/程序性细胞死配体1(PD-1/PD-L1)信号轴的抑制。这种纳米药物可使免疫抑制性TME恢复活力,并引起抗肿瘤免疫的级联效应。因此BM@MnP-BSA-aPD-1的PTT在抗GBM免疫疗法中表现出良好的益处,并在临床转化应用中显示出巨大的潜力。相关工作以“Multiple Synergistic Effects of the Microglia Membrane-Bionic Nanoplatform on Mediate Tumor Microenvironment Remodeling to Amplify Glioblastoma Immunotherapy”为题发表在ACS Nano。

【文章要点】
在本研究中,作者提出了一种多重联合协同抗GBM疗法。为了制备BM@MnP-BSA-aPD-1,将锰卟啉衍生物meso-四甲苯基卟啉Mn(III)氯化物(MnP)和牛血清白蛋白(BSA)通过自组装方法结合,构建了MnP-BSA纳米粒子。然后,通过二硫键桥接将抗免疫检查点抑制剂PD-1(aPD-1)的抗体掺入纳米颗粒中,以增强肿瘤免疫治疗。随后,使用简单的共挤出方法将BV2细胞膜(BM)涂覆在MnP-BSA-aPD-1纳米颗粒上以产生仿生纳米颗粒(BM@MnP-BSA-aPD-1)。BM@MnP-BSA-aPD-1可以穿过血脑屏障并靶向TME,从而响应可谷胱甘肽(GSH)对肿瘤部位有效、可控地释放包封的组分(Mn2+、卟啉大环和抗PD-1抗体)(图1)。
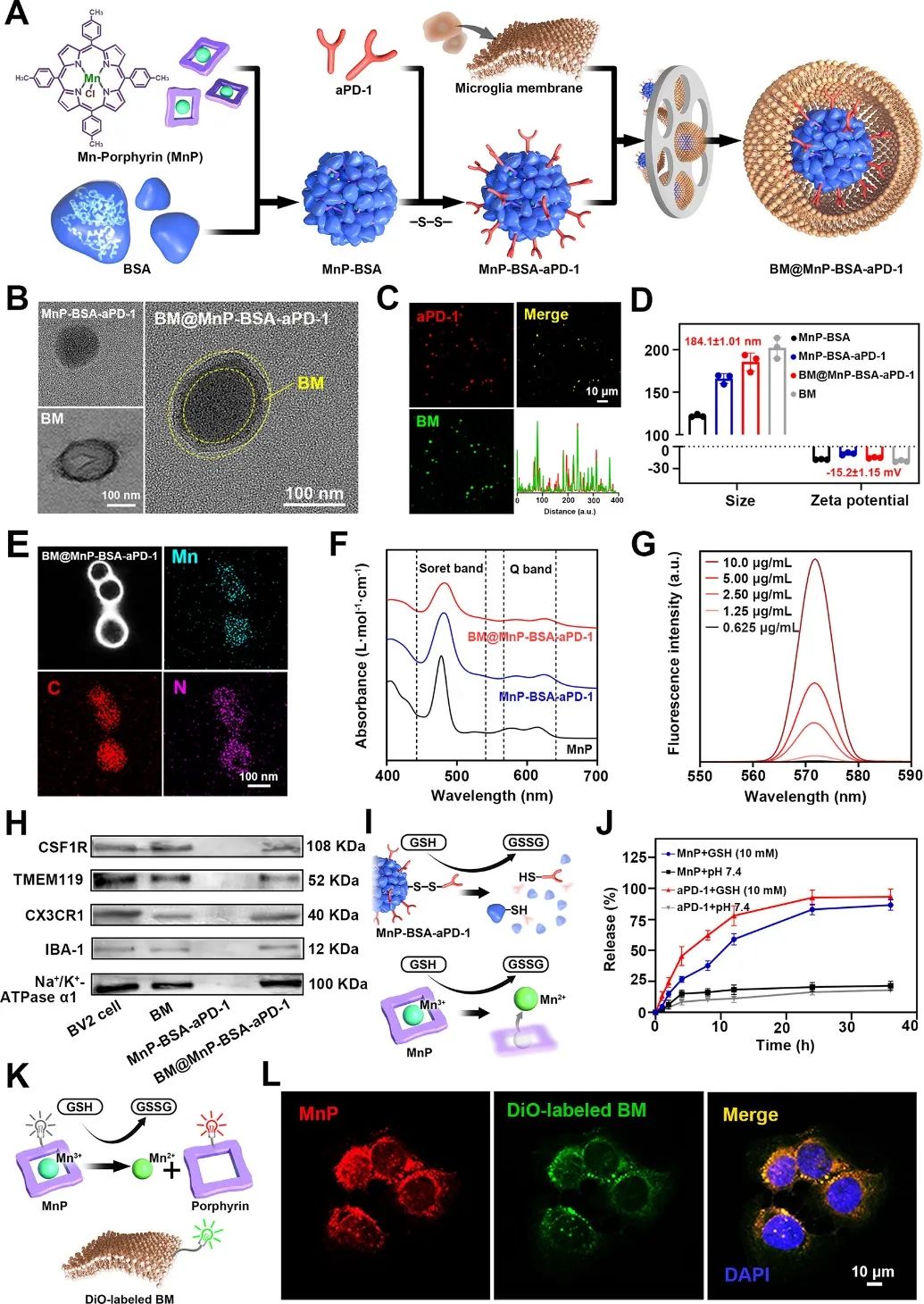
图1 BM@MnP-BSA-aPD-1纳米药物的制备
这些纳米颗粒具有四个功能:(1)BV2小胶质细胞膜(BM)促进血脑屏障穿过并靶向GBM的TME;(2) Mn2+激活cGAS-STING途径以产生I型IFN,该IFN通过促进DC成熟和抗原呈递、刺激CD8+T细胞和NK细胞活化以及增强抗肿瘤免疫疗法来增强先天和适应性免疫;(3) 卟啉对NIR激光的反应直接消融肿瘤并诱导ICD效应,其导致TAAs和DAMP释放、DC成熟、增强CD8+T细胞浸润和扩增抗肿瘤免疫反应;和(4)仿生纳米颗粒与抗PD-1抗体的组合阻断PD-1/PD-L1信号轴,抑制免疫逃逸,并协同上调抗肿瘤反应。正如预期的那样,基于PTT和免疫疗法的结合,这种不含化疗药物的纳米药物递送系统为抗GBM靶向治疗提供了一种替代策略(图2)。
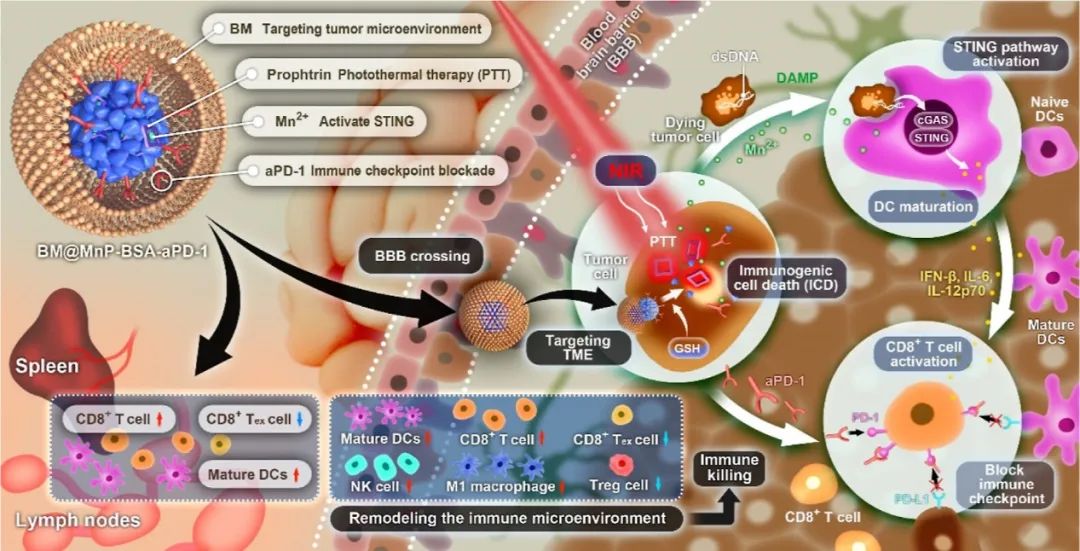
图2 BM@MnP-BSA-aPD-1纳米药物的多重协同作用
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c01253