前药已被探索作为传统化疗的替代品;然而,它们的靶点特异性仍然有限。而肿瘤微环境包含一系列微生物,这些微生物有望作为递送前药的肿瘤靶向载体。
有鉴于此,新加坡国立大学Matthew Wook Chang和新加坡科技学院In Young Hwang等人利用肿瘤微生物组固有的细菌-癌症相互作用来实现前药递送的高靶向特异性。作者首先鉴定了一种具有内在癌症结合机制的植物乳杆菌口服共生菌株,并设计该菌株以使抗癌前药能够在其表面负载,并以鼻咽癌(NPC)作为癌症模型。工程化的共生菌通过OppA介导的对表面硫酸乙酰肝素的识别显示出与NPC的特异性结合,并且负载的前药可被肿瘤相关的生物信号激活,在NPC附近释放SN-38(一种化疗化合物)实现治疗作用。相关工作以“Prodrug-conjugated tumor-seeking commensals for targeted cancer therapy”为题发表在Nature Communications。

【文章要点】
为了优化前药的使用,该文的目标是利用肿瘤微生物组中细菌和癌症细胞之间的内在相互作用来精确施用前药。大量研究已经表明,包括鼻咽、乳腺、卵巢和结直肠癌在内的各种癌症组织都含有共生微生物,这些微生物形成独特的癌症微生物群,可能影响宿主肿瘤细胞的致癌、发展和治疗。基于这些发现,作者提出了一个假设,即可以精确定位具有癌症结合能力的共生微生物,并设计它们将前药精确地输送到特定的癌症部位。有效载荷前药可以通过化学连接体与细菌载体偶联,以确保天然药物的位点特异性释放。为了验证这一假设,作者识别和表征了具有与癌症细胞结合能力的共生微生物,并随后利用鼻咽癌(NPC)作为癌症的代表性模型,对这些微生物进行改造,使其能够将化疗药物精确输送到癌症部位(图1)。
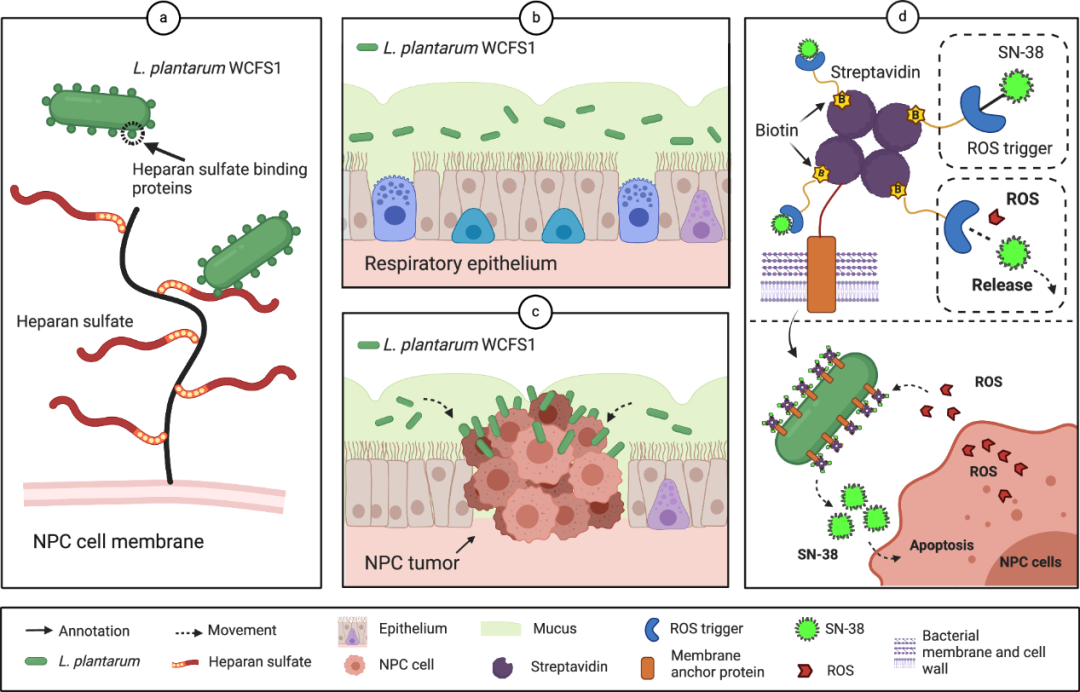
图1 工程化Lp以递送SN-38前药
在这项工作中,作者鉴定并表征了一种人类口服分离物——植物乳杆菌WFCS1(Lp)菌株——该菌株可通过寡肽结合(OppA)蛋白和硫酸乙酰肝素介导的相互作用与NPC特异性结合。作者设计在Lp表面呈现四聚体链亲和素,从而能够装载可以进行生物转化的生物素化前药化疗剂SN-38(TL-SN)。首先,表面负载模式有助于保护前药不被细菌内复杂的细胞内生物化学代谢。这种保护扩大了可使用的潜在化疗药物的范围。其次,通过嵌入的硫酮连接体实现了TL-SN的位点特异性转化。因此,工程化Lp与负载的前药显示出显著的协同作用,导致SN-38所需的半最大抑制浓度(IC50)降低高达10倍。在NPC小鼠异种移植物模型中,通过工程化Lp递送前药可抑制67%的肿瘤生长,使SN-38的疗效显著提高54%(图2)。
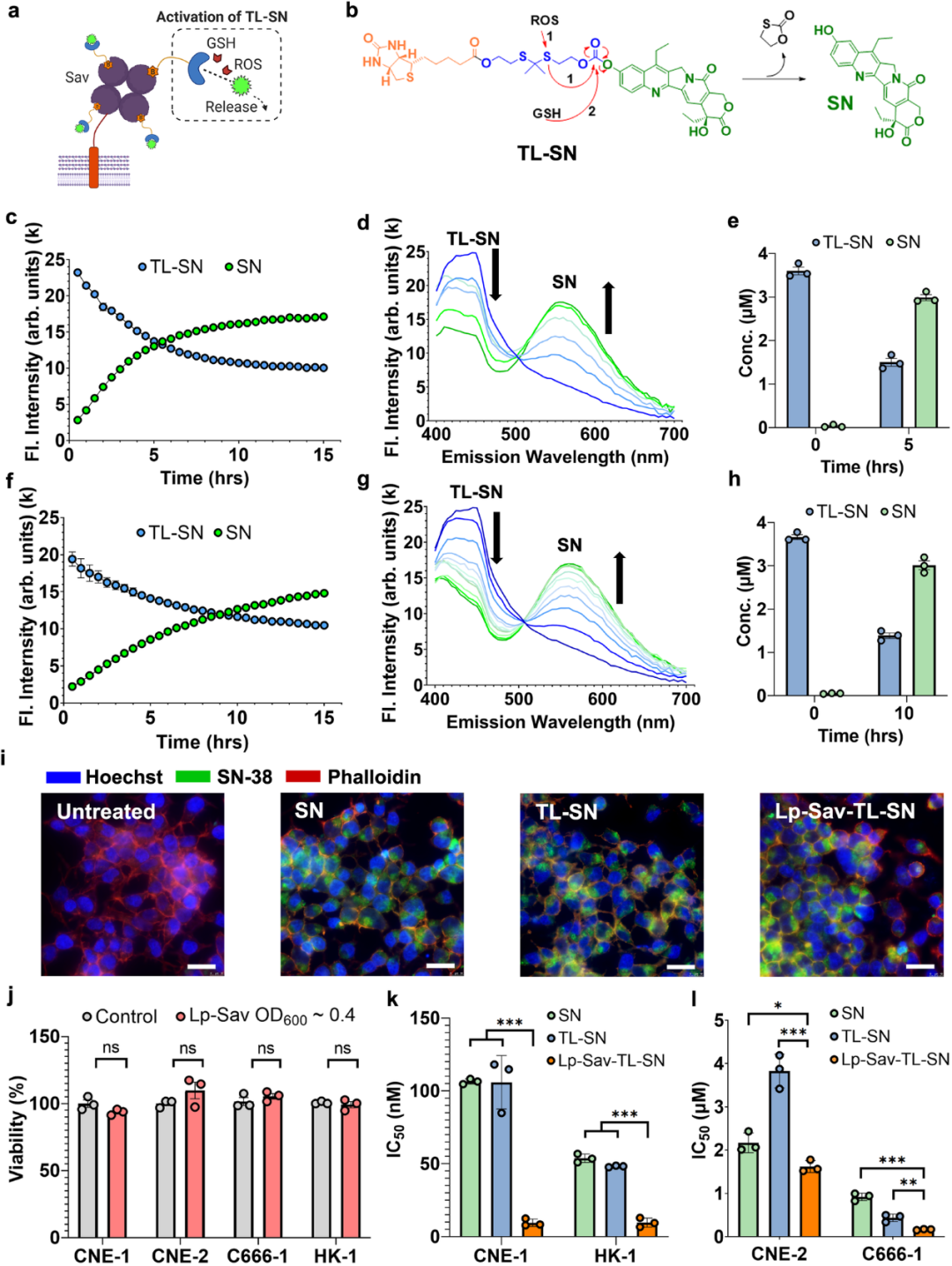
图2 从Lp表面释放前药并进行转化
原文链接:
https://www.nature.com/articles/s41467-024-48661-y