脂滴与线粒体拴在一起进行脂肪酸氧化是肿瘤细胞抵消能量应激的关键。然而,其潜在机制尚不清楚。
2024年5月21日,浙江大学吕志民及许大千共同通讯在Nature Metabolism 在线发表题为“Glycolytic enzyme PFKL governs lipolysis by promoting lipid droplet-mitochondria tethering to enhance β-oxidation and tumor cell proliferation”的研究论文,该研究表明糖酵解酶PFKL通过促进脂滴-线粒体系结来促进β-氧化和肿瘤细胞增殖,从而控制脂肪分解。该研究证明了葡萄糖剥夺诱导糖酵解酶磷酸果糖激酶,肝型(PFKL)的磷酸化,降低其活性并有利于其与perilipin 2 (PLIN2)的相互作用。
在脂滴上,PFKL作为蛋白激酶磷酸化PLIN2,促进PLIN2与肉毒碱棕榈酰基转移酶1A (CPT1A)结合。这导致脂滴和线粒体的捆绑,脂肪甘油三酯脂肪酶聚集到脂滴-线粒体捆绑区参与脂动员。在雄性小鼠中,干扰这一级联反应可抑制肿瘤细胞增殖,促进细胞凋亡并抑制肝肿瘤生长。这些结果表明,能量应激赋予PFKL作为一种蛋白激酶的月光功能,将脂滴与线粒体连接起来,并突出了PFKL在糖酵解、脂质代谢和线粒体氧化的综合调控中的重要作用。
 脂滴由中性脂质的核心组成,主要由三酰甘油和胆固醇酯组成,是细胞内重要的代谢中心。脂滴被包裹在一层极性的、两亲性的磷脂中,并被属于PLIN家族的结构蛋白修饰。具体来说,PLIN1主要存在于脂肪细胞中,而PLIN2和PLIN3则普遍表达。PLIN调节位于脂滴上的中性脂的合成和水解的酶,在脂滴的形成和稳定中起着关键作用。
在快速增殖的肿瘤中常见的营养胁迫下,细胞使用两种主要机制来氧化储存在线粒体内脂滴中的脂肪酸以产生能量,这一过程被称为脂肪酸氧化(FAO)或β-氧化。第一种机制是自噬介导的脂肪分解,称为大脂噬,它涉及自噬体吸收脂滴,随后将它们输送到溶酶体,由溶酶体-管腔脂肪酶水解。在伴侣蛋白介导的自噬作用下,PLIN2和PLIN3的降解促进了脂滴与自噬体的关联。第二种机制是脂滴的脂解消耗,其中细胞质中性脂肪酶如脂肪甘油三酯脂肪酶(ATGL)直接将三酰基甘油水解成脂肪酸和二酰基甘油。后者随后水解成甘油和其他脂肪酸。考虑到这些脂肪酸的运输可能发生在靠近脂滴的线粒体中,线粒体必须表现出高融合水平并靠近脂滴。此外,它还涉及脂滴相关蛋白和线粒体蛋白。然而,脂滴和线粒体的附着和拴系是如何被调节的在很大程度上是未知的。
脂滴由中性脂质的核心组成,主要由三酰甘油和胆固醇酯组成,是细胞内重要的代谢中心。脂滴被包裹在一层极性的、两亲性的磷脂中,并被属于PLIN家族的结构蛋白修饰。具体来说,PLIN1主要存在于脂肪细胞中,而PLIN2和PLIN3则普遍表达。PLIN调节位于脂滴上的中性脂的合成和水解的酶,在脂滴的形成和稳定中起着关键作用。
在快速增殖的肿瘤中常见的营养胁迫下,细胞使用两种主要机制来氧化储存在线粒体内脂滴中的脂肪酸以产生能量,这一过程被称为脂肪酸氧化(FAO)或β-氧化。第一种机制是自噬介导的脂肪分解,称为大脂噬,它涉及自噬体吸收脂滴,随后将它们输送到溶酶体,由溶酶体-管腔脂肪酶水解。在伴侣蛋白介导的自噬作用下,PLIN2和PLIN3的降解促进了脂滴与自噬体的关联。第二种机制是脂滴的脂解消耗,其中细胞质中性脂肪酶如脂肪甘油三酯脂肪酶(ATGL)直接将三酰基甘油水解成脂肪酸和二酰基甘油。后者随后水解成甘油和其他脂肪酸。考虑到这些脂肪酸的运输可能发生在靠近脂滴的线粒体中,线粒体必须表现出高融合水平并靠近脂滴。此外,它还涉及脂滴相关蛋白和线粒体蛋白。然而,脂滴和线粒体的附着和拴系是如何被调节的在很大程度上是未知的。
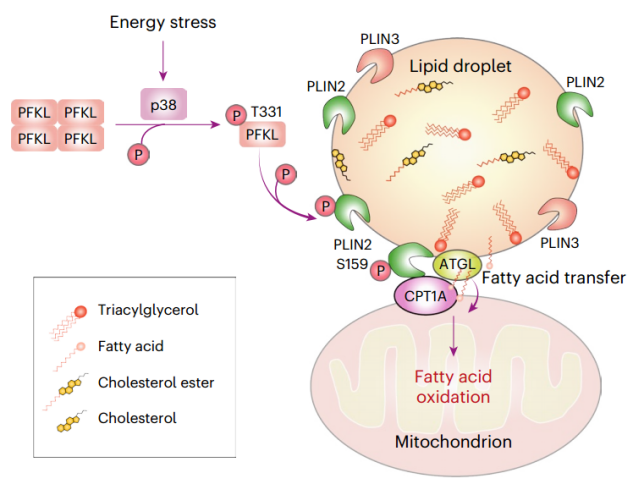 PFKL在HCC细胞中葡萄糖剥夺诱导的脂滴和线粒体栓系中的作用(图源自Nature Metabolism )
该研究证明了葡萄糖剥夺诱导PLIN2与线粒体蛋白CPT1A结合,这是葡萄糖剥夺诱导的脂滴-线粒体拴系所必需的。这是由p38 MAP激酶介导的PFKL Thr331位点磷酸化调控的,PFKL随后与PLIN2结合,并作为一种蛋白激酶磷酸化PLIN2的Ser159位点,导致PLIN2与CPT1A结合,脂滴和线粒体的附着和捆绑,ATGL的募集和随后的肝肿瘤生长的FAO。这些结果表明,能量应激赋予PFKL作为一种蛋白激酶的moonlight功能,将脂滴与线粒体连接起来,并突出了PFKL在糖酵解、脂质代谢和线粒体氧化的综合调控中的重要作用。
原文链接:
https://www.nature.com/articles/s42255-024-01047-2
PFKL在HCC细胞中葡萄糖剥夺诱导的脂滴和线粒体栓系中的作用(图源自Nature Metabolism )
该研究证明了葡萄糖剥夺诱导PLIN2与线粒体蛋白CPT1A结合,这是葡萄糖剥夺诱导的脂滴-线粒体拴系所必需的。这是由p38 MAP激酶介导的PFKL Thr331位点磷酸化调控的,PFKL随后与PLIN2结合,并作为一种蛋白激酶磷酸化PLIN2的Ser159位点,导致PLIN2与CPT1A结合,脂滴和线粒体的附着和捆绑,ATGL的募集和随后的肝肿瘤生长的FAO。这些结果表明,能量应激赋予PFKL作为一种蛋白激酶的moonlight功能,将脂滴与线粒体连接起来,并突出了PFKL在糖酵解、脂质代谢和线粒体氧化的综合调控中的重要作用。
原文链接:
https://www.nature.com/articles/s42255-024-01047-2