[摘要] 背景与目的:曲妥珠单抗的耐药发生率相对较低,可以作为辅助治疗提高临床疗效,既往多用于治疗乳腺癌,在其他癌症中的应用研究较少。本研究旨在探讨曲妥珠单抗辅助改良DOF双周方案对顺铂耐药的胃癌患者血清肿瘤标志物和生存率的影响,以期为顺铂耐药的胃癌患者的临床治疗方式选择提供更多参考。方法:选择2017年1月—2019年1月哈励逊国际和平医院收治的80例顺铂耐药的胃癌患者作为研究对象,按随机数字表法均分为观察组和对照组,均接受改良DOF双周方案治疗,观察组在此基础上加上曲妥珠单抗辅助治疗。比较两组的血清肿瘤标志物[血清癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、CA72-4]、血清新生血管标志物[血管内皮生长因子(vascular endothelial growth factor,VEGF)、色素上皮衍生因子(pigment epithelial derived factor,PEDF)、血管生成素-2(angiopoietin-2,Ang-2)]、生化指标[N端脑钠肽前体(N terminal pro B type natriuretic peptide,NT-proBNP)、天冬氨酸转氨酶(aspartate transaminase,AST)、血尿素氮(blood urea nitrogen,BUN)、丙氨酸转氨酶(Alanine aminotransferase,ALT)]、不良反应及生存率。本研究经哈励逊国际和平医院伦理委员会审查批准(编号:20160511)。结果:治疗后,两组的CEA、CA19-9及CA72-4较治疗前下降,且观察组的CEA、CA19-9及CA72-4检测值均低于对照组,差异有统计学意义(P<0.01)。治疗后,两组的VEGF、PEDF及Ang-2较治疗前下降,差异有统计学意义(P<0.01);两组治疗前后的VEGF、PEDF及Ang-2差异无统计学意义(P>0.05)。两组治疗前后的NT-proBNP、AST、 BUN及ALT差异无统计学意义(P>0.05)。两组的乏力、胃肠道反应、骨髓抑制发生人数占比及不良反应总发生率差异无统计学意义(P>0.05)。治疗后5年,观察组存活11例(27.5%),死亡29例(72.5%);对照组存活3例(7.5%),死亡37例(92.5%),观察组的中位生存期为2年(95% CI:1.8~2.2),对照组的中位生存期为1年(95% CI:0.6~1.4),观察组1~5年存活率高于对照组,差异有统计学意义(log-rank χ2=13.853,P=0.001)。结论:在顺铂耐药胃癌患者的临床治疗中采用曲妥珠单抗辅助改良DOF双周方案能降低血清肿瘤标志物表达水平,提升患者的5年生存率,且用药安全性较高。
[关键词] 胃癌;顺铂耐药;曲妥珠单抗;改良DOF双周方案;肿瘤标志物;生存率
[Abstract] Background and purpose: Trastuzumab has a relatively low incidence of drug resistance, which can be used as an adjuvant treatment to improve clinical efficacy. It has been used to treat breast cancer in the past, but its application in other cancers has been less studied. This study aimed to explore the effects of trastuzumab assisted modified DOF fortnightly regimen on serum tumor markers and survival rate in cisplatin-resistant gastric cancer patients, in order to provide more references for the selection of clinical treatment methods for cisplatin-resistant gastric cancer. Methods: Eighty patients with cisplatin-resistant gastric cancer treated in Harison International Peace Hospital from January 2017 to January 2019 were selected as the study objects, and they were divided into observation group and control group according to random number table method. All of them received improved DOF fortnightly treatment, and trastuzumab adjuvant treatment was added to the observation group on this basis. The serum tumor markers [serum carcinoembryonic antigen (CEA), carbohydrate antigen 19-9 (CA19-9), CA72-4], serum neovascular markers [vascular endothelial growth factor (VEGF), pigment epithelial derived factor (PEDF), angiopoietin-2 (Ang-2)], biochemical indicators [N-terminal pro B type natriuretic peptide (NT proBNP), aspartate transaminase (AST), blood urea nitrogen (BUN), alanine aminotransferase (ALT)], adverse reactions and survival rate were compared between two groups. This study was approved by the Ethics Committee of Harison International Peace Hospital (number: 20160511). Results: After treatment, CEA, CA19-9 and CA72-4 in both groups decreased, and CEA, CA19-9 and CA72-4 levels were lower in the observation group than in the control group with statistical significance (P<0.01). After treatment, VEGF, PEDF and Ang-2 in two groups decreased, and the difference was statistically significant (P<0.01). The levels of VEGF, PEDF and Ang-2 were compared between the two groups before and after treatment, and there was no significant difference (P>0.05). The levels of NT-proBNP, AST, BUN and ALT were compared between the two groups before and after treatment, and there was no statistically significant difference (P>0.05). The number of patients with fatigue, gastrointestinal reaction and myelosuppression and the total incidence of adverse reactions were compared between the two groups, and there was no statistically significant difference (P>0.05). At 5 years after treatment, 11 cases (27.5%) survived and 29 cases (72.5%) died in the observation group. There were 3 cases (7.5%) of survival and 37 cases (92.5%) of death in the control group. The median survival was 2 years (95% CI: 1.8-2.2) in the observation group and 1 year (95% CI: 0.6-1.4) in the control group. The survival rate of 1-5 years was higher in the observation group than in the control group. The difference was statistically significant (log-rank χ2=13.853, P=0.001). Conclusion: In the clinical treatment of cisplatin-resistant gastric cancer, trastuzumab assisted modified DOF fortnightly regimen suggests that it can reduce the expression levels of serum tumor markers, improve the 5-year survival rate of patients, and has certain drug safety.
[Key words] Gastric cancer; Cisplatin resistance; Trastuzumab; Modified DOF fortnightly regimen; Tumor markers; Survival rate
胃癌是一种起源于胃黏膜上皮的恶性肿瘤,常见临床症状为消化不良、上腹痛及饱胀不适等,随着疾病发展部分患者可能会出现呕血、黑便等症状,严重影响身体健康,甚至危及生命[1]。顺铂是较常见的胃癌化疗用药,可达到较显著的癌细胞消灭效果,可控制疾病、抑制癌细胞转移[2]。但在实际诊疗过程中,部分患者可能会发生顺铂耐药[3]。改良DOF双周方案主要由多西他赛、奥沙利铂、亚叶酸钙和5-氟尿嘧啶联合构成,在胃癌中可达到较理想的化疗效果[4]。但对无法接受手术治疗且有顺铂耐药性的胃癌患者而言,单一改良DOF双周方案的疗效有限。曲妥珠单抗是针对人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)膜外部分的单克隆抗体,可阻断HER2的信号转导通路,进而达到抑制肿瘤细胞生长和增殖、促进肿瘤细胞凋亡的目的[5-6]。目前国内相关研究多集中在改良DOF双周方案、曲妥珠单抗单一治疗方式在胃癌中的应用,联合用于顺铂耐药的胃癌患者中的研究较少。所以本研究拟将顺铂耐药的胃癌患者作为干预对象,比较改良DOF双周方案和改良DOF双周方案联合曲妥珠单抗的实际疗效,旨在探讨联合治疗方案对肿瘤标志物和生存率的影响,以期为顺铂耐药的胃癌患者的临床治疗方案选择提供参考。
1 资料和方
1.1 一般资料
选取2017年1月—2019年1月哈励逊国际和平医院收治的80例顺铂耐药胃癌患者作为研究对象。纳入标准:① 符合《胃肠间质瘤多学科综合治疗协作组诊疗模式专家共识》[7]中胃癌诊疗标准,有腹痛、消化不良等症状,胃镜、计算机体层成像(computed tomography,CT)及X线等影像学检查提示胃癌;② 年龄≥18岁;③ 一般资料齐全;④ 有顺铂耐药性,顺铂敏感性实验呈阳性,代谢指数检测中,被测量的拮抗剂的半抑制浓度(half maximal inhibitory concentration,IC50)≥100 μmol;⑤ TNM分期为Ⅲ/Ⅳ期,且均无手术指征,HER2阳性。排除标准:① 疾病危重,预计生存期<3个月;② 对本研究用药有严重过敏反应;③ 入组前即存在感染性或传染性疾病;④ 合并其他恶性肿瘤;⑤ 免疫力低下,有至少1个月放疗史或激素替代治疗史;⑥ 有肝肾功能障碍性疾病;⑦ 合并心脑血管疾病。剔除脱落标准:① 有精神疾病,配合度过低;② 已参与其他试验;③ 治疗不耐受需要停止治疗、试验,或中途退出本研究者。两组样本量符合公式:N=(Z2α×pq)÷d2,α=0.05、Zα=1.96、d=2%,根据肿瘤细胞化疗耐药发生率30%~80%[8],p=0.80、q=0.20,计算N≈1 537,考虑哈励逊国际和平医院实际收治人数及失访病例(1%~6%),1 537×0.06≈92例,剔除脱落12例,最终实际纳入病例数为80例。按随机数字表法均分为观察组和对照组,均接受改良DOF双周方案治疗,观察组在此基础上加上曲妥珠单抗辅助治疗。观察组:男女比例为22∶18,年龄38~74岁,平均(6.01±7.28)岁,TNM分期Ⅲ期∶Ⅳ期=21∶19,分化程度中高分化∶低分化=20∶20;对照组:男女比例为23∶17,年龄35~75岁,平均(55.05±7.01)岁,TNM分期Ⅲ期∶Ⅳ期=26∶14,分化程度中高分化∶低分化=25∶15。上述一般资料差异无统计学意义(P>0.05)。本研究纳入的研究对象均自愿签署知情同意书,本研究经哈励逊国际和平医院伦理委员会审查批准(编号:20160511)。
1.2 方法
对照组:实施改良DOF双周方案。第1天,静脉滴注50 mg/m2多西他赛(法国Rhone-Poulenc Rorer公司),加250 mL 5%葡萄糖注射液稀释配制;第2、3天,静脉滴注85 mg/m2奥沙利铂(比利时CENEXI-Laboratoires THISSEN公司),加500 mL 5%葡萄糖注射液稀释配制;第2、3天,静脉滴注0.2 g/m2亚叶酸钙(河南辅仁怀庆堂制药有限公司),滴注时间在2 h左右;第2、3天,静脉推注400 mg/m2 5-氟尿嘧啶(海南卓泰制药有限公司),于亚叶酸钙静脉滴注完后用药,并进行600 mg/m2微泵持续滴注(22 h)。14 d为1个周期。
观察组:实施曲妥珠单抗辅助改良DOF双周方案。本组改良DOF双周方案与对照组完全一致,只是在此基础上加上曲妥珠单抗辅助治疗。静脉注射8 mg/kg曲妥珠单抗(美国Genentech公司),每隔3周用药1次,后期用药剂量调整为6 mg/kg。21 d为1个疗程。
两组均接受为期2个月的治疗,在治疗2个月后进行疗效评价,并进行6个月的跟踪随访,视患者疾病情况动态调整治疗方案至进展期。
1.3 观察指标
下述血清指标检测时间为治疗前和治疗后(开始治疗后第3个月的第1周)。
血清肿瘤标志物:采集制备研究对象的清晨空腹静脉血血清(以3 500 r/min的离心速率离心15 min,离心半径为15 cm),用购自山东博科生物产业有限公司的全自动化学发光免疫检测仪(型号为BKI2200)进行血清癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)及CA72-4表达水平的检测。正常参考范围:CEA为0~5 ng/mL,CA19-9为0~40 U/mL,CA72-4为0~6 U/mL。
血清新生血管标志物:采集制备研究对象的清晨空腹静脉血血清(以3 500 r/min的离心速率离心10 min,离心半径为15 cm),用购自上海酶联生物科技有限公司的酶联免疫试剂盒进行血管内皮生长因子(vascular endothelial growth factor,VEGF)、色素上皮衍生因子(pigment epithelial derived factor,PEDF)及血管生成素-2 (angiopoietin-2,Ang-2)表达水平的检测。
生化指标:采集制备研究对象的清晨空腹静脉血血清,用酶联免疫试剂盒进行N端脑钠肽前体(N terminal pro B type natriuretic peptide,NT-proBNP)表达水平的检测;用购自上海寰熙医疗器械有限公司的全自动生化分析仪(型号为ichem-4800)进行天冬氨酸转氨酶(aspartate transaminase,AST)、血尿素氮(blood urea nitrogen,BUN)及丙氨酸转氨酶(alanine aminotransferase,ALT)表达水平的检测。
不良反应的发生情况:观察记录开始治疗后出现乏力、胃肠道反应及骨髓抑制等症状的患者数。
1~5年生存率:对研究对象进行为期5年的跟踪随访,调查记录两组患者的1~5年生存率。
1.4 统计学处理
采用SPSS 25.0软件对数据进行统计分析。计量数据均符合正态分布,以x±s表示,采用独立样本t检验进行组间比较,采用配对样本t检验进行组内比较;计数数据以n(%)表示,进行χ2检验;采用Kaplan-Meier法进行生存分析,组间比较采用log-rank检验。P<0.05为差异有统计学意义。采用GraphPad Prism 8绘制柱状图。
2 结 果
2.1 比较两组的血清肿瘤标志物
治疗前,两组的CEA、CA19-9及CA72-4差异无统计学意义(P>0.05)。治疗后,两组的CEA、CA19-9及CA72-4较治疗前下降,且观察组的CEA、CA19-9及CA72-4均低于对照组,差异有统计学意义(P <0.01)。观察组和对照组的CEA均恢复到正常参考范围内(图1)。
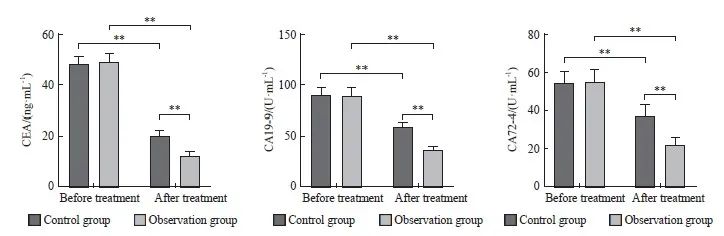
图1 两组血清肿瘤标志物的比较
Fig. 1 Comparison of serum tumor markers between the two groups
**: P<0.01.
2.2 比较两组的血清新生血管标志物
治疗后,两组的VEGF、PEDF及Ang-2较治疗前下降,差异有统计学意义(P<0.01)。两组治疗前后的VEGF、PEDF及Ang-2差异均无统计学意义(P>0.05,图2)。
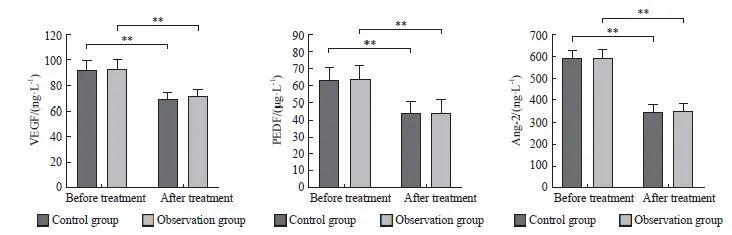
图2 两组血清新生血管标志物的比较
Fig. 2 Comparison of serum neovascularization markers between the two groups
**: P<0.01.
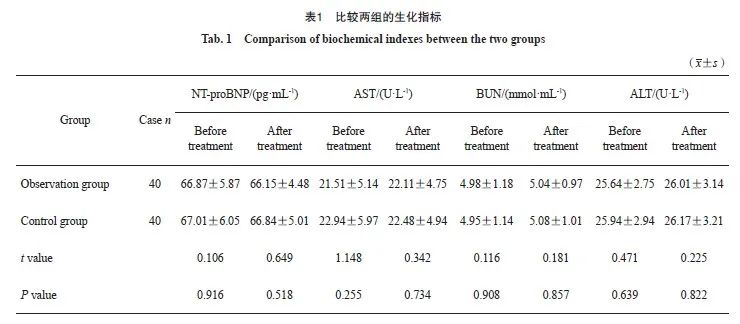
2.3 比较两组的生化指标
两组治疗前后的NT-proBNP、AST、BUN及ALT差异均无统计学意义(P>0.05,表1)。
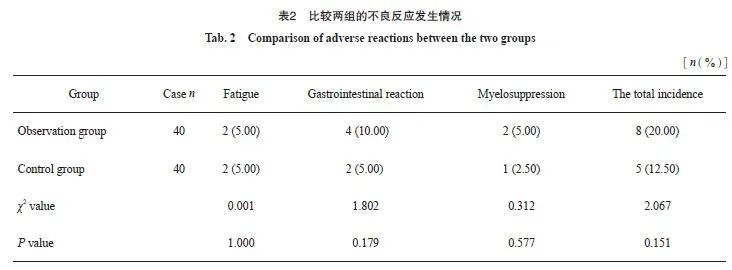
2.4 比较两组的不良反应发生情况
两组的乏力、胃肠道反应、骨髓抑制发生人数占比及不良反应总发生率差异均无统计学意义(P>0.05)。及时给予对症处理,症状显著消退,未对临床诊疗结局造成显著影响(表2)。
2.5 比较两组的1~5年生存率
治疗后5年,观察组存活11例(27.5%),死亡29例(72.5%);对照组存活3例(7.5%),死亡37例(92.5%),观察组的中位生存期为2年(95% CI:1.8~2.2),对照组的中位生存期为1年(95% CI:0.6~1.4),观察组1~5年存活率高于对照组,差异有统计学意义(log-rank χ2=13.853,P=0.001,表3,图3)。


图3 两组1~5年生存率的比较
Fig. 3 Comparison of 1-5 years survival rates between two groups
3 讨 论
顺铂作为化疗常用药物,可获得较显著的化疗效果,对抑制肿瘤生长有重要作用[8-9]。然而受患者自身身体素质及长期化疗等因素影响,部分患者可能会发生顺铂耐药,导致顺铂化疗效果降低,影响患者的生存期[10]。
改良DOF双周方案是近年来较新型的一种化疗方式,通过联用多西他赛、奥沙利铂、亚叶酸钙和5-氟尿嘧啶可在较短时间内达到较显著的肿瘤抑制效果,药物在促进癌细胞凋亡的同时,进一步抑制癌细胞增殖和转移[11]。曲妥珠单抗是一种靶向治疗药物,可通过调节HER2表达水平及作用,达到促进癌细胞凋亡的治疗目的,是治疗晚期胃癌的重要手段[12]。所以为进一步提升顺铂耐药胃癌患者的临床疗效,本研究将曲妥珠单抗辅助改良DOF双周方案用于顺铂耐药胃癌患者的临床诊疗中,结果显示,治疗后,两组的CEA、CA19-9、CA72-4、VEGF、PEDF及Ang-2较治疗前下降(P<0.05),观察组治疗后的CEA、CA19-9及CA72-4均低于对照组(P<0.05);两组治疗前后的VEGF、PEDF及Ang-2差异无统计学意义(P>0.05),提示采用此联合治疗方式能提升肿瘤抑制效果,且加入曲妥珠单抗辅助治疗后不会对新生血管抑制效果造成过多影响。曲妥珠单抗是抗HER2的单克隆抗体,主要是通过阻止人表皮生长因子与HER2的结合,阻断癌细胞的生长[13]。HER2作为原癌基因,主要发挥促进肿瘤生长的作用,与正常皮肤、表皮细胞的生长演化也密切相关。曲妥珠单抗可靶向作用于HER2,通过抑制转运蛋白对细胞内外物质的转运作用,加速癌细胞凋亡,从而抑制癌细胞增殖。朱麒等[14]研究显示,在常规SOX化疗基础上采取曲妥珠单抗治疗,治疗组胃癌患者的CEA、CA19-9及CA72-4更低,与本研究结论一致。李红等[15]将曲妥珠单抗用于HER2阳性晚期胃癌中,结果显示,辅助组治疗后的CEA、CA19-9及CA72-4低于常规组,说明给予曲妥珠单抗治疗能帮助胃癌患者达到更显著的血清肿瘤标志物改善效果,与本研究结论一致。本研究在改良DOF双周方案基础上给予曲妥珠单抗治疗后,观察组患者的血清肿瘤标志物表达水平改善更显著,癌细胞转移得到一定控制。不良反应方面,本研究结果显示,两组治疗前后的NT-proBNP、AST、BUN及ALT检测值差异无统计学意义(P>0.05),乏力、胃肠道反应、骨髓抑制发生人数占比及不良反应总发生率差异也无统计学意义(P>0.05),提示在改良DOF双周方案基础上加上曲妥珠单抗辅助治疗不会引起过多不良反应。除此之外,使用曲妥珠单抗后部分患者还可能出现发热、寒战、呼吸困难、心脏毒性及皮肤反应等不良反应,需及时给予物理降温、保温、吸氧或停止用药等干预措施,以减少药物不良反应对患者机体的损害。本研究结果显示,观察组的1~5年存活率高于对照组(P<0.05),提示此联合治疗方案对提升顺铂耐受胃癌患者的生存率有积极影响。选择在改良DOF双周方案治疗基础上加上曲妥珠单抗进行靶向治疗的原因,一是曲妥珠单抗仅作用于HER2,利于降低药物不良反应,用药安全有一定保障,对促进疾病康复、提高临床疗效均有积极影响;二是曲妥珠单抗通过切断肿瘤生长和增殖条件,进一步提高抗癌效果,对延长患者的生存期有一定价值。
综上所述,将曲妥珠单抗辅助改良DOF双周方案应用于顺铂耐药胃癌中能进一步降低患者的血清肿瘤标志物表达水平,对改善新生血管抑制效果、提高生存率等有一定意义,且用药安全性较高。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
李晶:实验设计,实验操作,数据分析,文章撰写;
郑磊:文章修改;
高钰:实验操作,数据分析。
[参考文献]
[1]ZHANG C, LI D N, YU R X, et al. Immune landscape of gastric carcinoma tumor microenvironment identifies a peritoneal relapse relevant immune signature[J]. Front Immunol, 2021, 12: 651033.
[2]KANG Y K, CHIN K, CHUNG H C, et al. S-1 plus leucovorin and oxaliplatin versus S-1 plus cisplatin as first-line therapy in patients with advanced gastric cancer (SOLAR): a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2020, 21(8): 1045-1056.
[3]皇甫娟, 张 强, 魏祯瑶, 等. 基于p53介导自噬通路探讨臭椿酮对顺铂耐药胃癌细胞株耐药性的影响[J]. 现代药物与临床, 2021, 36(6): 1112-1118.
HUANGFU J, ZHANG Q, WEI Z Y, et al. Effect of ailanthone on cisplatin-resistant gastric cancer cell line based on p53-mediated autophagy pathway[J]. Drugs Clin, 2021, 36(6): 1112-1118.
[4]陈延群, 莫海云. DOF方案与XELOX方案一线治疗进展期胃癌疗效对比[J]. 中华肿瘤防治杂志, 2021, 28(10): 782-787.
CHEN Y Q, MO H Y. Comparison of DOF regimen and XELOX regimen as first-line treatment in advanced gastric cancer patients[J]. Chin J Cancer Prev Treat, 2021, 28(10): 782-787.
[5]SHITARA K, BANG Y J, IWASA S, et al. Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer[J]. N Engl J Med, 2020, 382(25): 2419-2430.
[6]JANJIGIAN Y Y, MARON S B, CHATILA W K, et al. First-line pembrolizumab and trastuzumab in HER2-positive oesophageal, gastric, or gastro-oesophageal junction cancer: an open-label, single-arm, phase 2 trial[J]. Lancet Oncol, 2020, 21(6): 821-831.
[7]中国研究型医院学会消化道肿瘤专业委员会, 中国医师协会外科医师分会多学科综合治疗专业委员会. 胃肠间质瘤多学科综合治疗协作组诊疗模式专家共识[J]. 中国实用外科杂志, 2017, 37(1): 39-41.
Digestive Tumor Professional Committee of China Research Hospital Association, Multidisciplinary Comprehensive Therapy Professional Committee of the Surgical Branch of the Chinese Medical Association. Expert consensus on diagnosis and treatment mode of gastric cancer multidisciplinary comprehensive treatment collaboration group[J]. Chin J Pract Surg, 2017, 37(1): 39-41.
[8]曹毛毛, 李 贺, 孙殿钦, 等. 2000—2019年中国胃癌流行病学趋势分析[J]. 中华消化外科杂志, 2021, 20(1): 102-109.
CAO M M, LI H, SUN D Q, et al. Epidemiological trend analysis of gastric cancer in China from 2000 to 2019[J]. Chin J Dig Surg, 2021, 20(1): 102-109.
[9]LIOU J M, MALFERTHEINER P, LEE Y C, et al. Screening and eradication of Helicobacter pylori for gastric cancer prevention: the Taipei global consensus[J]. Gut, 2020, 69(12): 2093-2112.
[10]张维汉, 杨 昆, 陈心足, 等. 规范化外科手术与多学科综合治疗对胃癌患者预后的影响:一项单中心队列研究报告[J]. 中华胃肠外科杂志, 2020, 23(4): 396-404.
ZHANG W H, YANG K, CHEN X Z, et al. Effect of standardized surgical treatment and multidisciplinary treatment strategy on the prognosis of gastric cancer patients: report of a single-center cohort study.[J].Chin J Gast S,2020,23(4):396-404.
[11]艾克热木·玉苏甫, 阿布都沙拉木·依米提, 再依奴尔·阿不都外力, 等. 不同新辅助化疗方案治疗进展期胃癌的疗效和安全性及费用评估研究[J]. 中国全科医学, 2020, 23(26): 3286-3290.
AIKEREMU·YUSUFU, ABUDUSHALAMU·YIMITI, ZAIYINUER·ABUDUWAILI, et al. Evaluation of safety, efficacy and hospitalization cost of three neoadjuvant chemotherapy regimens for advanced gastric cancer[J]. Chin Gen Pract, 2020, 23(26): 3286-3290.
[12]MAKIYAMA A, SUKAWA Y, KASHIWADA T, et al. Randomized, phase Ⅱ study of trastuzumab beyond progression in patients with HER2-positive advanced gastric or gastroesophageal junction cancer: WJOG7112G (T-ACT study)[J]. J Clin Oncol, 2020, 38(17): 1919-1927.
[13]HACKSHAW M D, BUI C L, LADNER A, et al. Review of survival, safety, and clinical outcomes in HER2+ metastatic gastric cancer following the administration of trastuzumab[J]. Cancer Treat Res Commun, 2020, 24: 100189.
[14]朱 麒, 肖 瑶, 金丽艳, 等. 曲妥珠单抗联合化疗对HER-2阳性胃癌患者T淋巴细胞亚群及肿瘤标志物的影响[J]. 临床肿瘤学杂志, 2023, 28(2): 159-163.
ZHU Q, XIAO Y, JIN L Y, et al. Effects of Trastuzumab combined with chemotherapy on T lymphocyte subsets and tumor markers in patients with HER-2 positive gastric cancer[J]. Chin Clin Oncol, 2023, 28(2): 159-163.
[15]李 红, 史长山. 曲妥珠单抗辅助治疗HER2阳性晚期胃癌的安全性及对患者血清肿瘤标志物的影响研究[J]. 长春中医药大学学报, 2022, 38(1): 88-92.
LI H, SHI C S. Safety of the trastuzumab adjuvant treatment of HER2-positive advanced gastric cancer and its effect on patients' serum tumor markers[J]. J Changchun Univ Chin Med, 2022, 38(1): 88-92.