慢性腰痛是一类严重影响患者生活质量的常见病症,可导致患者运动功能障碍,甚至生活自理能力丧失。其中,由腰椎小关节紊乱导致的轴性腰痛(简称“腰椎小关节疼痛”)最为常见,发病率约为10%~15%[1-2]。
腰椎小关节疼痛定义为:单侧或双侧背部疼痛,放射至一侧或双侧臀部、腹股沟两侧和大腿,并停留于膝关节以上。然而,在某些情况下,患者的腰痛症状可能缺乏特异性[3]。介入治疗是腰椎小关节疼痛最为有效且安全的治疗方法[1,4-5],对于其临床安全性和技术细节,目前尚缺乏明确的指导方针。
为此,中美疼痛医学领域多位专家基于最新循证医学证据,共同制定了本共识,以期提高腰椎小关节疼痛介入治疗的安全性和规范化,为我国各级医疗机构疼痛专业开展慢性疼痛治疗工作提供借鉴,同时为其他非疼痛专业医生或初级保健医生在初诊和转诊类似患者时提供参考。
1 共识制订方法
2023年 11月1日,由美国克利夫兰医学中心疼痛科许继军教授牵头,组织中美疼痛医学领域多位专家成立了共识工作组。工作组6位海外成员来自美国不同地区大学或私立医院/诊所,12位国内成员来自我国不同地区大学附属医院。以“lumbar facetogenic pain”“lumbar spondylosis” “lumbar facet intervention”“facet injection”“medial branch block (MBB)”“facet radiofrequency ablation(RFA)”“facet denervation”为关键词,检索PubMed、Medline、Embase、Ovid和Cochrane图书馆数据库,检索时间为建库至2023年12月1日,共检索到系统评价和其他高质量临床试验及队列研究20余篇,同时参考了相关指南4篇[4,6-7]。
2023年12月31日完成共识初稿撰写,随后对共识进行讨论并凝练推荐意见,根据患者净获益情况,将证据等级分为高、中、低3个等级(表1),同时根据美国预防服务工作组推荐意见等级定义和实践建议[8] (表2)给出推荐意见。随后采用德尔菲法,经过3轮专家讨论和沟通,最终形成了基于6个临床问题的专家共识(表3)。
表1 净获益证据等级定义%)
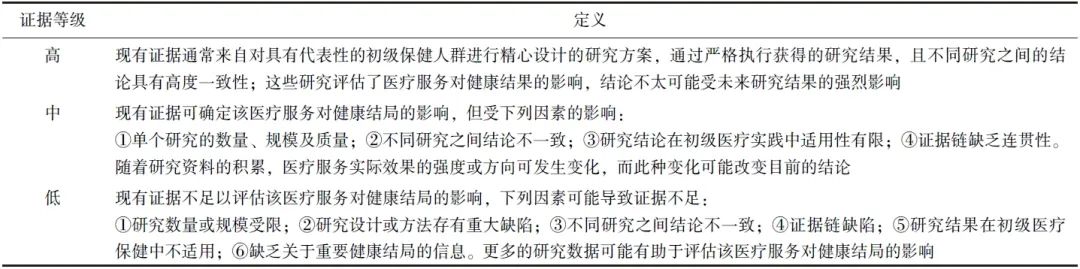
表2 推荐强度定义和实践建议
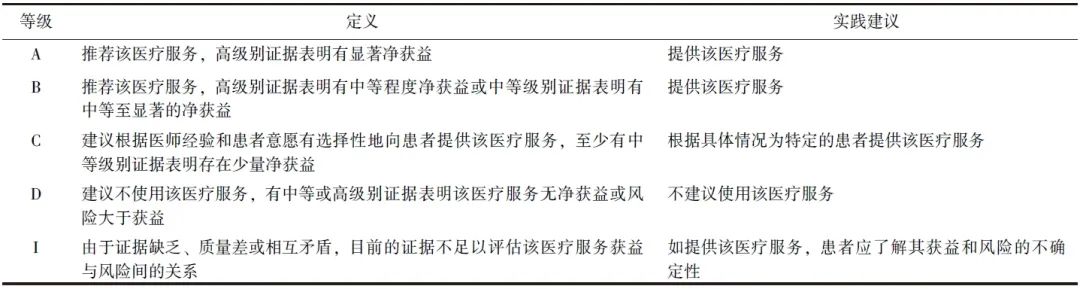
表3 《腰椎小关节疼痛介入治疗中美专家共识 (2024)》拟解决的临床问题及推荐意见



2 腰椎小关节疼痛的诊断
腰椎小关节疼痛的诊断依赖于病史、症状、体格检查和诊断性阻滞的联合证据。尚无特异性的体格检查或病史指征能够可靠地预测个体对腰椎小关节阻滞的反应[9-11]。腰椎小关节体表投影区的压痛,似乎与腰椎小关节介入治疗效果存在弱正相关关系。研究显示,与神经根性症状相关的表现(如咳嗽时疼痛加重、疼痛辐射至膝关节以下)可能与诊断性腰椎小关节阻滞失败相关[4]。
此外,合并其他疾病(如严重的精神疾病)与治疗失败具有明确相关性[12]。当选择阻滞靶点时,应基于临床表现(影像学表现、压痛部位、牵涉痛的类型等)明确选择具体的腰椎小关节(净获益证据等级:低;推荐强度:C)。
腰椎小关节注射或脊神经后内侧支阻滞(MBB)的治疗效果阳性被视为腰椎小关节疼痛的诊断金标准[2]。研究表明,在进行MBB前使用单光子发射计算机断层成像(SPECT)技术可识别引起疼痛的腰椎小关节炎症。
另有研究表明,在进行腰椎小关节注射前使用SPECT可能能够识别可引起疼痛的腰椎小关节病变[13]。关于SPECT的成本效益,仍需进一步研究。目前尚无证据支持核素扫描、MRI和CT等影像学技术用于识别病变位置具有参考价值。
3 介入治疗前的保守治疗
建议在行腰椎小关节介入前尝试3个月的保守治疗。保守治疗[14]可能包括药物(如非甾体抗炎药、抗抑郁药)、物理治疗(锻炼、热疗/冷疗、按摩)、中医针灸、激痛点疗法、整脊及营养、减重、睡眠健康等其他方法(净获益证据等级:低;推荐强度:C)。
4 腰椎小关节诊断性注射或阻滞
诊断性注射或阻滞是将局部麻醉药物注射至腰椎小关节内或支配腰椎小关节的MBB,从解剖上阻断疼痛的发生或传导。腰椎小关节注射符合疼痛介入性干预诊断标准,但对后续后内侧支射频消融的预测效果不如MBB[15],且技术上失败率较高。在进行腰椎小关节射频消融前,MBB是首选的诊断性阻滞手段[16](净获益证据等级:低;推荐强度:B)。
腰椎小关节注射皮质类固醇可能对某些人群具有治疗价值,例如炎性腰椎小关节疼痛或神经阻滞相对禁忌的个体。后内侧支射频消融可能导致多裂肌和其他脊柱肌肉萎缩[17],从而影响患者的运动能力,此外,部分患者(如装有心脏起搏器或带有自动植入式心律转复除颤器的患者)可能存在射频治疗禁忌证和并发症[18]。此类患者可能从腰椎小关节注射中获益(净获益证据等级:中;推荐强度:C)。
4.1 操作前影像引导
影像引导已成为脊柱操作的重要组成部分。使用影像学技术可确保治疗针尖位置准确,降低注射剂量,减少麻醉药物扩散范围,降低阻滞结果假阳性率。影像引导可直接显示骨质结构并引导精准操作,从而避免损伤神经附近组织(包括胸膜和血管),提高安全性[19]。
一般建议在腰椎MBB时使用CT或C臂机。如担心辐射暴露可能对患者(如孕妇)产生潜在危害或缺乏放射影像设备时,可选择使用超声引导[20](净获益证据等级:中;推荐强度:B)。
对于腰椎小关节注射,建议使用CT扫描以提高准确性。在无小关节狭窄的情况下,也可考虑使用C臂机(成本及辐射暴露率均较低)(净获益证据等级:低;推荐强度:C)[1-3]。
对于脊神经后内侧支射频消融,建议使用C臂机(净获益证据等级:低;推荐强度:B)[1-3]。
4.2 操作前镇静剂的使用
在进行诊断性腰椎小关节阻滞前是否使用镇静剂尚存争议。争议的焦点是使用镇静剂和/或镇痛药物是否会改变患者对阻滞的真实反应[21-22]。大多数专业学会建议仅在需要长时间保持不动(如肥胖患者进行双侧阻滞时,因为解剖异常在俯卧位时常有继发性疼痛而导致俯卧位困难)和患者严重焦虑的情况下,才使用镇静剂,若无合理指征,不应在诊断性阻滞前常规使用镇静剂。如使用镇静剂,应告知患者假阳性风险增加,且应尽量使用最低剂量不含阿片类药物的短效镇静剂[4](净获益证据等级:低至中;推荐强度:B)。
4.3 注射药物
4.3.1 药物容积选择
最影响注射扩散程度和阻滞特异性的因素是药物容积。对于腰部MBB,研究发现,0.25 mL和0.5 mL的造影剂均可浸润至目标神经根的后内侧支,但更小的容积向相邻结构(特别是更表浅肌肉和腰神经后背侧分支的远段)扩散范围明显更小[23]。因此,腰椎小关节MBB建议使用药物的总容积≤0.5 mL。
对于腰椎小关节注射,研究发现,当注射至关节的药物容积超过1.5 mL时,会导致关节囊破裂并使药物渗漏至硬膜外间隙[24],因此,腰椎小关节注射药物容积应<1.5 mL,以确保治疗的安全性(净获益证据等级:低;推荐强度:C)。
4.3.2 皮质类固醇的使用
使用皮质类固醇的理论基础是基于其对局部关节炎症的抑制。反复使用皮质类固醇注射可能伴随系统性并发症等副作用(如免疫抑制、糖尿病风险增加和骨质疏松)。尽管多项研究未发现皮质类固醇的益处[25-26],但其对于患有腰椎小关节急性炎性疼痛的患者可能有益[27]。
对于腰椎小关节反复介入后风险增加的患者(如年轻运动员、正在使用抗凝药物或有植入心脏设备的老年人),或阻滞成功率很高的患者(即既往在诊断性注射中获得长期缓解者),可考虑在阻滞中添加类固醇,以期获得长期症状缓解[4](净获益证据等级:中;推荐强度:D)。
4.4 预测后续射频消融的阻滞疗效截断值
大多数研究将≥50%的疼痛缓解作为预测后续射频消融的阻滞疗效标准,同时部分研究比较了不同的阻滞疗效截断值,范围从50%~80%不等。研究指出,虽然有研究表明疼痛缓解≥80%的患者更有可能对后续射频消融产生积极反应,但在缓解阈值达到50%而<70%或<80%的患者中,仍有相当比例的患者可从射频消融中受益。在无更可靠的治疗选择的情况下,建议使用≥50%的疼痛缓解作为预测后续射频消融的截断值[4](净获益证据等级:中;推荐强度:B)。
4.5 进行射频消融前的预测性阻滞次数
在进行射频消融前需要多少次预测性阻滞仍是备受争议的问题。关节内注射和神经阻滞的假阳性率约为17%~41%,此数值在伴有心理问题的患者中可能更高。假阴性阻滞的原因很多,包括未能命中目标神经(非常少见,因为0.5 mL局麻药至少可扩散至6 cm2)、静脉吸收(发生率为4%~19%,采用数字减影可有效降低其发生率)、阻滞无法达到小关节腔内(发生率为29%~38%)、后内侧支神经支配异常(发生率约为11%)、存在操作相关的疼痛(包括肌肉疼痛和痉挛,未能充分评估疼痛缓解)、其他脊柱共病以及突然停止使用阿片类药物等。虽然不同时间的2次预测性阻滞可提高射频消融的成功率,但单次阻滞可在降低医疗费用的同时保持对后续射频消融的成功预测率[4],因此单次或2次预测性阻滞均是合理的选择(净获益证据等级:低至中;推荐强度:C)。
5 腰椎小关节射频消融治疗
由于目前射频治疗腰椎小关节疼痛的临床证据主要来自应用单极标准射频 (≥80 ℃),因此本共识主要阐述此种射频方式在腰椎小关节疼痛治疗中的应用。
5.1 射频消融毁损范围
腰椎小关节介入治疗的靶神经脊神经后内侧支直径小于2 mm,这在技术上给增加毁损体积以提高靶神经毁损几率,同时减少非靶组织的损伤带来了挑战。消融毁损体积取决于热量产生和散失以及局部组织相互作用。与射频针尖的距离、射频电流场强度以及持续时间3个主要因素决定了热量产生和射频毁损范围(表4)。
表4 影响射频毁损范围的因素[4]
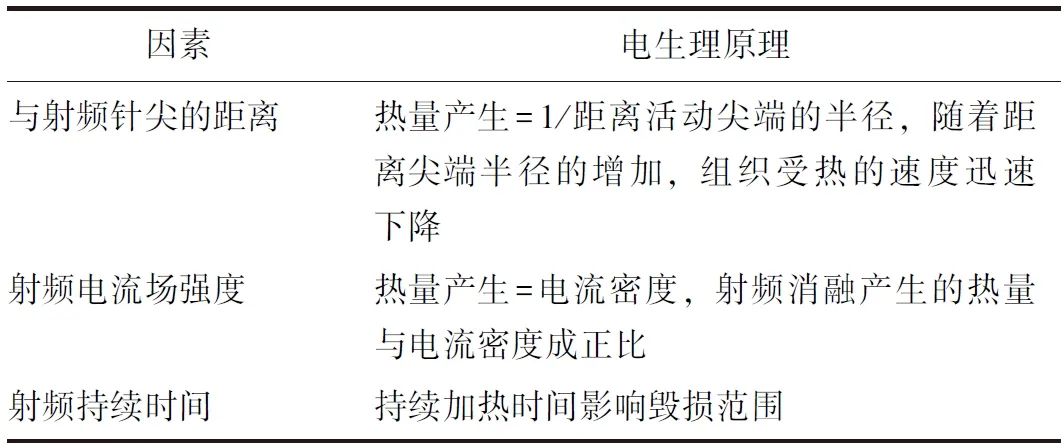
基于标准热射频的局限性和靶神经的小尺寸,创建较大的毁损范围并减少毁损变异可能会增加命中靶神经的可能性。如果使用较大的毁损范围,应注意限制对非目标结构的损害[4](净获益证据等级:低;推荐强度:C)。
5.2 射频针与靶神经的相对位置
L1~L4脊神经后内侧支起始于其下方的上关节突和横突根部交界处,穿过乳突辅助副韧带下方,然后向椎板走行。在椎板上,神经分为多个分支,分别支配下方的小关节、棘间韧带和肌肉。部分人群的后内侧支可能被卡在钙化的韧带下,这种情况最常见于L5。因此可对L5后侧支进行射频消融,其位于S1上关节突和骶骨翼之间的凹槽内。
射频毁损的范围理论上是沿着射频针尖端周围扩展的,毁损范围和射频针与靶神经的相对位置有关。射频电极与靶神经垂直产生的靶神经毁损范围(图1,黄色线条与灰色椭圆形阴影的交界)最小,平行置针扩大了毁损范围。当射频针与靶神经近乎平行时,毁损范围增加更为明显,消融靶神经可能性最高。根据解剖和现有文献,建议射频电极与后内侧支近乎平行放置,以增加射频消融的可靠性和容错率[4](净获益证据等级:低;推荐强度:B)。
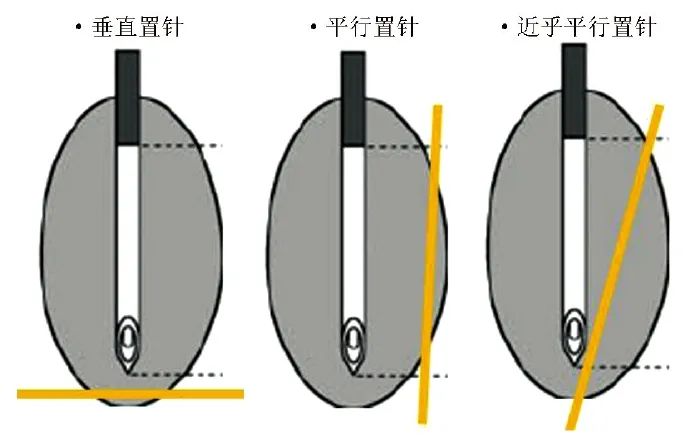
图1 射频电极相对于靶神经(黄色线)的位置
注:灰色椭圆形阴影代表射频毁损范围
5.3 射频消融前的感觉神经和运动神经测试
腰椎小关节后内侧支射频消融应避免消融腹侧分支或其他非目标结构。由于腰椎小关节后内侧神经分支的位置存在解剖变异,且每个神经分支又有多个关节分支,故应在放置好射频针后,先进行感觉神经和/或运动神经测试以确保射频针定位准确。感觉神经测试通常以50 Hz电刺激以确认电极与目标神经接触紧密。患者被要求在识别到感觉变化(例如刺痛、电击感、震动、疼痛)时告知治疗医生。传统认为,可接受的电压阈值为<0.5 V。
值得注意的是,不理想的射频针放置(垂直而非平行,图1)也可能导致感觉刺激足够但毁损范围不足以消融神经和缓解疼痛。运动神经测试通常以2 Hz的频率进行,其潜在用途包括:
1
识别多裂肌或其他腰椎旁肌肉刺激,表明针尖位置正确从而提高消融准确性;
2
通过排除远端(主要是下肢)肌肉收缩以识别针头与腹侧分支或脊神经可能接触从而提高安全性。
通常将电压增加至1.5~2 V(或者为感觉神经测试电压阈值的3倍)。运动神经刺激阈值可能在预防并发症方面发挥一定作用。Abbott等[28]报告了一例患者在进行L3~L5腰椎小关节后内侧支射频消融时,因未行1 V以上电压运动测试,引发了患者L5根性神经痛。
总之,在进行射频消融前强烈建议进行运动神经和感觉神经测试[4](净获益证据等级:低;推荐强度:C),运动神经测试可能对保证治疗的安全性和有效性有益(净获益证据等级:低;推荐强度:B)。
5.4 重复射频消融
在腰椎小关节后内侧支射频消融治疗后,患者疼痛缓解具有时间限度,因此可能需要进行重复射频消融。在初始射频消融治疗后的3个月或更长时间内,疼痛缓解50%以上的患者证据表明,重复神经射频可能增加成功率[29-31](净获益证据等级:中;推荐强度:B)。
值得注意的是,重复射频消融前不必强制重新进行诊断性阻滞。但如果患者对复发疼痛的描述发生变化,或者不确定当前疼痛是否与既往疼痛来源相同或相似时,可考虑在重复射频消融前重新进行诊断性阻滞[4]。
6 腰椎小关节介入治疗常见并发症
6.1 误穿或血管损伤
在美国区域麻醉和疼痛医学学会牵头制定的《使用抗凝药物和抗血小板药物的患者脊柱手术指南》中,腰椎小关节MBB和射频消融被分类为“低风险手术”[32]。多个学会建议在进行MBB预测性阻滞时应通过负压抽吸和术中实时透视观察造影剂扩散以排除针尖误入血管的情况。
此外,调查研究发现,在介入性脊柱手术后,血栓栓塞比出血类并发症发生率高3倍。在继续使用抗凝药物的患者中未观察到出血类并发症,但在停用抗凝药的2296例患者中共发生9例严重事件,其中2例死亡[33]。
因此,对于存在高血栓栓塞并发症风险的患者,建议在MBB或射频消融术前继续使用非肝素类抗凝药[4],且进行介入手术前,医患应共同评估手术出血和血栓的发生风险(净获益证据等级:中;推荐强度:B)。
6.2 组织灼伤
研究显示,射频消融毁损延伸至真皮层或设备故障(如电极故障、电极绝缘破损、接地电极片使用不正确)易导致皮肤烧伤。建议操作前检查所有设备,以确保其能够正常运行;将单极射频接地电极放置于干燥、干净、无瘢痕或纹身的下肢上,或使用较大的接地电极片可最大限度降低组织灼伤风险[34](净获益证据等级:中至高;推荐强度:B)。
6.3 射频消融相关疼痛和不适
由于射频消融治疗后,靶神经及周围组织热凝损毁,且治疗后数天至数周活动受限,部分患者可能出现腰部疼痛、麻木,或后内侧支感觉减退/异常。医生应告知患者关于射频消融治疗后此类常见不良反应。在射频消融后通过射频导管注射类固醇(如甲基强的松龙乙酸盐10 mg)或可减轻射频消融后的疼痛与不适[35](净获益证据等级:低;推荐强度:C)。
6.4 脊髓或脊神经根损伤
腰椎小关节射频消融可能会发生脊髓(上腰部)或脊神经根损伤,但这种情况较少见[36]。射频消融前使用多平面(前后位、同侧斜位“Scotty-dog”和侧位)影像能够防止射频消融针尖端在脊神经根孔之外。此外,行运动神经测试能够减少对脊髓和脊神经根损伤的可能性(净获益证据等级:低;推荐强度:B)。
6.5 射频消融相关脊柱肌肉退化
多裂肌对于腰椎的节段稳定性起到重要作用。腰椎小关节射频消融会导致多裂肌去神经化。尽管既往研究未发现射频消融影响脊柱稳定性[37],但应告知患者腰椎小关节神经射频对脊柱肌肉的短期和长期潜在影响。在进行射频消融前后,建议结合物理疗法治疗,目的在于恢复腰部肌肉的功能,从而改善治疗效果(净获益证据等级:低;推荐强度:C)。
7 腰椎小关节介入治疗时植入物的处理
7.1 植入电子设备
腰椎小关节神经支配的单极射频消融涉及从射频针尖端产生的电流流经身体然后通过接地电极片退出,产生的磁场可能会干扰植入电子设备的功能。应在射频消融前咨询负责管理植入设备的医疗团队,并与患者讨论设备损坏的风险。如果进行射频消融,植入的电子设备(如神经刺激器)应设置为0 V输出并在术前关闭;起搏器应设置为非同步模式;除颤器应在体表放置一块磁铁,以防止射频消融触发除颤;射频消融术后应重启神经刺激器至手术前设置(净获益证据等级:低;推荐强度:C)。
若患者在射频消融期间发生心律失常,应移除磁铁或使用外部除颤器/起搏电极[38]。研究表明,双极可能比单极射频消融更加安全[1-3]。尽量不使用镇静剂或合理使用镇静剂以能够与患者进行有效沟通,帮助尽早发现中枢神经系统任何潜在损伤或心血管失代偿。
7.2 射频消融对邻近脊柱植入物硬件的影响
应使用多平面影像引导的射频消融技术,以确保射频针与椎弓根内螺钉不接触,以避免对脊柱植入物周围组织造成热损伤[39](净获益证据等级:低;推荐强度:C)。
8 小结
腰椎小关节疼痛是临床常见症状,微创介入治疗技术已成为慢性疼痛的有效临床治疗手段,腰椎小关节注射或脊神经后内侧支阻滞的治疗效果阳性被视为其诊断金标准,本共识结合临床研究结果及中美两国相关领域专家学者的实践经验,以循证医学为依据,从腰椎小关节疼痛的诊断、介入治疗前的保守治疗、介入治疗技术要点、常见并发症以及对植入物的处理等6个临床问题提出专家推荐意见(表3),可为中美两国临床医生正确认识和合理采用介入技术治疗腰椎小关节疼痛和开展腰椎小关节相关临床试验提供参考和借鉴。未来随着技术的发展,将会有更多高质量的临床证据涌现,届时本共识也将进行更新和改进。
参考文献
[1]薛朝霞, 魏俊, 王祥瑞, 等. 脊神经后支相关性疼痛微创治疗技术中国疼痛科专家共识 (2021版)[J]. 中华疼痛学杂志, 2021, 17(3): 228-238.
[2]中国康复医学会脊柱脊髓专业委员会, 中华医学会骨科学分会骨科康复学组. 中国非特异性腰背痛临床诊疗指南[J]. 中国脊柱脊髓杂志, 2022, 32(3): 258-268.
[3]Perolat R, Kastler A, Nicot B, et al. Facet joint syndrome: from diagnosis to interventional management[J]. Insights Imaging, 2018, 9(5): 773-789.
[4]Cohen S P, Bhaskar A, Bhatia A, et al. Consensus practice guidelines on interventions for lumbar facet joint pain from a multispecialty, international working group[J]. Reg Anesth Pain Med, 2020, 45(6): 424-467.
[5]Eldabe S, Tariq A, Nath S, et al. Best practice in radiofrequency denervation of the lumbar facet joints: a consensus technique[J]. Br J Pain, 2020, 14(1): 47-56.
[6]Manchikanti L, Kaye A D, Soin A, et al. Comprehensive evidence-based guidelines for facet joint interventions in the management of chronic spinal pain: American Society of Interventional Pain Physicians (ASIPP) guidelines facet joint interventions 2020 guidelines[J]. Pain Physician, 2020, 23(3S): S1-S127.
[7]Lee D W, Pritzlaff S, Jung M J, et al. Latest evidence-based application for radiofrequency neurotomy (LEARN): best practice guidelines from the American Society of Pain and Neuroscience (ASPN)[J]. J Pain Res, 2021, 14: 2807-2831.
[8]U.S. Preventive Services Task Force. Grade definitions[Z/OL]. https://www.uspreventiveservicestaskforce.org/uspstf/about-uspstf/methods-and-processes/grade-definitions.
[9]Jackson R P, Jacobs R R, Montesano P X. 1988 Volvo award in clinical sciences. Facet joint injection in low-back pain. A prospective statistical study[J]. Spine (Phila Pa 1976), 1988, 13(9): 966-971.
[10]Cohen S P, Hurley R W, Christo P J, et al. Clinical predictors of success and failure for lumbar facet radiofrequency denervation[J]. Clin J Pain, 2007, 23(1): 45-52.
[11]Manchikanti L, Pampati V, Fellows B, et al. The inability of the clinical picture to characterize pain from facet joints[J]. Pain Physician, 2000, 3(2): 158-166.
[12]Lilius G, Laasonen E M, Myllynen P, et al. Lumbar facet joint syndrome. A randomised clinical trial[J]. J Bone Joint Surg Br, 1989, 71(4): 681-684.
[13]Dolan A L, Ryan P J, Arden N K, et al. The value of SPECT scans in identifying back pain likely to benefit from facet joint injection[J]. Br J Rheumatol, 1996, 35(12): 1269-1273.
[14]Miyamoto G C, Lin C W C, Cabral C M N, et al. Cost-effectiveness of exercise therapy in the treatment of non-specific neck pain and low back pain: a systematic review with meta-analysis[J]. Br J Sports Med, 2019, 53(3): 172-181.
[15]Cohen S P, Moon J Y, Brummett C M, et al. Medial branch blocks or intra-articular injections as a prognostic tool before lumbar facet radiofrequency denervation: a multicenter, case-control study[J]. Reg Anesth Pain Med, 2015, 40(4): 376-383.
[16]Van Zundert J, Vanelderen P, Kessels A, et al. Radiofre-quency treatment of facet-related pain: evidence and controversies[J]. Curr Pain Headache Rep, 2012, 16(1): 19-25.
[17]Dreyfuss P, Stout A, Aprill C, et al. The significance of multifidus atrophy after successful radiofrequency neurotomy for low back pain[J]. PM R, 2009, 1(8): 719-722.
[18]Barbieri M, Bellini M. Radiofrequency neurotomy for the treatment of chronic pain: interference with implantable medical devices[J]. Anaesthesiol Intensive Ther, 2014, 46(3): 162-165.
[19]Rathmell J P, Manion S C. The role of image guidance in improving the safety of pain treatment[J]. Curr Pain Headache Rep, 2012, 16(1): 9-18.
[20]Wu T, Zhao W H, Dong Y, et al. Effectiveness of ultrasound-guided versus fluoroscopy or computed tomography scanning guidance in lumbar facet joint injections in adults with facet joint syndrome: a meta-analysis of controlled trials[J]. Arch Phys Med Rehabil, 2016, 97(9): 1558-1563.
[21]Manchikanti L, Pampati V, Damron K S, et al. The effect of sedation on diagnostic validity of facet joint nerve blocks: an evaluation to assess similarities in population with involve-ment in cervical and lumbar regions (ISRCTNo: 76376497)[J]. Pain Physician, 2006, 9(1): 47-51.
[22]Cohen S P, Hameed H, Kurihara C, et al. The effect of sedation on the accuracy and treatment outcomes for diagnostic injections: a randomized, controlled, crossover study[J]. Pain Med, 2014, 15(4): 588-602.
[23]Wahezi S E, Alexeev E, Georgy J S, et al. Lumbar medial branch block volume-dependent dispersion patterns as a predictor for ablation success: a cadaveric study[J]. PM R, 2018, 10(6): 616-622.
[24]Moran R, O'Connell D, Walsh M G. The diagnostic value of facet joint injections[J]. Spine (Phila Pa 1976), 1988, 13(12): 1407-1410.
[25]Cohen S P, Doshi T L, Constantinescu O C, et al. Effectiveness of lumbar facet joint blocks and predictive value before radiofrequency denervation: the facet treatment study (FACTS), a randomized, controlled clinical trial[J]. Anesthesiology, 2018, 129(3): 517-535.
[26]Kennedy D J, Huynh L, Wong J, et al. Corticosteroid injections into lumbar facet joints: a prospective, randomized, double-blind placebo-controlled trial[J]. Am J Phys Med Rehabil, 2018, 97(10): 741-746.
[27]Ackerman W E 3rd, Ahmad M. Pain relief with intraarti-cular or medial branch nerve blocks in patients with positive lumbar facet joint SPECT imaging: a 12-week outcome study[J]. South Med J, 2008, 101(9): 931-934.
[28]Abbott Z, Smuck M, Haig A, et al. Irreversible spinal nerve injury from dorsal ramus radiofrequency neurotomy: a case report[J]. Arch Phys Med Rehabil, 2007, 88(10): 1350-1352.
[29]Rambaransingh B, Stanford G, Burnham R. The effect of repeated zygapophysial joint radiofrequency neurotomy on pain, disability, and improvement duration[J]. Pain Med, 2010, 11(9): 1343-1347.
[30]Son J H, Kim S D, Kim S H, et al. The efficacy of repeated radiofrequency medial branch neurotomy for lumbar facet syndrome[J]. J Korean Neurosurg Soc, 2010, 48(3): 240-243.
[31]Smuck M, Crisostomo R A, Trivedi K, et al. Success of initial and repeated medial branch neurotomy for zygapophysial joint pain: a systematic review[J]. PM R, 2012, 4(9): 686-692.
[32]Narouze S, Benzon H T, Provenzano D, et al. Interventional spine and pain procedures in patients on antiplatelet and anticoagulant medications (second edition): guidelines from the American Society of Regional Anesthesia and Pain Medicine, the European Society of Regional Anaesthesia and Pain Therapy, the American Academy of Pain Medicine, the International Neuromodulation Society, the North American Neuromodulation Society, and the World Institute of Pain[J]. Reg Anesth Pain Med, 2018, 43(3): 225-262.
[33]Endres S, Shufelt A, Bogduk N. The risks of continuing or discontinuing anticoagulants for patients undergoing common interventional pain procedures[J]. Pain Med, 2017, 18(3): 403-409.
[34]Burnham T, Hilgenhurst G, McCormick Z L. Second-degree skin burn from a radiofrequency grounding pad: a case report and review of risk-mitigation strategies[J]. PM R, 2019, 11(10): 1139-1142.
[35]Dobrogowski J, Wrzosek A, Wordliczek J. Radiofrequency denervation with or without addition of pentoxifylline or methylprednisolone for chronic lumbar zygapophysial joint pain[J]. Pharmacol Rep, 2005, 57(4): 475-480.
[36]Manchikanti L, Malla Y, Wargo B W, et al. Complications of fluoroscopically directed facet joint nerve blocks: a prospective evaluation of 7,500 episodes with 43,000 nerve blocks[J]. Pain Physician, 2012, 15(2): E143-E150.
[37]Smuck M, Crisostomo R A, Demirjian R, et al. Morphologic changes in the lumbar spine after lumbar medial branch radiofrequency neurotomy: a quantitative radiological study[J]. Spine J, 2015, 15(6): 1415-1421.
[38]Smith C, DeFrancesch F, Patel J, et al. Radiofrequency neurotomy for facet joint pain in patients with permanent pacemakers and defibrillators[J]. Pain Med, 2019, 20(2): 411-412.
[39]Gazelka H M, Welch T L, Nassr A, et al. Safety of lumbar spine radiofrequency procedures in the presence of posterior pedicle screws: technical report of a cadaver study[J]. Pain Med, 2015, 16(5): 877-880.