摘要:
脓毒性休克仍然是一个与显著发病率和病死率相关的卫生保健问题。《拯救脓毒症运动指南》(SSC指南)建议早期液体复苏和抗生素治疗。除了最初始的治疗,但该指南并没有明确推荐休克患者启动血管加压药和糖皮质激素治疗的合适时机。这篇综述总结了有关这些干预措施启动时间的文献。总结了与休克发作有关的这些治疗的启动时间、相互之间的治疗顺序以及用于指导启动这些干预措施的临床标记物的临床数据。但发现在休克发作后的前6小时内早期大剂量血管加压药的启动与较低的病死率相关。
在启动去甲肾上腺素后,有关进一步升级使用其它辅助性血管加压药,包括确切的剂量和时间节点在文献中并没有很好的阐述。然而,最近的数据表明,启动时机可能是其它血管加压药和补充性治疗(如糖皮质激素)的一个重要因素。去甲肾上腺素的剂量和血乳酸浓度有助于确定脓毒性休克患者何时进一步启动血管加压素和血管紧张素II。未来的指南务必对脓毒性休克治疗的启动时间做出明确的推荐建议。
引言
脓毒症和脓毒性休克仍然是与显著发病率和病死率相关的主要卫生保健问题。在《拯救脓毒症运动(SSC)指南》中,脓毒症和脓毒性休克治疗指南推荐及早开始输液,广谱抗生素,对于脓毒性休克患者,推荐去甲肾上腺素作为一线血管加压药。脓毒性休克患者的炎症状态导致血管内皮细胞损伤和内皮细胞糖萼脱落,血管通透性增加、微循环障碍、以及血管扩张性休克。液体复苏仍然是通过恢复血管内容量、心输出量和氧气供应来减轻脓毒性休克患者血流动力学损害的一线治疗方法。然而,液体复苏的效果会在30-60分钟内消失,当针对疾病的治疗如有更多的其它选择时,如血管加压药和抗生素,重复的液体复苏则变得受益有限。在脓毒症和脓毒性休克患者中尽早启动抗生素治疗的重要性已经得到了很好的证实,并且对于脓毒性休克患者而言,抗生素的开始使用每延迟一小时就会导致更差的结果。因此,在确诊或可疑脓毒症确诊后的第一个小时内开始使用抗生素是必须的。
除了最初使用液体复苏和抗生素治疗脓毒性休克外,SSC指南没有明确提供关于血管加压药和糖皮质激素启动的恰当时机,这会导致临床实践中的差异。治疗患者的临床医生认识到这种差异,就会使得具有普适性推荐意见的获得变得更具有挑战性。尽管存在临床差异,但临床医生往往对脓毒性休克患者的程序化处理方法依然感兴趣。
目前的文献描述了干预措施的启动时机与休克发生时间之间的时间关系,以及与彼此相关的治疗顺序。临床标志物,包括去甲肾上腺素剂量需求或血乳酸浓度,也被建议用来指导启动时机。这篇评论围绕着血管加压药和糖皮质激素治疗的启动时间方面做了总结,描述了目前文献中的空白以及启动这些治疗时的考量因素(图1)。旨在为临床医生提供指导,以帮助确定干预的时机,从而减少在血流动力学受损状态下所花费的时间。
在这篇综述中,纳入了PubMed 2000年1月至2022年1月的英文文献,包括以下术语:去甲肾上腺素、肾上腺素、精氨酸加压素、血管紧张素II、糖皮质激素、液体复苏、脓毒性休克和脓毒症。相关的临床数据也都被叙述性地总结,其中包括对照试验、观察性研究、综述性文章、指南和共识声明。重点是关于脓毒性休克患者启动这些治疗的具体有争议的问题。尽管有些引文的证据水平很低,但有一种趋势表明,人们一直对报告脓毒性休克相关治疗的恰当的启动时机比较感兴趣。
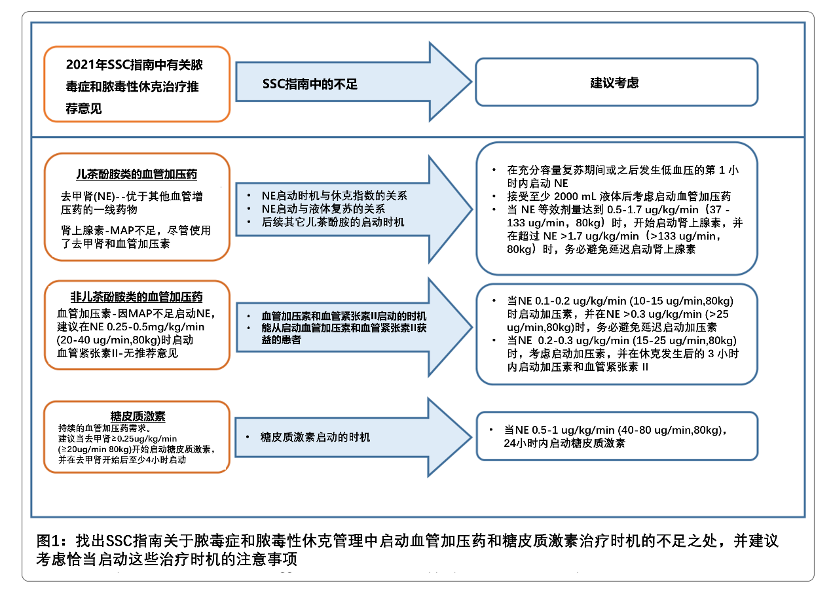
血管加压药的启动时机
目前SSC指南推荐去甲肾上腺素作为脓毒性休克的一线血管加压药(vasopressor)。当平均动脉压(MAP)达不到目标时,建议加用血管加压素(vasopressin)而不是一味儿地增加去甲肾上腺素的剂量。对于MAP不足的患者,尽管有去甲肾上腺素和血管加压素,但肾上腺素是一种推荐的替代药物。而在脓毒性休克合并心功能不全和持续低灌注的患者中,尽管已经给予了足够的液体复苏,但多巴酚丁胺可以加入去甲肾上腺素。尽管多巴胺以前在纠正低血压中起主要作用,但证据却与之相反,荟萃分析显示,与去甲肾上腺素相比多巴胺会增加患者的病死率。针对这一点,再加上高剂量多巴胺对心肌的过度β刺激导致不良心律失常,使得在脓毒性休克中的应用仅限于其他儿茶酚胺(去甲肾上腺素或肾上腺素)无法获得的环境中才考虑使用多巴胺。虽然指南强烈推荐去甲肾上腺素作为脓毒性休克的一线血管加压药,但比较现有二线药物的数据有限。因此,应根据血管活性药治疗的药理作用、所需的药效作用和患者的特点,采用个体化的方法来决定血管活性治疗方案。
虽然有关何谓“大剂量”儿茶酚胺的真正定义仍然存在争议,但有证据表明,去甲肾上腺素单药治疗的剂量超过了常规使用剂量的范围并因此而带来损害的剂量。必须考虑血管加压药治疗的风险,并应使用最低有效剂量,因为多项评估表明,较高剂量的儿茶酚胺,特别是超过0.5-1 ug/kg/min的剂量,与不良反应和病死率独立相关。一项回顾性研究评估了需要高剂量血管加压药物的脓毒性休克患者的生存情况,报告了与增加病死率相关的平均血管加压药物剂量为去甲肾上腺素>0.75 ug/kg/min(敏感性73%,特异性74%)。因此,早期多模式血管加压药物治疗的基本原则强调在休克时间轴的早期联合使用多种不同作用机制的血管加压药,而不一定是在某种血管加压药物失败后而才联合使用另外一种血管加压药在这种情况下,较少的儿茶酚胺和更多的辅助治疗环境被认为是有益的。值得注意的是,即使对于特定的血管加压药物如去甲肾上腺素,文献中关于剂量如何报告也存在不一致的情况。总体而言,研究已经报道了使用酒石酸去甲肾上腺素、去甲肾上腺素碱和盐酸去甲肾上腺素的剂量,这些产品每单位(规格)含有不同的去甲肾上腺素碱的剂量,这增加了报道最佳起始血管加压药剂量的复杂性。
早期在脓毒性休克中启动血管加压药的关键方面是与充分的液体复苏相互作用。在CHASERS(休克中血管加压药的特征,Characterization of Vasopressor Requirements in Shock,CHASERS)研究中,评估了血管加压药的使用和液体输注。在这项多中心、前瞻性、观察性队列研究中显示,在休克发作的前6小时内,随着血管加压药的给药强度(vasopressor dosing intensity,VDI)的增加,那么该患者的30天住院死亡风险是增加的,VDI被定义为去甲肾上腺素及其等效的其它血管加压药物的总剂量。随着VDI的增加,高病死率在前24小时内持续存在,若以去甲肾上腺素等效剂量计算,其中血管加压药剂量的中位数为8.5μg/min(相当于80kg患者,0.1μg/kg/min)。有趣的是,那些接受至少2000mL液体的患者减弱了VDI与病死率增加之间的相关性。此外,早期高VDI(休克发作后的前6小时内开始血管加压药治疗并且VDI ≥ 15μg/min去甲肾上腺素等效剂量),与早期低VDI(休克发作后的前6小时内VDI < 15μg/min去甲肾上腺素等效剂量)、晚期高VDI(休克发作6小时后,VDI ≥ 15μg/min去甲肾上腺素等效剂量,并持续至第一个24小时)和持续VDI暴露(休克发作后的前6小时内VDI ≥ 15μg/min去甲肾上腺素等效剂量,并持续增加至整个24小时)相比,病死率更低,这些证据进一步支持早期启动血管加压药。尽管该项研究没有使用基于公斤体重的剂量去评估血管加压药的使用,但即使对于80kg体重的患者,15μg/min的去甲肾上腺素等效剂量大约相当于0.2μg/kg/min。重要的是,CHASERS研究中所有这些分析都针对疾病严重程度因素进行了校正,例如APACHE III评分、合并症和其他复苏干预措施。相比之下,最近发表的前瞻性、多中心、观察性研究根据血管加压药治疗时间与液体复苏的关系将患者分为早期血管加压药治疗组和晚期血管加压药治疗组。在该项倾向匹配分析中,当血管加压药治疗在液体复苏(fluid bolus administration)后的1小时内开始时,患者28天的死亡风险更高(47.7% vs 33.6%; p = 0.013)。当两组的输液总量均大于30mL/kg时,晚期血管加压药治疗组在休克识别后6h内的输液量更大(33.4mLvs.38.0±15.7mL/kg;p=0.046)。该研究未报告血管加压药的剂量,因此无法与先前提到的文献进行比较。未来的研究需要评估液体和血管加压药治疗启动时机之间的关系,以及在脓毒症中的限制性液体治疗策略。尽管目前无法得出理想液体复苏的阈值,但适当的血管内复苏似乎能够减弱血管加压药剂量与患者病死率之间的关系。
平衡血管加压药和限制儿茶酚胺剂量之间的需求问题,引发了对脓毒性休克和持续性低血压患者对血管加压药启动时机的质疑。在脓毒性休克的危重患者中,低血压与病死率和器官系统损伤之间密切相关。在脓毒性休克患者,尽管对儿茶酚胺剂量过大的问题存在担忧,但去甲肾上腺素的启动是实现MAP目标和恢复重要器官灌流的基础。当延迟启动时,尤其是超过6小时时,患者似乎需要更长时间的血管加压药维持治疗,导致休克无法缓解。然而,确定启动血管加压药的准确时间点是具有挑战性的。有人提出,当舒张期动脉压(DAP)偏低时应该是反映了血管张力丧失和全身血管扩张。然而,DAP并没有被传统地纳入脓毒性休克的定义中,其效用需要进一步研究和证实。一项评估DAP和心率在血管加压药开始前和开始时的比值(舒张期休克指数,DSI)(译者注:DSI可以计算为心率除以DAP。DSI>2.2与较高的病死率相关,并被提倡评估早期开始使用血管加压药。DSI反映了血管扩张或者血管麻痹的严重程度)的研究报告称,DSI的增加与死亡风险增加相关,DSI可以用来指导血管加压药启动的时机。
应考虑尽早和积极地启动血管加压药的治疗,并也得到了多项研究的支持,这些研究指出延迟血管加压药治疗与病死率增加之间存在关联。这些研究结果与2018年SSC Hour-1 bundle(SSC 1小时集束化治疗)相一致,该集束化治疗建议在容量复苏期间或之后的第1个小时内启动血管加压药治疗。一项小型回顾性研究发现,早期合适的抗生素治疗和达到足够的全身灌注,而不是随心所欲地启动血管加压药治疗,与改善器官功能相关。然而,随后的回顾性分析发现,血管加压药治疗的延迟会恶化临床结果,包括病死率。一项评估发现,去甲肾上腺素每延迟启动1小时,会导致病死率增5.3%。鉴于先前回顾性研究的局限性,2019年发表了CENSER试验,该研究是一项单中心、前瞻性、双盲、安慰剂对照试验,评估了随机分配到早期低剂量去甲肾上腺素治疗组或安慰剂组患者的休克控制率。休克控制率的定义为持续的平均动脉压(MAP)≥65mmHg,并有充分的组织灌注的证据。早期启动血管加压药治疗组患者去甲肾上腺素启动时间为1.5小时,而标准治疗组为3小时。在6小时时,早期启动血管加压药治疗组的休克控制率达到76.1%,而标准组仅为48.4%(p <0.001)。尽管两组之间28天的病死率没有差异,但早期启动去甲肾上腺素治疗组的患者心源性肺水肿和新发心律失常的发生率较低。此外,早期启动血管加压药治疗可以限制脓毒性休克中液体正平衡带来的有害影响,早期启动血管加压药可通过增强液体的血管内作用并避免液体超负荷。在脓毒性休克患者的一项回顾性研究中,早期启动去甲肾上腺素治疗的患者比延迟启动的患者需要的液体更少。因此,应尽早启动去甲肾上腺素治疗,理想情况下在休克发生后的1小时内,并且在充分的液体复苏后启动。
其它补充性的血管加压药的启动时间
血管加压素(Vasopressin)
血管加压素是一种非儿茶酚胺类的血管加压药,具有对加压素-1(V1)受体的药理活性,导致血管收缩,并具有V2受体介导的抗利尿活性。具有里程碑意义的脓毒性休克加压素试验(Vasopressin in Septic Shock Trial,VASST)比较了血管加压素联合去甲肾上腺素与单独使用去甲肾上腺素的情况。总体而言,两组之间的28天病死率没有差异(血管加压素联合去甲肾上腺素为35.4%,单独使用去甲肾上腺素为39.3%)。然而,亚组分析发现,在病情不太严重的脓毒性休克患者中,使用血管加压素具有降低病死率的益处,这些病情不太严重的患者是随机分组时去甲肾上腺素剂量≤15 ug/min和随机分组时乳酸浓度≤1.4 mmol/L的患者。随后,一项单中心、前瞻性、开放标签试验显示,在去甲肾上腺素治疗的前4小时内早期使用血管加压素比单独使用去甲肾上腺素能更快地实现和维持目标平均动脉压(MAP)。实现目标MAP和降低儿茶酚胺剂量需求已经成为使用血管加压素的一致性发现,并且与改善结果相关。最近的一项回顾性观察评估发现,是在调整了序贯器官功能衰竭评分(SOFA)和急性生理和慢性健康评分III(APACHE III)之后。
在调整了SOFA评分和APACHE III评分,以及儿茶酚胺剂量后,血管加压素接受者中有45.4%在血管加压素开始后6小时内实现了好的血流动力学反应,这与减少ICU的病死率风险独立相关(OR, 0.51; 95% CI 0.35–0.76)。这些研究表明,早期启动血管加压素可能是有益的,并将血流动力学反应作为其持续使用的目标。
在VASST研究中,与单独接受去甲肾上腺素相比,当随机分组时去甲肾上腺素剂量≤15 ug/min时,血管加压素组的病死率降低。仅评估血管加压素接受者的观察性分析显示了类似的趋势。一项研究发现,在血管加压素启动时,去甲肾上腺素的等效剂量与ICU病死率的增加风险独立相关(OR,3.14;95% CI 1.36–7.28)。此外,最近的一项研究发现,在调整了病情严重程度的协变量(包括SOFA评分和APACHE III评分)后,当血管加压素启动时去甲肾上腺素等效剂量在60 ug/min以下时,每增加10 ug/min的去甲肾上腺素等效剂量,院内死亡的风险增加20.7%(OR,1.21;95% CI 1.09–1.34)。当血管加压素启动时,去甲肾上腺素等效剂量超过60 ug/min时,未检测到相关性。关于临床标志物血乳酸,数据显示与血管加压素启动的时间有关,与ICU病死率的增加风险相关(OR,1.10;95% CI 1.04–1.18)。一项研究发现,当血管加压素在休克发生后12小时开始时,每增加1 mmol/L的血乳酸浓度,院内死亡风险增加18%。相反,VASST研究和前述的回顾性评估未发现休克发生后到血管加压素开始的时间(以小时计)与临床结果之间的关联。这些数据表明,在使用时,应在患者处于低剂量去甲肾上腺素或血乳酸浓度较低时开始启动血管加压素的治疗,而不是延迟到临床标志物明显升高,表明疾病更为严重。早期启动血管加压素的好处可能归因于其涉及内分泌替代的机制,因为已知血管加压素水平在低血压发作后会迅速下降。第二个理由可能是其节约去甲肾上腺素的能力,限制免疫调节效应和减少对去甲肾上腺素的暴露。无论如何,应该努力尽早开始血管加压素的治疗,而不是延迟使用血管加压素的使用。
去甲肾上腺素等效剂量和血乳酸浓度是可以用来帮助确定何时开始给予脓毒性休克患者启动相关加压素的重要标志物。然而,目前尚不清楚其中哪一个标志物的预测性更强,或者如何同时利用这两个标志物。2021版的SSC指南支持了这个想法,并建议将血管加压素作为一种备选添加到那些未达到目标MAP的患者中,而不是无限制地、一味地增加去甲肾上腺素的剂量。临床上,在床旁,尤其是当血乳酸浓度不易获取或最近没有进行检测,似乎去甲肾上腺素等效剂量可能是更容易获取的标志物,应在其剂量超过10-15 ug/min(在80公斤体重的患者中为0.1-0.2 ug/kg/min)之前考虑开始血管加压素的使用。
血管紧张素II(Angiotensin II)
血管紧张素II是由血管紧张素转换酶(ACE)剪切血管紧张素I产生的八肽,与血管紧张素II型1受体具有较高的亲和力。它可刺激外周血管平滑肌上的这种G蛋白偶联受体会导致醛固酮分泌、内源性血管加压素的释放,以及直接的动脉和静脉血管收缩。这种人体肽的合成类似物已在“血管紧张素治疗高动力型休克”(Angiotensin II for Treatment of High Output Shock,ATHOS-3)的研究中进行过评估。在这项3期临床研究中,研究对象为难治性休克患者,需要至少0.2 ug/kg/min去甲肾上腺素等效剂量,患者入组时的中位数为0.34 ug/kg/min。随后,早期上市后评估表明,临床采用的血管紧张素II与ATHOS-3中的并不一致。这些研究包括所有接受血管紧张素II治疗血管扩张性休克的患者,其中大多数患者为脓毒性休克。血管紧张素启动时的背景为血管加压药(这里指去甲肾上腺素)需求量分别为0.58ug/kg/min和0.55ug/kg/min,都远高于3期临床试验的剂量。
在ATHOS-3研究中,接受血管紧张素II治疗的患者中有69.9%达到了主要的血液动力学终点,而接受标准治疗的患者中这一比例仅有23.4%(OR,7.95;95% CI 4.76–13.3,p < 0.001)。在血管紧张素II上市后的评估中发现类似的血液动力学反应率,尽管对反应的定义有所不同,其中,Wieruszewski等人的研究中为67%,Smith等人的研究中为80.1%。然而,在对反应者进行分析时,与无反应者相比,对血管紧张素II具有积极血液动力学反应的患者在30天内死亡的风险较低(HR,0.50;95% CI 0.35–0.71,p < 0.001),尽管这些患者的基线疾病严重程度不同。此外,血乳酸浓度较低的患者更有可能对血管紧张素II产生积极的血液动力学反应(OR,增加1.11/mmol/L;95% CI 1.05–1.17,p < 0.001),并在30天内存活下来(死亡风险比HR,增加0.94/mmol/L;95% CI 0.91–0.96,p < 0.001)。当根据基线血管加压药的需求进行二分类时,在ATHOS-3研究中,如果其基线血管加压药需求较低(< 0.5 ug/kg/min),血管紧张素II的接受者更有可能达到血压目标。考虑到后期售后环境中的基线血管加压药的需求,发现血管紧张素II具有更能显著节省血管加压药的效果。在那些血管加压药需要< 0.2 ug/kg/min的患者中,此种效果更为明显(3小时的平均差,-97.7%;95% CI -171.7至-23.8%,p = 0.01),然而发现这种效果仍然适用于< 0.3 ug/kg/min的患者,尽管差异程度稍有减少(3小时的平均差,-68.3%;95% CI -133.5至-3.0%,p = 0.04)。这些数据均表明,在休克不太严重时,应用血管紧张素II治疗成功的机会最大,并且对结果产生积极的影响。
在ATHOS-3研究中,与安慰剂相比,接受血管紧张素II的患者在3小时内背景血管加压药的剂量发生了更显著的变化(-0.03 vs. +0.03 ug/kg/min,p < 0.001)。Wieruszewski等人发现,与血管紧张素II反应者相比,在3小时内背景血管加压药剂量发生了更显著的节省效果,平均减少了0.20 ug/kg/min去甲肾上腺素等效剂量。尽管大多数患者已经接受了血管加压素(n = 248,92%),但已经接受血管加压素的患者在多变量分析中更有可能对血管紧张素II产生良好的血液动力学反应(OR,6.05;95% CI 1.98–18.6,p = 0.002)。同样,Smith等人发现在3小时内平均降低了0.16 ug/kg/min去甲肾上腺素等效剂量。至于这些差异和更显著的血管加压药节省效果是源于更高的基线血管加压药的需求还是由于滴定方案和目标血压值的差异造成的,目前尚不清楚。
似乎一部分患者,其内源性肾素-血管紧张素系统功能紊乱,对血管紧张素II有显著反应,并可能受益于早期给药。当血管紧张素转换酶存在缺陷或不足时,内源性血管紧张素II不会产生,导致血管紧张素I和肾素积累。这增加了可供脑啡肽酶(Neprilysin)和ACE-2降解的底物量,导致血管扩张的血管紧张素副产物,即血管紧张素1-9和血管紧张素1-7的积累。这些物质在肾小球旁细胞上提供反馈,以产生额外的肾素,进一步增强血管扩张途径。因此,在ATOS-3研究中,肾素水平较高的患者(即与血管紧张素II相比,血管紧张素I过多)在使用血管紧张素II与安慰剂(28天存活率分别为70%和51%,HR,0.56;95%CI为0.35-0.88,p=0.01)[50]时,有显著的避免死亡的效果。因此,通过补充外源性血管紧张素II可抑制这种灾难性的负反馈循环路,并防止血管扩张介质的大量积聚,可能作为改善脓毒性休克结果的一种机制。
肾上腺素(Epinephrine)
升级其它补充性儿茶酚胺类药物的确切剂量和时间尚未很好地阐明,其中也包括肾上腺素。如前所述,在混合性心源性休克导致组织灌注不足和心输出量减少的患者中,肾上腺素可能比血管加压素更受欢迎,因为肾上腺素的β受体作用和血管加压素缺乏正性肌力作用。一项新的剂量研究调查了脓毒性休克患者启动肾上腺素的最佳去甲肾上腺素等效剂量,这项研究确定了启动肾上腺素的最佳去甲肾上腺素剂量范围为37-133 ug/ min,对于80公斤的患者为0.5-1.7 ug/ kg/min。在该剂量范围内,29%的患者在肾上腺素的作用下实现了血流动力学的稳定,而在这个剂量范围之外使用肾上腺素的患者中只有15%的人达到了血流动力学稳定(p=0.03)。根据这些数据,建议以37~133 ug/ min(0.5-1.7 ug/ kg/min,80kg)的去甲肾上腺素等效剂量作为启动肾上腺素的理想临界点,应避免延迟给药至去甲肾上腺素剂量超过133 ug/ min。延迟启动肾上腺素的治疗可能影响血流动力学稳定性的实现,甚至可能是徒劳的。在使用去甲肾上腺素后,可以考虑在儿茶酚胺节省策略的同时,将去甲肾上腺素的等量升级(切换)为与先前描述的剂量相当的肾上腺素。由于没有关于其他额外的儿茶酚胺类药物的最佳时机的数据,因此必须经过深思熟虑的升级,以避免过量的儿茶酚胺暴露。使用肾上腺素时,应监测不良反应,包括快速性心律失常、高血糖、低钾血症和高乳酸血症。
非儿茶酚胺类血管加压药的启动时机
在首次启动血管加压药(一线的去甲肾上腺素)之后,由于临床试验方法学的限制和临床实践的回顾性队列研究外推,有关何时二次启动血管加压药(非儿茶酚胺类的)的种类和时机仍然不太清楚。但无论如何,过量的儿茶酚胺类血管加压药的暴露会增加心律失常、重要器官损伤以及组织缺血的风险。较高剂量的血管加压药和显著的累积暴露都与较差的脓毒性休克的预后相关。即使在使用血管紧张素II的患者中,那些去甲肾上腺素需求剂量较大的患者的死亡风险也会增加(HR,1.61,每1 ug/kg/min;95%CI 1.03-2.51p=0.037)。因此,在组织灌注不足的情况下,尽量使用非儿茶酚胺类血管加压药(血管加压素和血管紧张素II)以减少儿茶酚胺类血管加压药的暴露可能是改善脓毒性休克预后和缩短组织低灌注时间的另一种机制。
去甲肾上腺素的等效剂量可用于确定脓毒性休克患者何时启动血管加压素和血管紧张素II。如上所述,在去甲肾上腺素等效剂量超过10-15 ug/min (0.1-0.2 ug/ kg/min,80kg患者)之前,应考虑启动添加血管加压素。同样,当血管加压素治疗后血流动力学依然没有达到稳定时,血管紧张素II应该迅速启动跟进,因为有数据表明二者之间有协同作用。这种添加策略可在去甲肾上腺素等效剂量超过15-25 ug/min (0.2-0.3 ug/ kg/min,80kg患者)之前进行,再次避免儿茶酚胺的毒性。
结合这些敏感和特定的生物标志物,最好是通过开发护理点分析,以及呈现的休克病例的临床特征,将对未来的快速脓毒症护理至关重要。
随着各种休克内源型分子复杂性的不断增加,有必要建立一个以生物标志物为指导的非儿茶酚胺类血管加压药启动的角色,以真正实现早期复苏的个体化。目前作为生物标志物潜在靶点的竞争者包括血浆中血管加压素的浓度和直接肾素浓度。尽管在回顾性研究中,休克患者血浆中的血管加压素浓度与患者对血管加压素有良好的血流动力学反应之间的关系尚未得到证实,但由于血管加压素的快速血浆清除机制,因此仍有机会深入识别那些因为血管加压素的快速血浆清除机制而产生的明显血管加压素缺乏的内源性亚型。另外,肾素在预测低血压患者的院内病死率和ICU病死率方面表现一直都很优秀,并且远远超过了血乳酸。除了高肾素患者对血管紧张素Ⅱ有良好的血流动力学反应之间具有较强的相关性之外,肾素正迅速发展成为一种有希望的休克预测指标。将上述这些生物标志物的敏感和特异性结合起来,最好是开发成床旁分析工具(POCT),再结合休克患者的临床特征,这一点未来必将成为脓毒症快速治疗的关键。
糖皮质激素治疗的启动时机
脓毒性休克的高炎性状态导致血管扩张和低血压。在脓毒性休克的管理中使用糖皮质激素,其抗炎特性通过抑制核因子KB来降低白细胞介素(IL)-1、IL-6、IL-8、肿瘤坏死因子(TNF)-α、TNF受体1和2。此外,糖皮质激素抑制一氧化氮(NO)合成酶,抑制感染引起的NO介导的血管扩张。最后,外源性糖皮质激素解决了皮质醇水平不足的问题,减轻了相对肾上腺皮质功能不足,进一步减轻了脓毒性休克中的血液动力学不稳定。
糖皮质激素治疗在脓毒性休克中的作用仍存在争议。这些争议的问题包括休克持续时间、血管加压药的需求以及病死率,这些必须与不良事件权衡,不良事件包括感染、高血糖和高钠血症在内。四项大型随机对照试验评估了糖皮质激素在脓毒性休克患者中的使用,并报告了不一致的结果。Annane等人的研究和用于人类脓毒性休克的活化蛋白C和糖皮质激素(Activated Protein C and Corticosteroids for Human Septic Shock,APROCCHSS)试验报告称,与安慰剂相比,接受低剂量糖皮质激素方案的脓毒性休克患者的全因病死率显著降低。相比之下,糖皮质激素治疗脓毒性休克(Corticosteroid Therapy of Septic Shock,CORTICUS)试验和糖皮质激素辅助治疗脓毒性休克重症患者(Adjunctive Corticosteroid Treatment in Critically Ill Patients with Septic Shock,ADRENAL)试验均未能显示生存益处。然而,好几项试验发现,氢化可的松与休克逆转的时间较短相关,支持其在持续需要血管加压药的脓毒性休克患者中的使用。这些重要试验纳入标准的不同可能导致了不同的结果。Annane等人的研究和APROCCHSS试验表明,包括了比CORTICUS和ADRENAL试验中患者情况更为严重,并获得了降低病死率的益处。相比之下,CORTICUS和ADRENAL试验并未明确规定纳入液体复苏和血管加压药。因此,可以认为,在充分液体复苏和血管加压药治疗后仍然存在血流动力学不稳定的脓毒性休克患者中,应保留糖皮质激素治疗的启动。然而,氢化可的松治疗的最佳剂量和时间表存在不确定性,主要是由于研究设计的差异和结果的异质性所致。从历史上看(1989年前),研究高剂量、短疗程糖皮质激素的研究显示病死率显著增加。而更近期的研究调查了低剂量、但延长持续时间的治疗,显示出了有益的病死率结果。试验中的氢化可的松剂量为每天200mg,静脉分次给药,治疗时间为5-7天。目前指南推荐氢化可的松200mg/d,静脉注射。
这些试验设计在纳入时的随机时间和血管加压药的剂量上有所不同。在这些试验中的大多数报告了在去甲肾上腺素平均剂量为0.5-1 ug/ kg/min时开始使用糖皮质激素。Annane等人的研究最短的注册时间为8小时。ADRENAL和APROCCHSS的研究设计从休克发生到登记入组都有24小时,而CORTICUS试验到登记入组的时间最长为72小时。Annane等人和ADRENAL研究是唯一报告了从休克发生到第一次使用类固醇的平均时间(分别为4.1 ± 3.4 h ,20.9 ± 91.9 h)。有人认为,在CORTICUS试验中,糖皮质激素激素启动的延迟导致了病死率下降不明显。
一项回顾性队列研究评估了休克发生后使用糖皮质激素的合适时间。根据休克发生后的时间,患者(n=1470)被分成5个不同的时间队列:0-6、6-12、12-24、24-48或>48h。在多变量线性回归中,当在0-6h内与>48h、6-12h与>48h、12-24h与>48h比较时,糖皮质激素的开始时间与较长的存活天数和不使用血管加压药的天数独立相关,并且当比较在0-6h内与>48h内接受糖皮质激素治疗时,与ICU病死率降低相关。最近的一项多中心、倾向评分加权的观察性队列研究评估了脓毒性休克早期(在启动血管加压药12h内)和晚期(在启动血管加压药12小时后)小剂量糖皮质激素激素的启动,并发现,与晚期启动小剂量糖皮质激素激素相比,早期启动可能促使更早地停用血管加压药(40.7h vs .60.6h;p=0.0002)。
尽管关于脓毒性休克患者糖皮质激素治疗开始时间没有明确的建议,但SSC指南推荐在脓毒性休克患者中存在持续需要血管加压药治疗的情况下使用糖皮质激素激素,并建议在血管加压药启动后的4小时内开始使用糖皮质激素,并且去甲肾上腺素等效剂量至少为0.25ug/kg/min。基于现有文献和所述的益处机制,我们认为在脓毒性休克的24小时内,尽管进行了充分的液体复苏和血管加压药的治疗(去甲肾上腺素等效剂量0.5-1ug/kg/min),尽早启动糖皮质激素激素的治疗是合理的。
结论
脓毒性休克是一种与高病死率相关的复杂疾病。及时启动干预治疗以稳定血流动力学和逆转休克状态至关重要。但目前临床指南缺乏关于脓毒性休克相关治疗启动时间的推荐建议。在充分液体复苏之后开始启动去甲肾上腺素可能会减轻血管加压药剂量强度与增加病死率之间的关系。休克发生后的前6小时内,早期大剂量血管收加压药的使用与较低的病死率相关。在启动去甲肾上腺素之后,文献中对于补充性血管加压药升级的确切剂量和时机尚没有得到很好的阐明。然而,近期的数据表明,时机可能是启动血管加压药和补充性治疗(血管加压药、糖皮质激素)的重要因素。在脓毒性休克患者中,去甲肾上腺素等效剂量和血乳酸浓度可帮助确定血管加压素和血管紧张素II的启动时机。利用血浆肾素水平可以完成对生物标志物指导下的血管紧张素II的使用。当去甲肾上腺素的等效剂量为10-15 ug/min (0.1-0.2 ug/ kg/min,80kg患者),或血乳酸浓度<2.3 mmol/L时启动去甲肾上腺素已显示出具有降低病死率的益处。同样,观察性研究表明,在休克发生后的3小时内,当去甲肾上腺素等效剂量为15-25 ug/min (0.2-0.3 ug/ kg/min,80kg患者)时,联合血管加压素和血管紧张素II也可能是有益的。在已经确定或者怀疑休克状态中存在心源性问题患者的患者,而且其他血管加压药的剂量已经优化(充分试用过)时,临床医生应考虑添加肾上腺素,并且不应显著延迟肾上腺素的启动。在评估糖皮质激素使用的随机对照试验中,包括了至少在休克发生后24小时内去甲肾上腺素等效剂量为0.5-1.0 ug/ kg/min时启动了糖皮质激素的脓毒性休克患者。因此,临床上需要简化的指南,其中包含明确的推荐建议,反映实际的临床应用,并基于良好设计的研究。
Ammar MA, Ammar AA, Wieruszewski PM, et al. Timing of vasoactive agents and corticosteroid initiation in septic shock. Ann Intensive Care 2022;12:47 . 10.1186/s13613-022-01021-9