白血病是最常见的儿童恶性肿瘤,随着治疗方案的优化,白血病患儿的治愈率显著提高,白血病幸存患儿的群体基数也不断扩大。然而,由于化疗导致的心脏损伤,白血病幸存患儿面临着沉重的心血管疾病负担。其中,急性髓系白血病(AML)幸存患儿的心血管疾病负担最为显著,主要表现为化疗后的心力衰竭,严重降低了患儿的生存质量。然而,临床上缺乏白血病围化疗期的心肌保护药物,导致患儿的心脏疾病负担居高不下。
2024年4月12日,国家儿童医学中心(上海)、上海交通大学医学院附属上海儿童医学中心张浩教授团队在European Heart Journal在线发表了题为“Rescue of cardiac dysfunction during chemotherapy in acute myeloid leukaemia by blocking IL-1α”的研究论文,揭示了白血病化疗的心脏毒性新机制,为降低白血病幸存患儿的心脏疾病负担提供了新策略。

首先,研究人员利用AML患儿化疗后的心肌活检标本进行单细胞测序,发现化疗后心肌细胞的“命运”与其能量代谢紊乱密切相关,受损心肌细胞表现为糖代谢相关基因表达的上调与脂肪酸代谢相关基因表达的下调,能量代谢出现重编程。
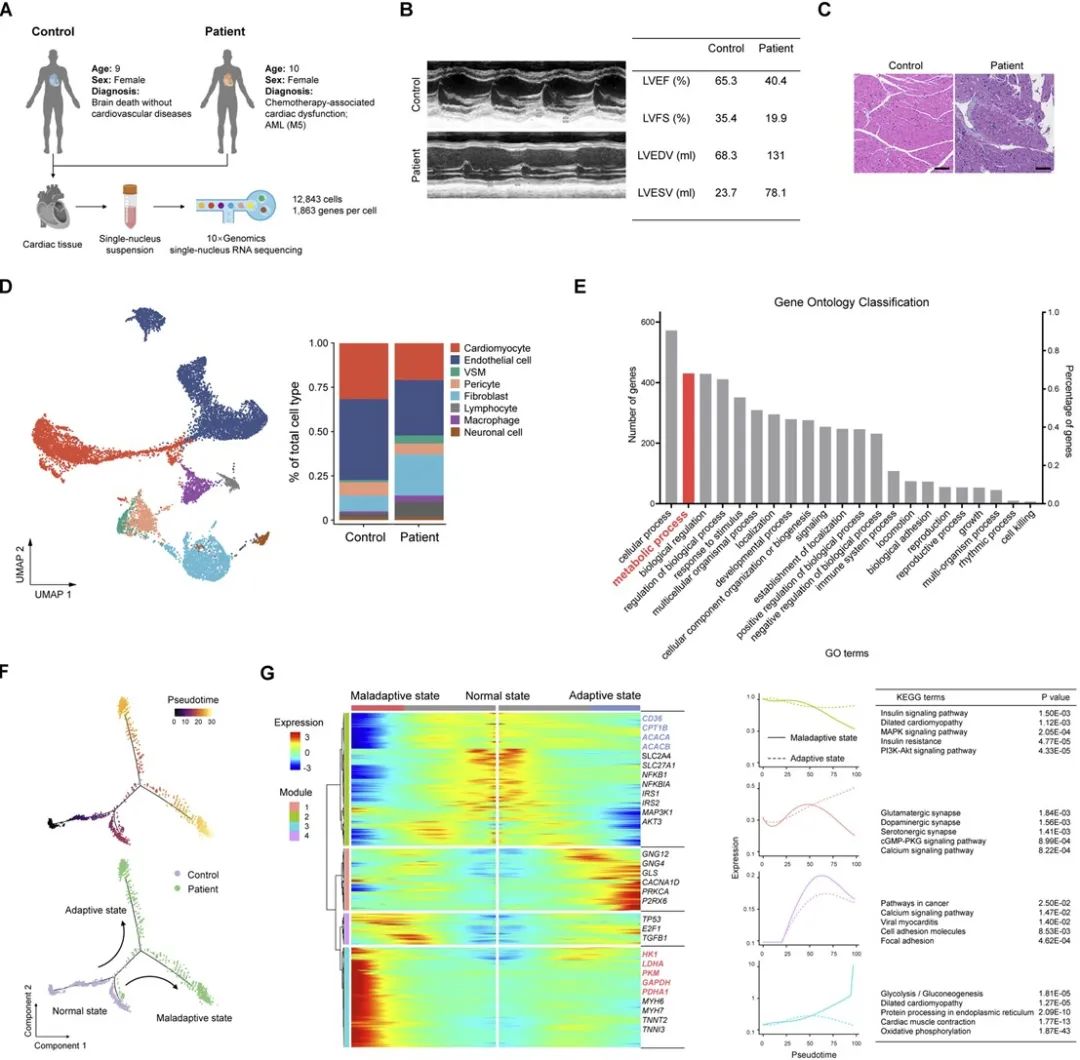
为了探究化疗引起心脏损伤的机制,研究人员构建了MLL-AF9、NUP98-HOXA9 AML动物模型,并在此基础上模拟临床用药方案给予诱导化疗,小动物磁共振和心脏超声检查发现AML荷瘤小鼠在接受柔红霉素(DNR)化疗后会出现心脏功能下降。PET/CT结果显示心脏脂肪酸摄取降低,葡萄糖摄取增加,ATP含量下降。有趣的是,无瘤小鼠在接受相同剂量的DNR化疗后却不会出现上述改变,提示化疗后肿瘤的变化在化疗诱导的心脏功能障碍和代谢紊乱中起到了关键作用。
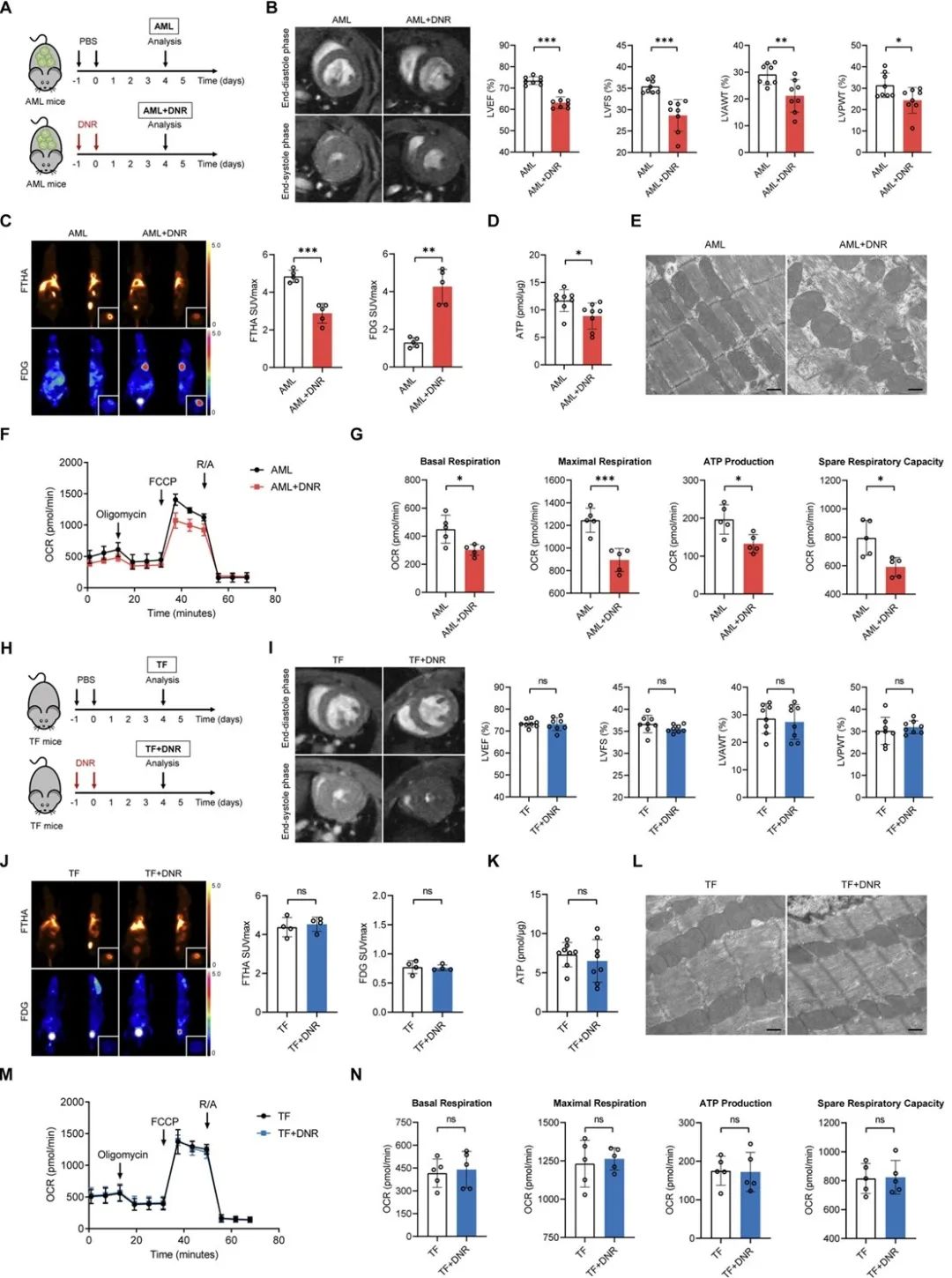
接下来,研究者进一步应用代谢流技术评估了荷瘤小鼠化疗后心脏能量代谢的变化,实验结果表明:三羧酸循环中脂肪酸来源的碳显著降低,葡萄糖来源的碳显著增高,并且葡萄糖在磷酸戊糖途径中的碳流量增强。这提示作为心脏主要供能物质的脂肪酸利用出现障碍,糖酵解和磷酸戊糖途径代偿性增强。然而,进一步的质谱检测却显示化疗后荷瘤小鼠心脏三羧酸循环中代谢物的绝对定量出现下降,从而说明糖代谢的增强并没有完全代偿脂肪酸能量代谢的下降,最终导致心脏直接供能物质ATP的缺乏,引起心脏功能障碍。
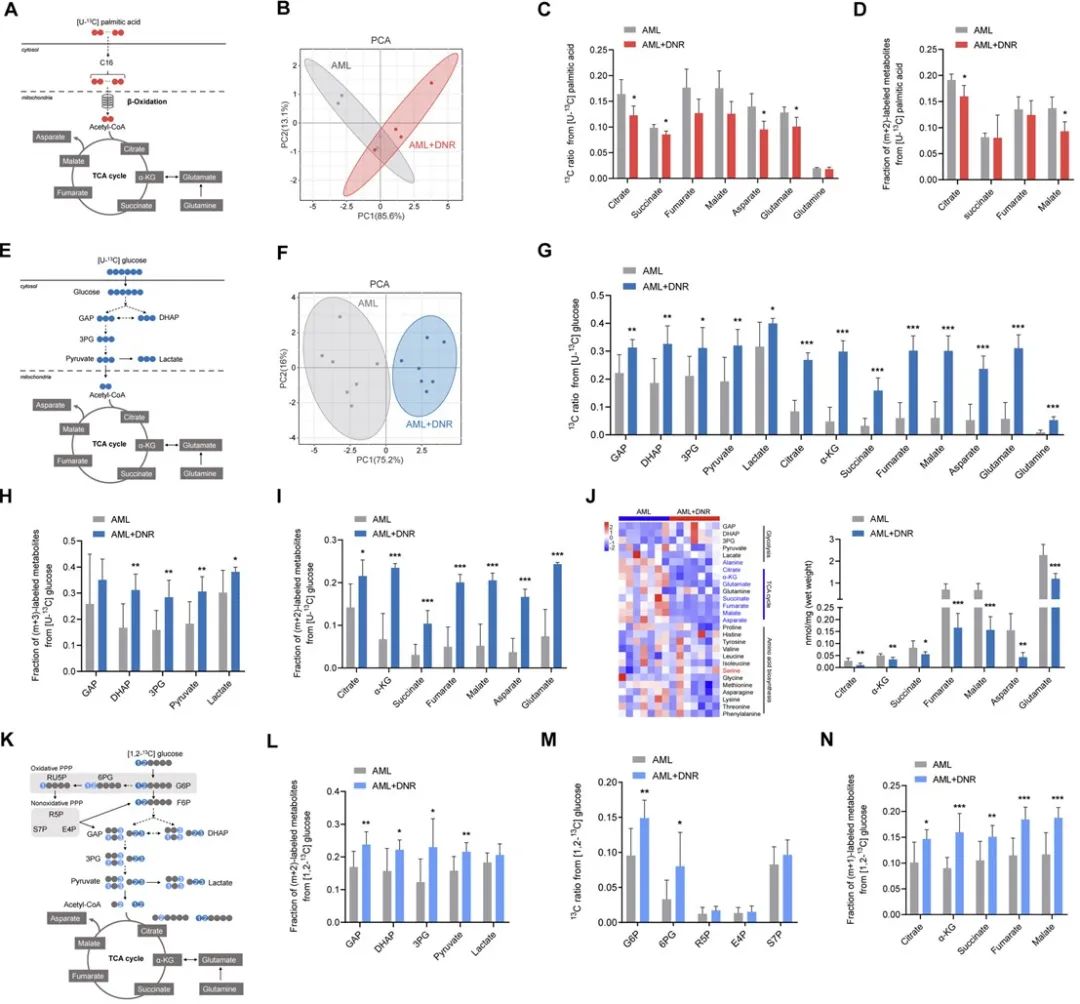
进一步,心脏bulk-RNA测序结果显示细胞因子通路显著富集,证明细胞因子可能在心脏代谢重编程中有重要作用。为了明确引起心脏能量代谢障碍的细胞因子,研究者利用血浆多因子筛选与蛋白质组学技术,发现血浆IL-1α在荷瘤小鼠化疗后显著升高,无瘤小鼠化疗后无显著改变,其变化趋势与心脏代谢表型变化一致。研究人员进一步发现注射IL-1α重组蛋白能直接引起无瘤小鼠心脏功能障碍,然而心肌细胞特异性IL-1α受体敲除却能减轻化疗引起的心脏损伤。
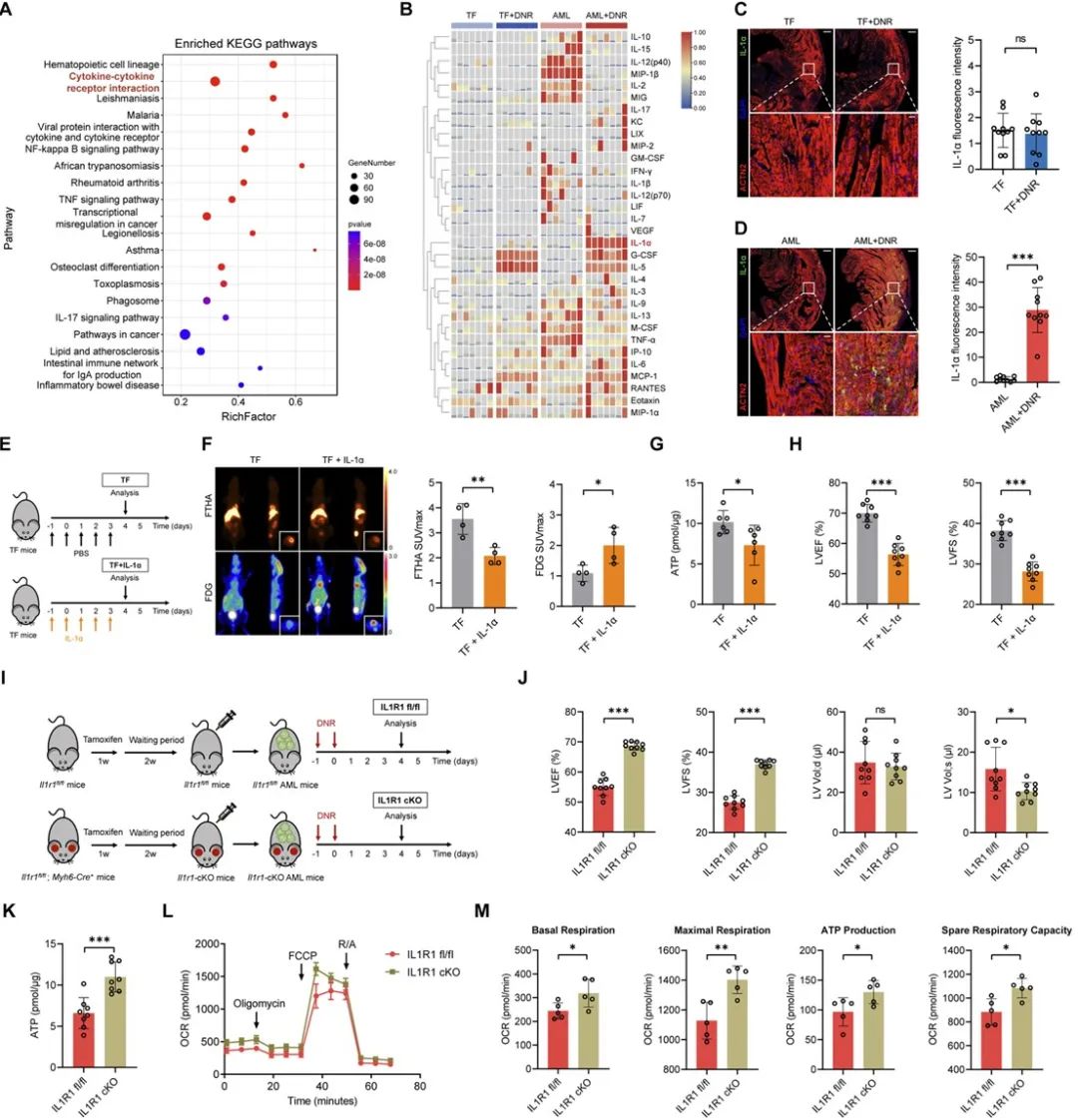
为了阐明IL-1α的主要来源,研究者利用IL-1α敲除小鼠与IL-1α敲降的AML细胞进行了交叉验证实验,证明化疗引起肿瘤细胞坏死释放的IL-1α是导致心脏能量代谢紊乱、功能障碍的主要原因。
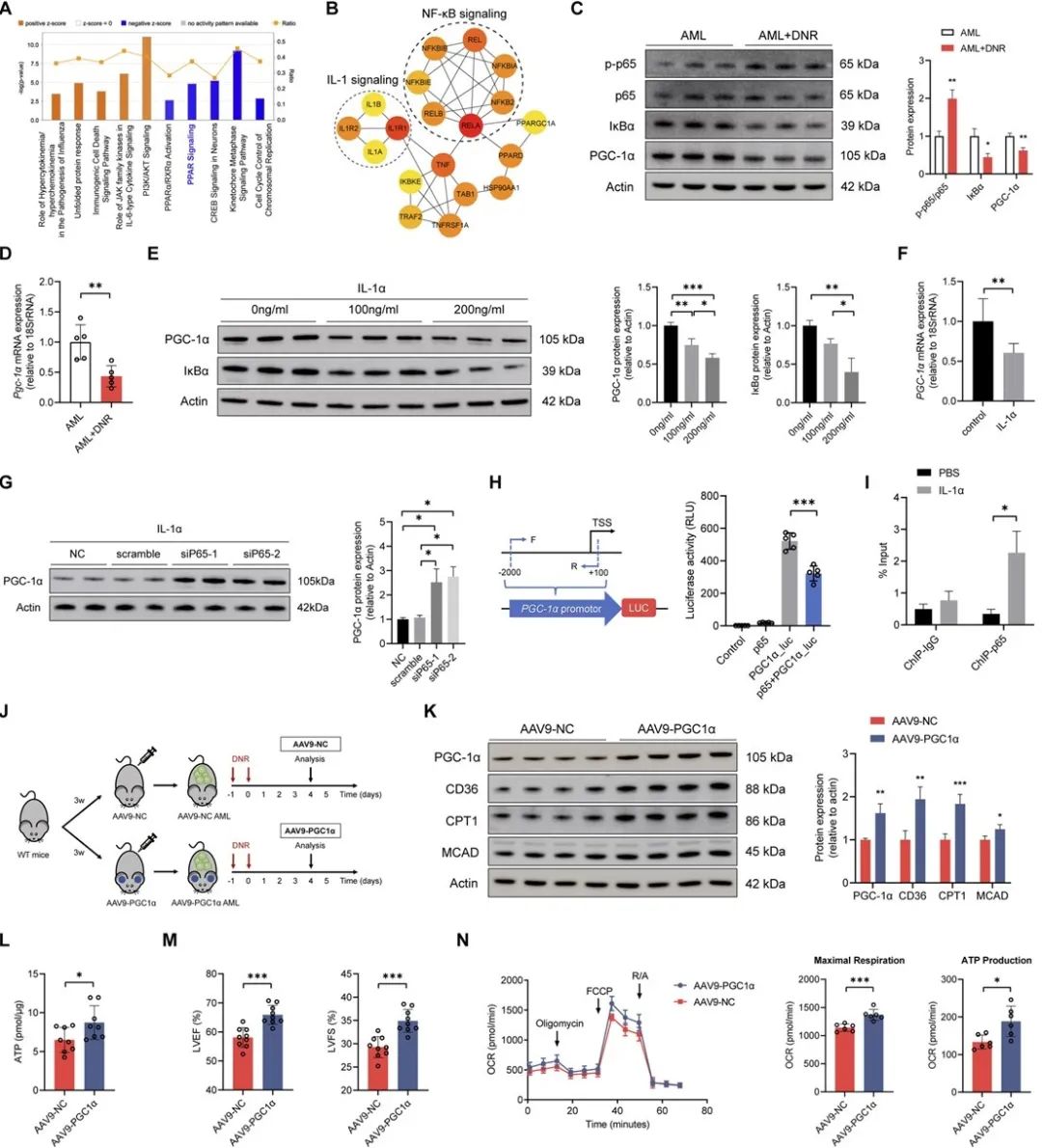
分子机制上,IL-1α引起心脏NF-κB信号通路激活,进而抑制能量代谢关键调节因子PGC-1α的表达,从而造成脂肪酸代谢障碍和葡萄糖利用的代偿性升高。NF-κB通路抑制剂、心肌细胞PGC-1α过表达均能提高荷瘤小鼠化疗后心脏功能。上述结论在患者心肌样本与AML化疗队列中得到了进一步验证。
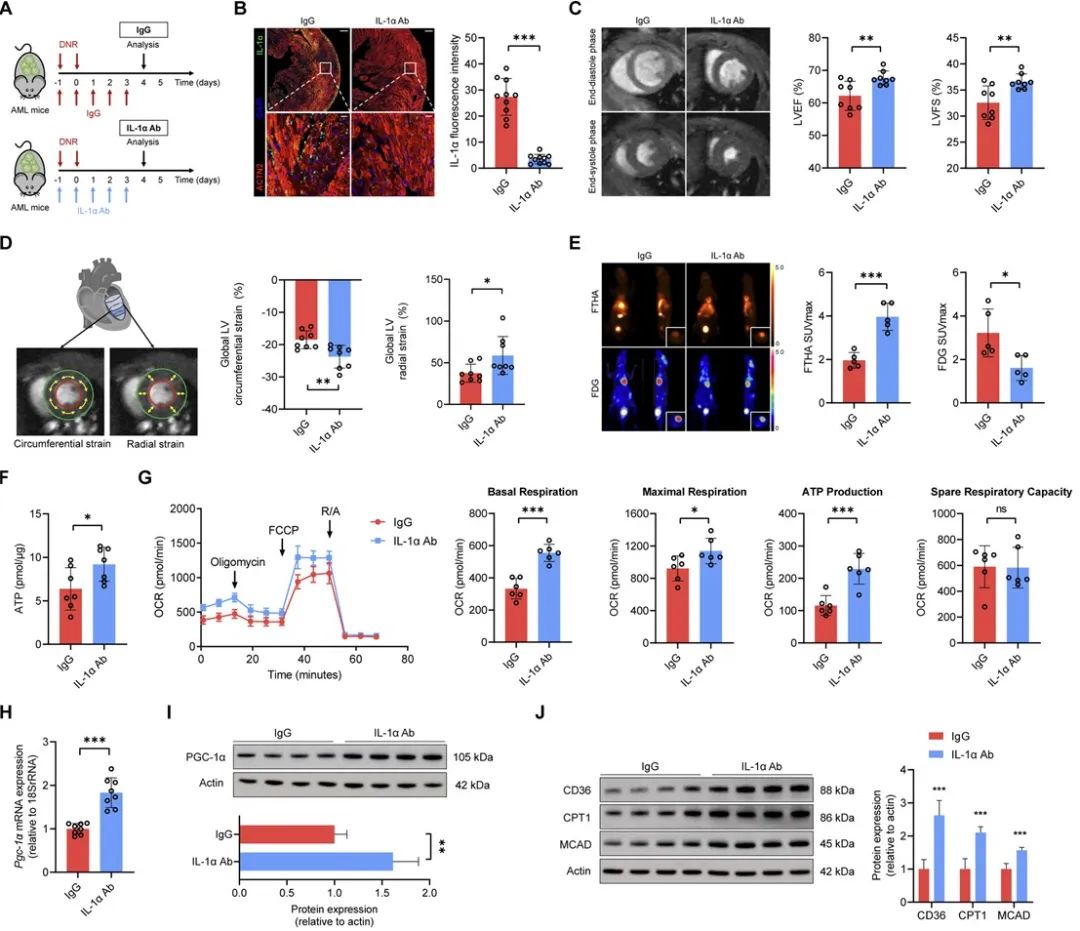
最后,研究人员证实中和抗体阻断IL-1α可减轻化疗的心脏毒性,且不影响化疗效果。
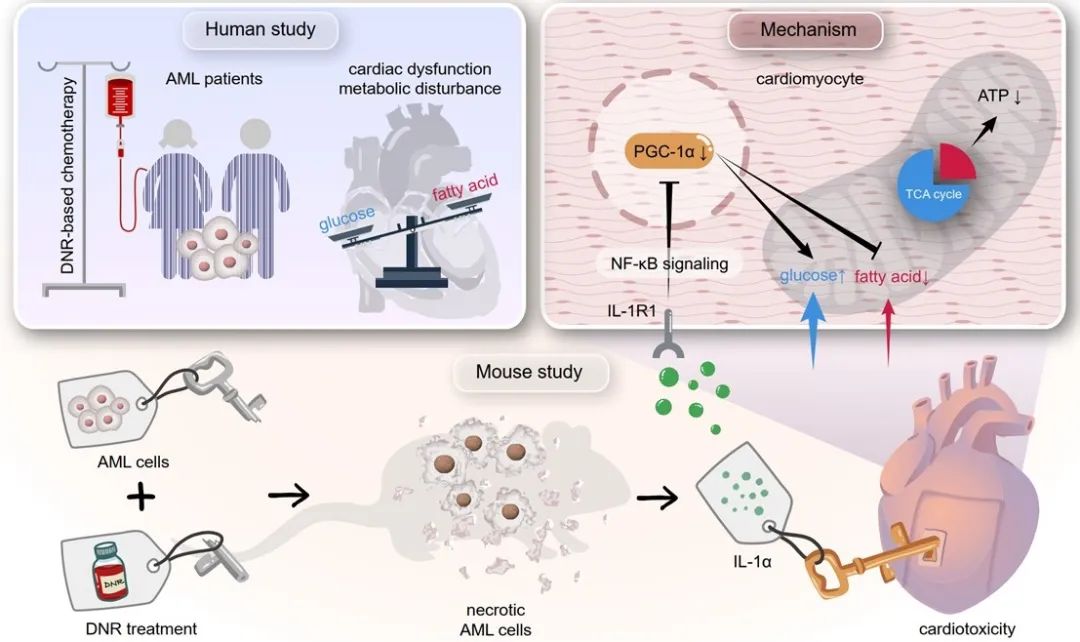
综上所述,本研究阐明了肿瘤、化疗与心脏的相互作用关系,强调了肿瘤释放的炎症因子在化疗导致的心脏损伤中发挥了重要作用,从全新的角度阐释了蒽环类化疗药物的心脏毒性机制,对于预防和缓解儿童白血病化疗期间蒽环类药物的心脏毒性具有重要的临床意义。
上海儿童医学中心张浩教授和刘一为副研究员为本文共同通讯作者。周星亮博士生、刘一为副研究员和沈熠博士生为本文共同第一作者。该研究受到国家自然科学基金、上海市科学技术委员会、上海市卫生健康委员会和上海市地方高水平大学创新研究团队的资助。
原文链接:
https://doi.org/10.1093/eurheartj/ehae188