在骨科领域,锌基可生物降解材料具有优异的机械性能、成骨和抗菌生物活性。然而,体内和临床研究揭示了一个令人沮丧的事实,即块体锌基植入物的降解通常需要十年或更长时间,而骨修复的生理周期仅为3-6个月。在过去的几年里,基于新型可生物降解锌合金的3D打印技术迅速发展。然而,与块体材料相比,由于孔隙率和比表面积增加,由加速降解引起的过量诱导的锌毒性是锌基多孔支架的一个关键挑战。因此,了解多孔支架结构设计对支架材料降解动力学和相应生物功能的影响对促进骨组织修复至关重要。
在本研究中,北京航空航天大学王晓刚研究员、杨宏韬助理教授、北京大学郑玉峰教授和清华大学温鹏副教授等人通过骨免疫调节,在具有90%孔隙率的锌基多孔支架中实现了显著的骨向内生长。在微观尺度上,作者采用包含0.8 wt%Li的合金来产生以LiZn4和Zn相为特征的共析片状结构。这种微观结构最佳地平衡了高强度和免疫调节效果。在介观尺度上,具有纳米级粗糙度的表面图案有利于丝足类的形成和巨噬细胞的扩散。在宏观尺度上,与各向异性体心立方晶格(BCC)单元相比,各向同性最小表面G单元表现出适当的退化率和更均匀的特征。在体内,G支架在促进巨噬细胞向抗炎表型极化方面表现出更高的效率,随后导致成骨标志物显著升高、胶原沉积增加和新骨形成增强。在体外,转录组学分析揭示了巨噬细胞中JAK/STAT通路的激活,通过上调Il-4、Il-10的表达可促进成骨。相关工作以“Multiscale architecture design of 3D printed biodegradable Zn-based porous scaffolds for immunomodulatory osteogenesis”为题发表在Nature Communications。

【文章要点】
作为异物,生物材料在体内会立即被免疫系统发出信号,并引发一系列炎症反应。具有骨免疫调节特性的生物材料可以积极调节免疫细胞的行为,并在骨再生过程中促进有利的组织反应。免疫细胞在调节骨细胞功能中的重要作用使骨生物材料设计的范式转向骨免疫调节。巨噬细胞通过调节免疫反应、促进血管生成和调节成骨细胞的活性,在骨组织再生中发挥着至关重要的作用。它们与骨细胞的密切相互作用影响骨重塑和愈合。骨巨噬细胞(OsteoMacs)代表在骨骼结构中发现的一个独特的巨噬细胞亚群。可生物降解的金属在与体液接触后开始电化学反应,从而在数小时内激活先天免疫系统。巨噬细胞是最早与植入物相互作用并介导宿主异物反应的细胞之一。对于可生物降解的锌基多孔支架,材料和免疫细胞之间的相互作用及其介导的组织修复是在多个尺度上进行的。在微观层面上,二价锌离子通过SLC30/SLC39家族转运到巨噬细胞中,并受到金属硫蛋白的调节以介导锌的稳态。细胞内锌决定巨噬细胞的细胞命运,包括生存能力、吞噬能力、极化和炎症信号。在介观层面上,具有地形线索的多孔材料的丰富表面积可以作为调节巨噬细胞行为的天然平台。在宏观层面上,孔隙几何形状可以影响集体细胞行为和材料降解的时空特征。锌合金支架的降解随着孔隙率的增加而正增加,而随着孔径的增加而负增加。因此,可生物降解的锌基多孔支架的多尺度结构设计有望协调免疫细胞反应和随后的骨再生。
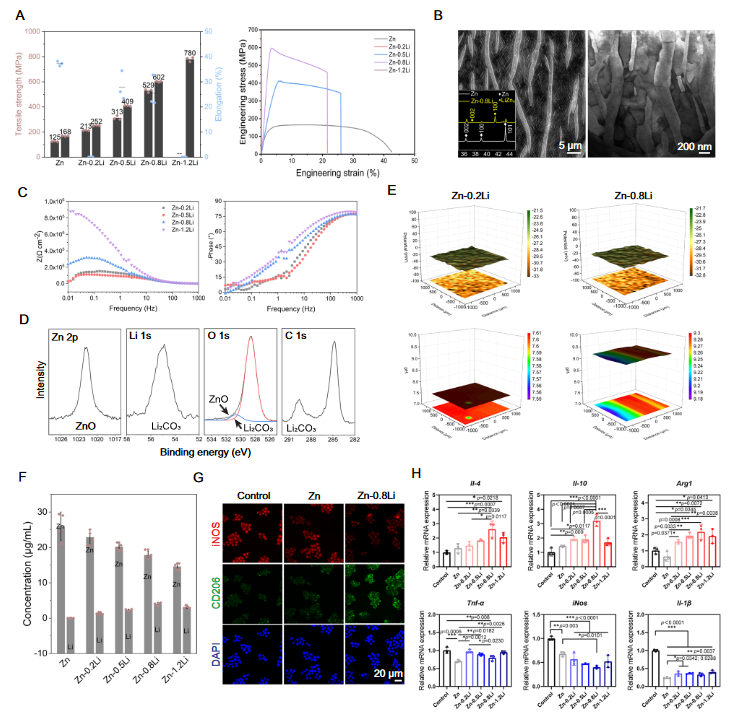
图1 设计锌基合金用于制备生物可降解骨支架
在此,为了降低锌过量毒性的风险,作者选择了高强度二元Zn-Li合金体系,并采用激光粉末床融合技术,制作了孔隙率为90%的锌基合金支架,这是迄今为止报道的孔隙率最高的支架。因此,支架的比表面积是其体积对应物的10倍。(图1)。作者还开发了超声波处理、酸蚀和电化学抛光技术,以在支架表面形成具有不同形态的微图案,而材料组成和表面图案之间的最佳组合则被进一步用于创建具有仿生最小表面几何形状(回旋体)的锌基多孔支架。
经过优化,从Zn-0.8Li合金中同时释放的Zn和Li离子显著增强了巨噬细胞的极化,有利于促进再生表型。Zn-0.8Li合金的独特结构,其特征是LiZn4和Zn相交替排列,层间距为200–300 nm,有利于通过电化学抛光产生纳米级波状微图案。这反过来又在早期附着过程中激活巨噬细胞,促进高扩散区域和丝足类的形成。此外,G支架以其各向异性特征和最小的表面几何形状而闻名,在体外和体内都表现出了适当的降解速率和均一行为。研究显示,G支架在一个月内表现出高效促进巨噬细胞向抗炎表型极化的行为,导致成骨标志物显著升高,胶原沉积增加,并在三个月时增强新骨形成。此外,G支架可以通过上调Il-4和Il-10的表达来激活巨噬细胞中的JAK/STAT途径,随后促进成骨(图2)。
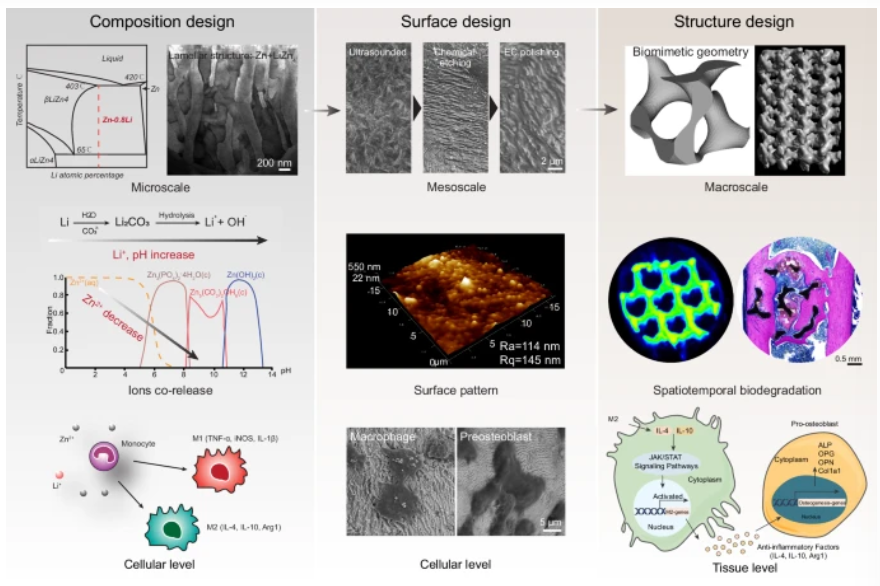
图2 免疫调节性骨生成
原文链接:
https://www.nature.com/articles/s41467-024-47189-5