[摘要] 胃癌严重威胁人类健康,尽管近年来化疗、靶向治疗和免疫治疗等新型药物研发不断取得突破,但根治性手术始终是胃癌诊疗的核心。随着标准胃癌根治手术的成型,以腹腔镜技术为代表的微创外科治疗技术的进步,进展期胃癌围手术期综合治疗模式的确定,以及胃癌精准外科理念的形成和初步实践,胃癌手术治疗取得了巨大进步。个体化和精准化胃癌外科治疗理念深入人心。安全、有效、精准、微创始终是胃癌外科医师需牢牢把握的学科发展的内在规律。为帮助年轻医师更好的成长,本文总结胃癌诊疗的最新进展,并对未来的发展趋势进行展望。
[关键词] 胃癌;外科治疗;进展;趋势
[Abstract] Gastric cancer poses a serious threat to the health of people. Despite the continuous breakthroughs in the development of new drugs such as chemotherapy, targeted therapy and immunotherapy in recent years, radical surgery remains the cornerstone in the treatment of gastric cancer. With the establishment of standard gastric cancer surgery, the advancement of minimally invasive surgical techniques represented by laparoscopy, the determination of perioperative comprehensive treatment of advanced gastric cancer and the formation and initial practice of precise surgical concepts for gastric cancer, the progress of surgical treatment for gastric cancer is advancing by leaps and bounds. The concepts of individualized and optimal treatment are gradually taking root. Safety, effectiveness, precision and minimally invasive approaches have always been the inherent laws of discipline development firmly grasped by gastric cancer surgeons. In order to facilitate better growth for young doctors, the author summarized the latest developments in the diagnosis and treatment of gastric cancer and looked ahead to future trend.
[Key words] Gastric cancer; Surgical treatment; Progress; Trend
胃癌是威胁人类生命健康的常见恶性肿瘤之一,中国最新的流行病学数据[1-2]显示,2022年全国约有35.87万人罹患胃癌,26.04万人死于胃癌,中国的新发和死亡胃癌病例分别占全球的44.0%和48.6%。化疗、靶向治疗和免疫治疗等新型药物的不断研发,给胃癌的综合治疗带来诸多突破性进展,但根治性外科手术仍是当前胃癌唯一的潜在治愈性治疗手段[3]。腹腔镜、内镜和机器人等微创器械技术的发展、新型药物的研发和精准医学新技术的转化应用,推动胃癌外科治疗步入了新时代。目前,从胃癌的预防与早期筛查、微创外科理念与新技术、围手术期治疗与全病程管理,到生物医学与人工智能(artificial intelligence,AI)等前沿交叉学科的转化研究,无一不渗透到胃癌外科学科发展之中,各类新器械、新技术、新理念层出不穷,胃癌外科治疗可谓进入到百花齐放、百家争鸣的时代。但外科医师需要牢牢把握住胃癌外科诊疗的内在规律,安全、有效、精准、微创始终是核心。
1 规范化淋巴结清扫和标准胃癌根治手术的全球共识达成
自1881年Billroth在维也纳开展世界上第1例胃癌外科手术[4]以来,手术一直是胃癌治疗的主要手段。Halsted从乳腺癌手术开始所倡导的肿瘤根治性手术原则[5],被推广至胃癌外科手术,即完整切除全部病灶及清扫可能转移的淋巴结。由于胃周的淋巴脉管系统较为复杂,淋巴回流网络几乎涉及到上腹部所有重要脏器及其相应的血管,不同部位、不同浸润深度的肿瘤淋巴结转移途径又不尽相同,因此在相当长的时间里,缺少淋巴结清扫的统一标准。日本学者于20世纪70~80年代初步摸索出胃周淋巴结的转移规律,继而以分组标记的方式描述与胃癌转移相关的淋巴结,按动脉走行、分支作为解剖标志描述胃的淋巴回流系统,按照从上到下、从前到后、从小弯到大弯的顺序对各组淋巴结分别标记,最终阐明了胃周三站16组淋巴结回流系统,进而,日本第10版《胃癌处理规约》[6]正式引入了D2淋巴结清扫概念,自此D2作为标准手术被逐步推广。同期,中国学者傅培斌、陈峻青等首先开展了胃癌根治术,复旦大学附属中山医院王承棓教授亦带领团队在国内较早开展了标准胃癌根治术,并选择性施行包括腹主动脉旁淋巴结清扫(para-aortic lymph nodes disp,PAND)的扩大胃癌根治术和胃癌肝转移的肝转移灶同期切除术。相较于东方学者对D2淋巴结清扫范围理念的迅速接纳,西方学者则抱着更审慎的态度。1986年英国医学研究理事会开展了一项随机对照试验(randomized controlled trial,RCT),比较D1与D2淋巴结清扫在胃癌手术中的价值,5年的随访结果显示,无论是总生存(overall survival,OS)还是无进展生存(progression-free survival,PFS),D2组并未显示出明显的生存获益[7],但该研究高达46%的手术并发症发生率及13%的死亡率,使不少东方学者对其手术质量产生怀疑。1989年,荷兰学者开展了著名的DUTCH研究,虽然D2根治术术后死亡率仍高达10%,显著高于同期东方研究报道的0.5%~1.0%,且两组在术后5年和10年两次分析中的生存差异均无统计学意义[8],但术后15年的长期随访结果显示,D2组在胃癌相关死亡率和肿瘤局部复发率方面显示出显著的生存优势[9]。至此,东西方达成共识,以D2淋巴结清扫为核心的标准根治性手术遂成为胃癌外科治疗的基石。
至于是否开展更广泛的淋巴结清扫这一议题,医学界也进行了相应研究,如PAND(本文中腹主动脉旁淋巴结仅指16a2/b1组淋巴结),一项比较预防性PAND的RCT(JCOG9501)[10]结果显示,预防性PAND不但无法改善生存反而会增加围手术期并发症的发生率,而治疗性PAND的价值目前尚无定论。在综合治疗快速发展的大背景下,针对腹主动脉旁淋巴结转移患者在术前新辅助治疗后行PAND显示出一定价值。2014年一项前瞻性、多中心、单臂研究(JCOG0405)[11]结果显示,对合并腹主动脉旁淋巴结转移的进展期胃癌,术前予以顺铂联合替吉奥方案化疗后再行D2+PAND淋巴结清扫,R0切除率达82%,5年生存率为53%,获益显著。
食管胃连接部(esophagogastric junction,EGJ)癌的发病率近年来逐渐升高,越来越受到重视,但EGJ癌的肿瘤分型、手术路径及淋巴结清扫范围仍有争议。为此,2023年国际胃癌大会特地设置了EGJ癌相关议题,日本临床肿瘤学会(Japanese Clinical Oncology Group,JCOG)公布了多中心前瞻性研究[12]的最终结果:当食管浸润长度>2 cm时,No.110淋巴结清扫被强烈推荐;对于食管浸润长度>3 cm且≤4 cm的腺癌或鳞癌,No.106recR和No.108淋巴结清扫被弱推荐;当食管浸润长度>4 cm时,No.106recR淋巴结清扫被强烈推荐。对于cT2-4期EGJ肿瘤,不必要清扫No.4sa、No.4sb、No.4d、No.5和No.6淋巴结,尽管No.19淋巴结的转移发生率为5.2%,但其对预后影响较低,因此,在第6版推荐中,No.19淋巴结的清扫被剔除,同样情况还适用于No.111、No.112淋巴结。但该研究也存在样本量小、接受新辅助治疗患者较少等不足。在围手术期治疗逐渐标准化的背景下,接受围手术期治疗的EGJ癌患者的淋巴结清扫范围该如何界定是未来需要思考的问题[13]。
2 微创外科技术体系的建立和快速推广
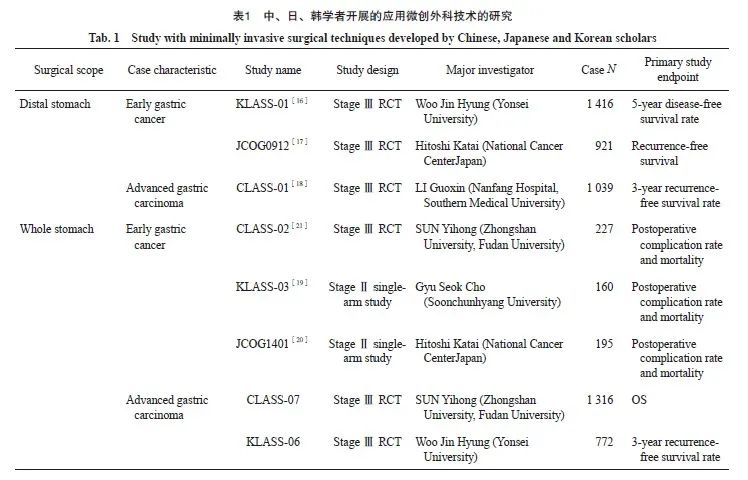
1994年日本Kitano等[14]报道了世界上第1例腹腔镜远端胃癌根治术,标志着胃癌外科治疗正式进入微创时代。相较于传统开放手术,腹腔镜手术具有解剖精细、恢复快和切口美观等优势,受到医师和患者的青睐。30年来,腹腔镜手术比例逐年升高[15],中国部分医疗机构甚至出现所有胃癌手术均为腹腔镜手术等极端情况。随着成像设备、能量平台及吻合器械的不断进步,腹腔镜手术的技术水平不断提高,辅助切口越做越小。同时,以内镜黏膜下切除(endoscopic submucosal disp,ESD)为代表的内镜技术亦快速发展,内镜治疗早期胃癌的指征不断扩大。虽然从技术层面上胃癌微创技术体系得以建立并快速推广,但需要指出的是,部分医疗机构和医师存在刻意追求外科技术而忽视手术指征的现象,既给患者带来医疗风险,生存也并未获益。微创外科技术的应用只有建立在扎实的循证医学基础上,才能使更多患者获益。为此,中、日、韩学者共同努力,通过已有医学组织(JCOG)或新成立的研究小组[中国腹腔镜胃肠外科研究组(Chinese Laparoscopic Gastrointestinal Surgery Study Group,CLASS)、韩国腹腔镜胃肠外科研究组(Korean Laparoscopic Gastrointestinal Surgery Study Group,KLASS)],开展高质量RCT,论证腹腔镜手术的安全性和有效性(表1)。于2006年率先开展的KLASS-01研究[16]和2009年开展的JCOG0912研究[17]探讨了腹腔镜远端胃癌根治术在早期胃下部癌中应用的安全性和有效性,CLASS则跨过早期远端胃癌,率先研究了腹腔镜远端胃癌根治术治疗进展期胃癌的安全性和有效性[18]。腹腔镜全胃手术的安全性率先由日、韩学者发表[19-20],中国学者开展的CLASS-02研究[21]也于2020年发表。至于腹腔镜全胃手术在进展期胃癌中的有效性研究,目前仅中国(CLASS-07)及韩国学者(KLASS-06)开展,研究仍在进行中。全腹腔镜手术、腹腔镜下纵隔淋巴结、新辅助治疗后的腹腔镜手术等领域均为当今微创外科研究的热点和难点。随着3D、4K等显像技术的进步,手术视野更清晰、解剖操作更精细,为开展复杂腹腔镜手术提供了技术支持。
机器人胃癌外科手术最早于2002年由日本Hashizume等[22]报道。相较于腹腔镜手术,机器人有着更佳的操作稳定性、灵活性和更清晰放大的3D视野,便于狭小空间内开展精细解剖、缝合打结等复杂操作,一些在腹腔镜下操作困难的手术,如保留脾脏的脾门淋巴结清扫术、消化道重建(手工缝合)及保留迷走神经的胃癌根治术等,在机器人系统里应对更加游刃有余。余佩武教授牵头的国内首个机器人胃癌手术的多中心回顾性队列研究[23]结果显示,相较于腹腔镜手术,机器人手术具有术中出血量少(126.8 mL vs 142.5 mL,P<0.001)、淋巴结清扫数目多(32.5 vs 30.7,P<0.001)的优势;在术后并发症方面,机器人手术总体并发症发生率低于腹腔镜手术(12.6% vs 15.2%,P=0.023),但两者在术后Ⅱ级以上严重并发症(2.5% vs 2.9%)发生率方面差异无统计学意义;远期疗效方面,两种手术方式的术后3和5年无病生存率差异无统计学意义,这为进一步开展高质量RCT奠定了基础。JCOG在正式开展机器人胃癌根治术的Ⅲ期研究JCOG1907(MONA LISA study)之前,开展了一项预试验(Pre JCOG1907)[24],结果显示,术后C~D分级Ⅱ级以上并发症发生率腹腔镜组较机器人组更高(19.7% vs 8.8%,P=0.02)。
目前胃癌微创外科治疗模式深入人心,手术方式、质控体系建设逐渐规范化,手术质量得到显著提升。然而外科医师必须时刻谨记技术服务于理念,为不同患者个体化地选择合适的微创外科技术,切忌盲目进行微创手术。
3 局部进展期胃癌围手术期综合治疗理念逐步形成
有研究[25]显示,对于早期胃癌患者,根治性手术后5年OS率高达90%以上,然而,对于局部进展期胃癌患者,接近一半的患者生存期不足5年。《中国胃肠肿瘤外科联盟数据报告(2014—2016)》[26]显示,中国进展期胃癌患者占总病例数的70%以上。如何进一步改善患者预后,除前面提到的JCOG9501研究[10],日本学者还进行了一些扩大手术范围及淋巴结清扫范围的尝试,JCOG9502研究[27]结果显示,左胸腹联合途径清扫纵隔淋巴结不能改善患者的术后生存,JCOG0110研究[28]和JCOG1001研究[29]结果显示,联合脾脏切除术和网膜囊切除术不仅不能提高进展期胃癌的远期疗效,反而会增加术后并发症的发生风险。ACTS-GC研究[30]和CLASSIC研究[31]奠定了S-1、卡培他滨联合奥沙利铂(XELOX)在进展期胃癌术后辅助治疗中的地位,研究结果显示,上述两个方案能显著提高进展期胃癌患者的5年OS率,但随着分期进展,患者的生存获益逐渐减少。西方学者始终认为肿瘤为全身性疾病,早期肿瘤即有可能播散全身,术前系统治疗可针对早期播散病灶,基于此理论,MAGIC研究[32]和FLOT4研究[33]为其代表。这一理念逐渐影响到中、韩学者,RESOLVE研究[34]和PRODIGY研究[35]为中、韩同期开展的比较围手术期化疗与单纯术后辅助化疗有效性的多中心RCT,结果显示,无论围手术期S-1联合奥沙利铂(SOX)方案,还是术前S-1、多西他赛联合奥沙利铂(DOS)术后S-1方案,均可以显著提高局部进展期胃癌患者的长期生存率。自此,进展期胃癌治疗模式从单纯外科手术治疗转向以多学科诊疗(multi-disciplinary treatment,MDT)为特点的围手术期综合治疗模式。
近年来,随着对靶向治疗和免疫治疗的深入了解,围手术期治疗方案已经从单一化疗发展到化疗与靶向治疗、免疫治疗的结合。ToGA试验[36]证实,曲妥珠单抗联合以顺铂为基础的化疗可以延长晚期胃癌患者的中位OS,但这一效果仅限于人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性患者。自2011年起,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)胃癌治疗指南推荐在诊断时进行HER2检测。然而,由于中国胃癌患者HER2阳性率较低及耐药问题,新兴靶点如Claudin 18.2等获得了更多关注。2023年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会上,中国学者报告的GLOW研究初步结果[37]显示,靶向Claudin 18.2的治疗能显著延长患者的中位PFS和中位OS。目前,靶向治疗主要用于姑息治疗,在围手术期一线治疗方面仅有HER-FLOT[38]、NEOHX[39]等小规模研究开展,尚无大规模Ⅲ期RCT报道。
免疫治疗通过激活机体的抗肿瘤免疫系统来控制和清除肿瘤。目前,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)、T细胞转移疗法等是免疫治疗中研究最广泛的领域。CheckMate 649研究[40]和Keynote-062研究[41]将免疫治疗提升为姑息一线治疗方案,在2023年ASCO年会上,CheckMate 649研究发布了长达4年的长期随访结果[42],有接近25%的晚期患者术后生存超过4年,长期疗效显著。ORIENT-16研究结果[43]显示,信迪利单抗联合化疗在OS和PFS方面均优于单纯化疗。然而,ATTRACTION-5研究[44]未达到主要研究终点,提示术前免疫治疗的潜在价值及其在围手术期一线治疗中的作用仍需进一步研究。Keynote-585研究[45]和MATTERHORN研究[46]旨在探索免疫治疗在围手术期一线治疗中的作用,中期结果显示,免疫治疗有助于提高病理学缓解率。Keynote-811研究[47]探讨了免疫治疗联合HER2靶向治疗在晚期胃癌中的应用,显示出提高OS的趋势。但也要注意到,与传统化疗相比,免疫治疗可能带来免疫相关不良反应,常见的累及器官包括皮肤、胃肠道、肝脏、内分泌器官和肺等。发生率及类型与药物种类相关,例如,细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抗体的不良反应发生率(53.8%)远高于靶向程序性死亡蛋白-1(programmed death-1,PD-1)抗体(26.5%)或程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)抗体(17.1%),CTLA-4阻断治疗后,所有级别的结肠炎、垂体炎和皮疹更为常见,而PD-1/PD-L1阻断治疗后,肺炎、甲状腺功能减退、关节痛和白癜风更常见。临床医师要时刻警惕免疫治疗相关不良反应的发生。
4 精准医学时代的精准外科发展趋势
近年来,精准医学理念逐步深入人心,胃癌治疗步入精准外科时代,精准理念从狭义的以生物信息学为基础的肿瘤精准靶向治疗,转向广义的以精准分期为指导、个体化诊疗为核心的精准外科治疗。这要求必须始终坚持在胃癌外科诊疗全病程中践行精准理念:术前做到精准肿瘤学评估及基线评估,精准分期,根据分期进行个体化治疗。对于早期胃癌,积极开展微创外科手术,既要根治,又要保全功能,如功能保留外科手术(近端胃切除术、保留幽门手术)在特定人群的临床实践;对于进展期胃癌,要联合各医疗科室,践行MDT理念,建立以分子诊断、分子分型为基础的围手术期综合治疗方案,如靶向治疗和免疫治疗在某些特定分子亚型人群中的应用;对于晚期肿瘤,外科医师也可以发挥一定作用。AIO-FLOT3研究[48]对含有单个不可根治切除因素的晚期胃癌患者,通过积极的转化治疗后接受根治性手术,中位OS可达31.3个月。合适的转化治疗,并施加根治性外科手术可以使部分晚期胃癌患者获得长期生存。
AI目前已广泛应用于医学的各项领域,以机器学习、深度学习为代表的新一代AI技术更是在图像识别领域表现出远超人类的分析能力,在指导临床诊疗中应用前景巨大。目前有研究显示,AI可提高内镜下对早期胃癌的识别率,避免漏诊、误诊[49];AI与计算机体层成像(computed tomography,CT)结合,可协助放射科医师提高肿瘤分期精准率,特别是淋巴结转移状态评估[50],甚至可以发现部分隐匿性腹膜转移患者[51];AI应用于辅助病理学诊断,具有成本低、效率高等特点,在基于传统H-E染色切片病理学检查预测微卫星不稳定性(microsatellite instability,MSI)及EB病毒状态方面具有巨大应用潜力[52]。此外,AI还可以与二代测序技术相结合,筛选药物靶点,寻找预后预测标志物[53]。AI助力胃癌精准外科决策领域的应用方兴未艾,但要将其应用于临床,并经受住实践的考验,得到临床医师的认可,更早更好地造福于患者,仍有很长的路要走。
导航辅助外科手术是一个崭新领域,是指通过术中超声、CT、磁共振成像(magnetic resonance imaging,MRI)、内镜、吲哚菁绿荧光及虚拟现实(visual reality,VR)等方式,为术中病灶定位、解剖层面显示、复杂解剖变异及淋巴结清扫等提供精准导航。目前在胃癌外科中应用成熟的主要是吲哚菁绿荧光、纳米炭示踪等导航成像技术,一部分显色剂可被局部肿瘤组织吸收而显色,另一部分被淋巴系统吸收、引流,由于淋巴系统转运缓慢,显色剂可在淋巴系统内存在较长时间,从而实现肿瘤定位、淋巴引流示踪及组织血运观察等多重功能。FUGES-012研究[54-55]已初步证实,使用吲哚菁绿荧光示踪不仅能显著提高淋巴结清扫总数目,患者也可能生存获益,CLASS-11研究将继续探究吲哚菁绿荧光示踪应用于胃癌手术的有效性。但如何精准地识别转移的淋巴结,避免过度清扫非转移的淋巴结,目前临床上尚无可选的分子示踪剂,吲哚菁绿成像效果受组织深度影响,对于较大或深部的肿瘤,成像效果可能受限,目前仍处于临床探索阶段。VR技术可将术前腹部影像学数据重建的三维虚拟画面投射到裸眼现实的真实手术场景中,这要求目标器官具有较为固定的配准标记,且手术过程中能保持相对稳定的形态和相对固定的位置。在胃癌根治手术中,胰腺的解剖位置相对固定,D2淋巴结清扫以胰腺上缘为核心,因此以胰腺为参照物进行三维虚拟画面投射具有可操作性,但光学跟踪引导精度不足、图像引导配准起始变化参数无法最优约束等技术难题限制了其在临床上的广泛应用。
5 总结
近年来,随着淋巴结清扫和标准胃癌根治术的共识初步达成,胃癌根治术具有统一的评价体系和质控标准;微创外科技术体系的建立和快速推广,使更多患者享受到微创手术带来的便利,但要警惕盲目追求极致微创而忽视手术安全性、疗效确切性。局部进展期胃癌围手术期综合治疗理念逐步形成,给更多的以往无法根治的胃癌患者带来新希望。进入精准医学时代,胃癌外科呈现以精准分期为指导、个体化治疗为核心的精准外科发展趋势,新技术从各层面助力于胃癌的诊断、分期及治疗。在可预见的未来,胃癌外科将更为精准化、智能化、微创化,免疫治疗及靶向治疗等辅助治疗效果的提升将进一步使患者获益。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
汪学非:确定文章框架,文章审阅,经费支持;
周鹏:文章主题撰写,文献综述;
唐兆庆:文章审阅,文笔润色。
[参考文献]
[1]ZHENG R S, CHEN R, HAN B F, et al. Cancer incidence and mortality in China, 2022[J]. Zhonghua Zhong Liu Za Zhi, 2024, 46: 221-231.
[2]YANG W J, ZHAO H P, YU Y, et al. Updates on global epidemiology, risk and prognostic factors of gastric cancer[J]. World J Gastroenterol, 2023, 29(16): 2452-2468.
[3]SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. Lancet, 2020, 396 (10251): 635-648.
[4]SATO H, NOSHIRO H. Report about the present condition of Billroth’s stomach specimens[J]. Gastric Cancer, 2019, 22(6): 1310-1311.
[5]GHOSSAIN A, GHOSSAIN M A. History of mastectomy before and after Halsted[J]. J Med Liban, 2009, 57(2): 65-71.
[6]日本胃癌学会. 胃癌处理规约[M]. 10版. 东京: 金原出版株式会社, 1979.
Japanese Gastric Cancer Association. Gastric cancer management protocol[M]. 10 edition. Tokyo: Kanehara Publishing Co., LTD, 1979.
[7]CUSCHIERI A, FAYERS P, FIELDING J, et al. Postoperative morbidity and mortality after D1 and D2 reps for gastric cancer: preliminary results of the MRC randomised controlled surgical trial. The Surgical Cooperative Group[J]. Lancet, 1996, 347(9007): 995-999.
[8]BONENKAMP J J, HERMANS J, SASAKO M, et al. Extended lymph-node disp for gastric cancer[J]. N Engl J Med, 1999, 340(12): 908-914.
[9]SONGUN I, PUTTER H, KRANENBARG E M, et al. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial[J]. Lancet Oncol, 2010, 11(5): 439-449.
[10]SASAKO M, SANO T, YAMAMOTO S, et al. D2 lymphadenectomy alone or with para-aortic nodal disp for gastric cancer[J]. N Engl J Med, 2008, 359(5): 453-462.
[11]TSUBURAYA A, MIZUSAWA J, TANAKA Y, et al. Neoadjuvant chemotherapy with S-1 and cisplatin followed by D2 gastrectomy with para-aortic lymph node disp for gastric cancer with extensive lymph node metastasis[J]. Br J Surg, 2014, 101(6): 653-660.
[12]KUROKAWA Y, TAKEUCHI H, DOKI Y, et al. Mapping of lymph node metastasis from esophagogastric junction tumors: a prospective nationwide multicenter study[J]. Ann Surg, 2021, 274(1): 120-127.
[13]徐泽宽, 李 铮, 徐 皓. 从2023年国际胃癌大会看胃癌外科治疗进展与发展趋势[J]. 中国实用外科杂志, 2023, 43(9): 971-974.
XU Z K, LI Z, XU H. Progress and trends of surgical treatment for gastric cancer from the International Gastric Cancer Congress 2023(IGCC 2023)[J]. Chin J Pract Surg, 2023, 43(9): 971-974.
[14]KITANO S, ISO Y, MORIYAMA M, et al. Laparoscopy-assisted billroth Ⅰ gastrectomy[J]. Surg Laparosc Endosc, 1994, 4(2): 146-148.
[15]YOUNG K, MO H, LEE H H, et al. Laproscopic surgery for gastric cancer[M]//Management of Gastric Cancer. InTech, 2011.
[16]KIM H H, HAN S U, KIM M C, et al. Effect of laparoscopic distal gastrectomy vs open distal gastrectomy on long-term survival among patients with stage Ⅰ gastric cancer: the KLASS-01 randomized clinical trial[J]. JAMA Oncol, 2019, 5(4): 506-513.
[17] KATAI H, MIZUSAWA J, KATAYAMA H, et al. Survival outcomes after laparoscopy-assisted distal gastrectomy versus open distal gastrectomy with nodal disp for clinical stage IA or IB gastric cancer (JCOG0912): a multicentre, noninferiority, phase 3 randomised controlled trial[J]. Lancet Gastroenterol Hepatol, 2020, 5(2): 142-151.
[18] YU J, HUANG C M, SUN Y H, et al. Effect of laparoscopic vs open distal gastrectomy on 3-year disease-free survival in patients with locally advanced gastric cancer: the CLASS-01 randomized clinical trial[J]. JAMA, 2019, 321(20): 1983-1992.
[19] HYUNG W J, YANG H K, HAN S U, et al. A feasibility study of laparoscopic total gastrectomy for clinical stage Ⅰ gastric cancer: a prospective multi-center phase Ⅱ clinical trial, KLASS 03[J]. Gastric Cancer, 2019, 22(1): 214-222.
[20] KATAI H, MIZUSAWA J, KATAYAMA H, et al. Single-arm confirmatory trial of laparoscopy-assisted total or proximal gastrectomy with nodal disp for clinical stage Ⅰ gastric cancer: Japan Clinical Oncology Group study JCOG1401[J]. Gastric Cancer, 2019, 22(5): 999-1008.
[21] LIU F L, HUANG C M, XU Z K, et al. Morbidity and mortality of laparoscopic vs open total gastrectomy for clinical stage Ⅰ gastric cancer: the CLASS02 multicenter randomized clinical trial[J]. JAMA Oncol, 2020, 6(10): 1590-1597.
[22] HASHIZUME M, KONISHI K, TSUTSUMI N, et al. A new era of robotic surgery assisted by a computer-enhanced surgical system[J]. Surgery, 2002, 131(1 Suppl): S330-S333.
[23] LI Z Y, ZHOU Y B, LI T Y, et al. Robotic gastrectomy versus laparoscopic gastrectomy for gastric cancer: a multicenter cohort study of 5 402 patients in China[J]. Ann Surg, 2023, 277(1): e87-e95.
[24] OJIMA T, NAKAMURA M, HAYATA K, et al. Short-term outcomes of robotic gastrectomy vs laparoscopic gastrectomy for patients with gastric cancer: a randomized clinical trial[J]. JAMA Surg, 2021, 156(10): 954-963.
[25] ZONG L, ABE M, SETO Y, et al. The challenge of screening for early gastric cancer in China[J]. Lancet, 2016, 388(10060): 2606.
[26] 中国胃肠肿瘤外科联盟. 中国胃肠肿瘤外科联盟数据报告(2014—2016)[J]. 中国实用外科杂志, 2018, 38(1): 90-93.
China Gastrointestinal Cancer Surgery Union. Data report of China Gastrointestinal Cancer Surgery Union (2014-2016)[J]. Chin J Pract Surg, 2018, 38(1): 90-93.
[27] SASAKO M , SANO T, YAMAMOTO S, et al. Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomised controlled trial[J]. Lancet Oncol, 2006, 7(8): 644-651.
[28] SANO T, SASAKO M, MIZUSAWA J, et al. Randomized controlled trial to evaluate splenectomy in total gastrectomy for proximal gastric carcinoma[J]. Ann Surg, 2017, 265(2): 277-283.
[29] KUROKAWA Y, DOKI Y, MIZUSAWA J, et al. Bursectomy versus omentectomy alone for resectable gastric cancer (JCOG1001): a phase 3, open-label, randomised controlled trial[J]. Lancet Gastroenterol Hepatol, 2018, 3(7): 460-468.
[30] SAKURAMOTO S, SASAKO M, YAMAGUCHI T, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine[J]. N Engl J Med, 2007, 357(18): 1810-1820.
[31] BANG Y J, KIM Y W, YANG H K, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial[J]. Lancet, 2012, 379(9813): 315-321.
[32] CUNNINGHAM D, ALLUM W H, STENNING S P, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. N Engl J Med, 2006, 355(1): 11-20.
[33] AL-BATRAN S E, HOMANN N, PAULIGK C, et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial[J]. Lancet, 2019, 393(10184): 1948-1957.
[34] ZHANG X T, LIANG H, LI Z Y, et al. Perioperative or postoperative adjuvant oxaliplatin with S-1 versus adjuvant oxaliplatin with capecitabine in patients with locally advanced gastric or gastro-oesophageal junction adenocarcinoma undergoing D2 gastrectomy (RESOLVE): an open-label, superiority and non-inferiority, phase 3 randomised controlled trial[J]. Lancet Oncol, 2021, 22(8): 1081-1092.
[35] KANG Y K, YOOK J H, PARK Y K, et al. PRODIGY: a phase Ⅲ study of neoadjuvant docetaxel, oxaliplatin, and S-1 plus surgery and adjuvant S-1 versus surgery and adjuvant S-1 for resectable advanced gastric cancer[J]. J Clin Oncol, 2021, 39(26): 2903-2913.
[36] BANG Y J, VAN CUTSEM E, FEYEREISLOVA A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. Lancet, 2010, 376(9742): 687-697.
[37] SHAH M A, SHITARA K, AJANI J A, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial[J]. Nat Med, 2023, 29(8): 2133-2141.
[38] HOFHEINZ R D, HEGEWISCH-BECKER S, KUNZMANN V, et al. Trastuzumab in combination with 5-fluorouracil, leucovorin, oxaliplatin and docetaxel as perioperative treatment for patients with human epidermal growth factor receptor 2-positive locally advanced esophagogastric adenocarcinoma: a phase Ⅱ trial of the Arbeitsgemeinschaft Internistische Onkologie Gastric Cancer Study Group[J]. Int J Cancer, 2021, 149(6): 1322-1331.
[39]RIVERA F, IZQUIERDO-MANUEL M, GARCÍA-ALFONSO P, et al. Perioperative trastuzumab, capecitabine and oxaliplatin in patients with HER2-positive resectable gastric or gastro-oesophageal junction adenocarcinoma: NEOHX phase Ⅱ trial[J]. Eur J Cancer, 2021, 145: 158-167.
[40]JANJIGIAN Y Y, SHITARA K, MOEHLER M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40.
[41]SHITARA K, VAN CUTSEM E, BANG Y J, et al. Efficacy and safety of pembrolizumab or pembrolizumab plus chemotherapy vs chemotherapy alone for patients with first-line, advanced gastric cancer: the KEYNOTE-062 phase 3 randomized clinical trial[J]. JAMA Oncol, 2020, 6(10): 1571-1580.
[42]SHITARA K, MOEHLER M H, AJANI J A, et al. Nivolumab (NIVO)+ chemotherapy (chemo) vs chemo as first-line (1L) treatment for advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma (GC/GEJC/EAC): 4 year (yr) follow-up of CheckMate 649[C]. Chicago: ASCO, 2024.
[43]XU J M, JIANG H P, PAN Y Y, et al. Sintilimab plus chemotherapy for unresectable gastric or gastroesophageal junction cancer: the ORIENT-16 randomized clinical trial[J]. JAMA, 2023, 330(21): 2064-2074.
[44]TERASHIMA M, KANG Y K, KIM Y W, et al. ATTRACTION-5: a phase 3 study of nivolumab plus chemotherapy as postoperative adjuvant treatment for pathological stage Ⅲ (pStage Ⅲ) gastric or gastroesophageal junction (G/GEJ) cancer[J]. J Clin Oncol, 2023, 41(16_suppl): 4000.
[45]SHITARA K, RHA S Y, WYRWICZ L S, et al. Neoadjuvant and adjuvant pembrolizumab plus chemotherapy in locally advanced gastric or gastro-oesophageal cancer (KEYNOTE-585): an interim analysis of the multicentre, double-blind, randomised phase 3 study[J]. Lancet Oncol, 2024, 25(2): 212-224.
[46]JANJIGIAN Y Y, AL-BATRAN S E, WAINBERG Z A, et al. Pathological complete response (pCR) to 5-fluorouracil, leucovorin, oxaliplatin and docetaxel (FLOT) with or without durvalumab (D) in resectable gastric and gastroesophageal junction cancer (GC/GEJC): subgroup analysis by region from the phase 3, randomized, double-blind MATTERHORN study[J]. J Clin Oncol, 2024, 42(3_suppl): LBA246.
[47]JANJIGIAN Y Y, KAWAZOE A, BAI Y X, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial[J]. Lancet, 2023, 402(10418): 2197-2208.
[48]AL-BATRAN S E, HOMANN N, PAULIGK C, et al. Effect of neoadjuvant chemotherapy followed by surgical rep on survival in patients with limited metastatic gastric or gastroesophageal junction cancer: the AIO-FLOT3 trial[J]. JAMA Oncol, 2017, 3(9): 1237-1244.
[49]LUO H Y, XU G L, LI C F, et al. Real-time artificial intelligence for detection of upper gastrointestinal cancer by endoscopy: a multicentre, case-control, diagnostic study[J]. Lancet Oncol, 2019, 20(12): 1645-1654.
[50]DONG D, FANG M J, TANG L, et al. Deep learning radiomic nomogram can predict the number of lymph node metastasis in locally advanced gastric cancer: an international multicenter study[J]. Ann Oncol, 2020, 31(7): 912-920.
[51]DONG D, TANG L, LI Z Y, et al. Development and validation of an individualized nomogram to identify occult peritoneal metastasis in patients with advanced gastric cancer[J]. Ann Oncol, 2019, 30(3): 431-438.
[52]SUNDAR R, BARR KUMARAKULASINGHE N, HUAK CHAN Y, et al. Machine-learning model derived gene signature predictive of paclitaxel survival benefit in gastric cancer: results from the randomised phase Ⅲ SAMIT trial[J]. Gut, 2022, 71(4): 676-685.
[53]KATHER J N, PEARSON A T, HALAMA N, et al. Deep learning can predict microsatellite instability directly from histology in gastrointestinal cancer[J]. Nat Med, 2019, 25(7): 1054-1056.
[54]CHEN Q Y, XIE J W, ZHONG Q, et al. Safety and efficacy of indocyanine green tracer-guided lymph node disp during laparoscopic radical gastrectomy in patients with gastric cancer: a randomized clinical trial[J]. JAMA Surg, 2020, 155(4): 300-311.
[55]CHEN Q Y, ZHONG Q, LIU Z Y, et al. Indocyanine green fluorescence imaging-guided versus conventional laparoscopic lymphadenectomy for gastric cancer: long-term outcomes of a phase 3 randomised clinical trial[J]. Nat Commun, 2023, 14(1): 7413.